修回日期: 2010-09-17
接受日期: 2010-09-27
在线出版日期: 2010-11-08
目的: 研究缺氧对肝癌血管生成拟态(vasculogenic mimicry, VM)的影响及其可能机制.
方法: 建立基质胶Matrigel三维培养体系, 观察高转移人肝癌细胞系MHCC97-H在常氧(常氧组)和缺氧(缺氧组)条件下形成VM的差异; 应用RT-PCR和Western blot技术检测两组缺氧诱导因子-1α(HIF-1α)、基质金属蛋白酶(matrix metalloproteinase, MMP)-2和MMP-9的表达. 选择151例肝癌组织标本, 免疫组织化学方法检测VM是否存在及HIF-1α、MMP-2和MMP-9的表达.
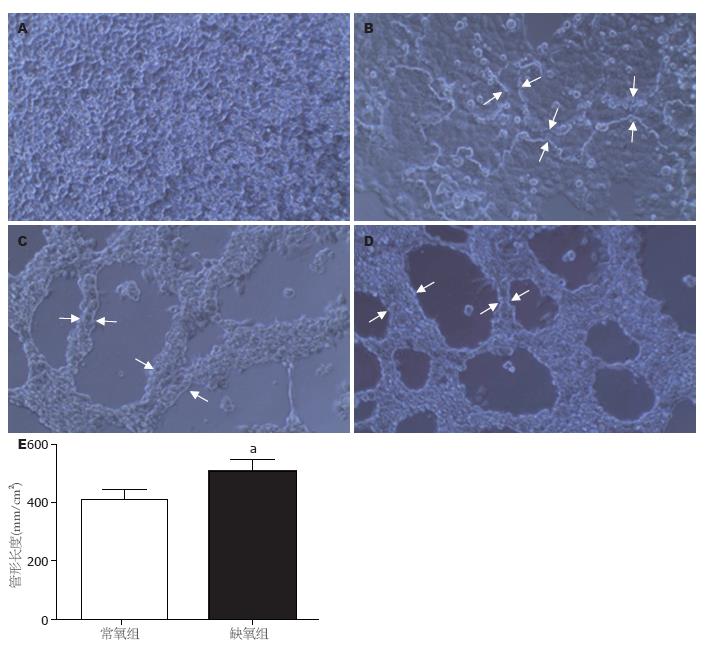
结果: 三维培养48 h, 缺氧组能形成基质型VM或管形VM, 而常氧组不形成基质型VM或形成较短的管形VM. 缺氧组HIF-1α、MMP-2和MMP-9 mRNA和蛋白表达水平明显较常氧组高(mRNA: 0.70±0.05 vs 0.51±0.10, P = 0.03; 0.90±0.09 vs 0.67±0.09, P = 0.013; 0.64±0.10 vs 0.42±0.07, P = 0.01; 蛋白: 0.52±0.09 vs 0.41±0.09, P = 0.035; 0.63±0.11 vs 0.50±0.11, P = 0.023; 0.50±0.14 vs 0.38±0.09, P = 0.008). 151例肝癌组织标本中31例存在VM, 存在VM的标本HIF-1α、MMP-2和MMP-9免疫组织化学染色综合得分较不存在VM的标本高(4.5±1.6 vs 3.4±1.7, P = 0.001; 4.5±1.6 vs 3.4±1.7, P = 0.030; 3.9±1.9 vs 2.9±1.8, P = 0.007).
结论: 缺氧能促进肝癌VM的形成, 诱导HIF-1α、MMP-2和MMP-9表达可能是其作用机制之一.
引文著录: 刘文斌, 许戈良, 荚卫东, 李建生, 马金良, 葛勇胜, 任维华, 余继海, 王伟, 胡晔. 缺氧对肝癌血管生成拟态的影响及其机制. 世界华人消化杂志 2010; 18(31): 3294-3300
Revised: September 17, 2010
Accepted: September 27, 2010
Published online: November 8, 2010
AIM: To investigate the effect of hypoxia on vasculogenic mimicry (VM) formation in hepatocellular carcinoma (HCC) and to explore possible mechanisms involved.
METHODS: A three-dimensional cell culture system for human HCC cell line MHCC97-H was established to observe VM formation under normoxic and hypoxic conditions. Semi-quantitative reverse transcription-polymerase chain reaction (RT-PCR) and Western blot were used to detect the effect of hypoxia on the mRNA and protein expression of hypoxic inducible factor-1α (HIF-1α), matrix metalloproteinase (MMP)-2 and MMP-9, respectively. Immunohistochemistry was used to identify patterned matrix VM and investigate the expression of HIF-1α, MMP-2 and MMP-9 in 151 HCC samples.
RESULTS: Patterned matrix VM or tubular VM was produced under hypoxic conditions, while cells cultured under normoxic conditions for 48 h failed to form patterned matrix VM or formed shorter tubular VM. After cells were cultured for 48 h, the mRNA and protein expression levels of HIF-1α, MMP-2 and MMP-9 were significantly higher under hypoxia than under normoxia (mRNA: 0.70 ± 0.05 vs 0.51 ± 0.10, 0.90 ± 0.09 vs 0.67 ± 0.09, 0.64 ± 0.10 vs 0.42 ± 0.07, P = 0.03, 0.013, 0.01; protein; 0.52 ± 0.09 vs 0.41 ± 0.09, 0.63 ± 0.11 vs 0.50 ± 0.11, 0.50 ± 0.14 vs 0.38 ± 0.09, P = 0.035, 0.023, 0.008). Thirty-one of 151 HCC samples exhibited evidence of patterned matrix VM. The staining intensity of HIF-1α, MMP-2 and MMP-9 expression was significantly higher in the VM group than in the non-VM group (4.5 ± 1.6 vs 3.4 ± 1.7, 4.5 ± 1.6 vs 3.4 ± 1.7, 3.9 ± 1.9 vs 2.9 ± 1.8, P = 0.001, 0.030, 0.007).
CONCLUSION: Hypoxia can induce VM formation in HCC by regulating the expression of HIF-1α, MMP-2 and MMP-9.
- Citation: Liu WB, Xu GL, Jia WD, Li JS, Ma JL, Ge YS, Ren WH, Yu JH, Wang W, Hu Y. Hypoxia promotes vasculogenic mimicry formation in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2010; 18(31): 3294-3300
- URL: https://www.wjgnet.com/1009-3079/full/v18/i31/3294.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i31.3294
血管生成拟态(vasculogenic mimicry, VM)是Maniotis等[1]于1999年发现的一种新的微循环模式, 即在侵袭性黑色素瘤中, 肿瘤细胞获得内皮细胞特性, 形成能传导血液的血管样结构, 这一过程独立于经典的血管生成和内皮细胞增殖. 此后, VM在恶性食管间质瘤、乳癌、胶质瘤、结直肠癌和肝癌等肿瘤中均有报道[2-7]. VM在肿瘤生物学中可能具有十分重要的意义[2,6-8]. 然而, 形成VM的机制目前还不清楚. 缺氧诱导因子-1α(hypoxic inducible factor-1α, HIF-1α)、基质金属蛋白酶(matrix metalloproteinase, MMP)-2或MMP-9可能与卵巢癌、黑色素瘤等肿瘤VM形成具有一定的关系[9-11]. 本课题采用三维培养模型, 观察常、缺氧条件下肝癌细胞VM形成以及HIF-1α、MMP-2和MMP-9表达的差异, 并结合肝癌组织VM以及HIF-1α、MMP-2和MMP-9免疫组织化学检测, 以研究缺氧对肝癌VM形成的影响及其可能机制.
高转移人肝癌细胞系MHCC97-H购于复旦大学中山医院肝癌研究所, 高糖DMEM培养基及胎牛血清购自美国Hyclone公司, 基质胶Matrigel购自美国BD公司, TRIzol购自美国Invitrogen公司, RT-PCR试剂盒购自日本TaKaRa公司, PCR引物由上海生物工程公司合成, 蛋白酶K购自美国Sigma-Aldrich公司, 鼠抗人层粘连蛋白单克隆抗体购自美国Milipore公司, 鼠抗人CD34单克隆抗体, 兔抗人HIF-1α、MMP-2、MMP-9单克隆抗体购自美国Santa Cruz公司, 二步法免疫组织化学检测试剂盒购自北京中杉生物技术公司; Western blot相关试剂、试剂盒购自碧云天生物技术研究所.
1.2.1 基质胶Matrigel三维培养: MHCC97-H于37 ℃、50 mL/L CO2及饱和湿度条件下培养在高糖DMEM培养基中, 内含100 mL/L胎牛血清、100 kU/L青霉素和100 mg/L链霉素, 取对数生长期细胞用于实验. 于24孔培养板每孔中加入200 μL Matrigel原液, 37 ℃培养箱内温育60 min, 再向每孔添加1 mL浓度为6×105个/mL的细胞悬液. 如每孔加25 μL Matrigel原液则细胞浓度为2×105个/mL. 实验分常氧组(950 mL/L空气和50 mL/L CO2)和缺氧组(10 mL/L O2, 50 mL/L CO2和940 mL/L N2), 均于37 ℃培养48 h. 使用相差显微镜进行拍照, 所摄照片用美国国立卫生研究院影像软件进行分析, 测量每张照片中血管样结构的长度(长度>200 µm被定义为血管样结构[12]), 并计算每张照片的总长度.
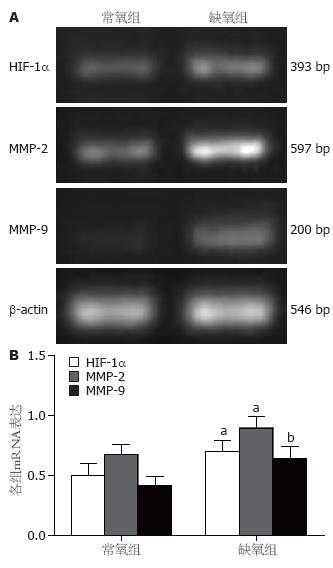
1.2.2 RT-PCR检测HIF-1α、MMP-2 和MMP-9表达: 细胞在常氧与缺氧条件下三维培养48 h, 用胰蛋白酶消化收集细胞, 以TRIzol抽提总RNA. 依照TaKaRa二步法试剂盒说明步骤反转录和PCR扩增. HIF-1α上游引物5'-GAAACTTCTGGATGCTGGTG-3', 下游引物5'-TATACGTGAATGTGGCCTGT-3', 扩增片段长度393 bp; MMP-2上游引物5'-GATGATGCCTTTGCTCG-3', 下游引物5'-AGTGGACATGGCGGTCT-3', 扩增片段长度597 bp; MMP-9上游引物5'-GAGGTTCGACGTGAAGGCGCAGATG-3', 下游引物5'-AGGTCACGTAGCCCACTTGGTC-3', 扩增片段长度175 bp; β-actin上游引物5'-GGGACCTGACTGACTACCTC-3', 下游引物5'-ACTCGTCATACTCCTGCTTG-3', 扩增片段长度546 bp. 12.5 μL PCR反应体系: 5×PCR Buffer 2.5 μL, RNase Free dH2O 7.188 μL, 上、下游引物各0.125 μL, TaKaRa Ex Taq HS 0.063 μL, cDNA 2.5 μL. PCR反应条件: 94 ℃预变性5 min, 94 ℃变性40 s, 55 ℃退火30 s, 72 ℃延伸45 s, 共35个循环后72 ℃延伸10 min. PCR反应结束后, 取5 µL PCR扩增产物在2%琼脂糖凝胶上电泳, 利用Tanon凝胶成像系统采集图像并进行吸光度测定, 以目的条带与内参照条带的灰度值比值代表目的基因mRNA的表达水平.
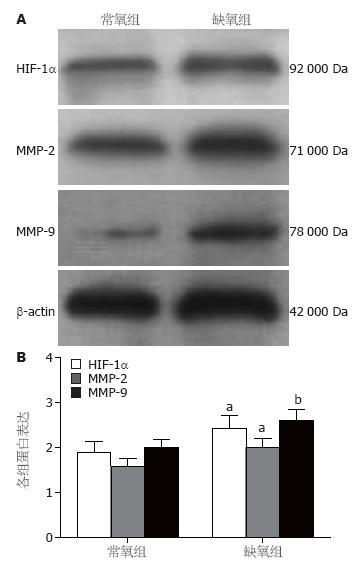
1.2.3 Western blot检测HIF-1α、MMP-2和MMP-9表达: 细胞在常氧与缺氧条件下三维培养48 h, 用胰蛋白酶消化收集细胞, 加蛋白裂解液制备总蛋白, 采用BCA法检测蛋白浓度. 总蛋白100 ℃加热变性10 min, 取50 μg样品上样检测. 10% SDS-PAGE胶电泳分离蛋白后, 半干式电转膜仪17 V 30 min将蛋白转移至PVDF膜上. 5%脱脂奶粉室温下封闭1 h, TBST漂洗3×5 min, 抗HIF-1α, 抗MMP-2, 抗MMP-9或抗β-actin单克隆抗体室温孵育1 h或4 ℃过夜. TBST漂洗3×5 min后加HRP标记的二抗(1∶5 000)室温孵育1 h. TBST漂洗3×5 min后使用ECL化学发光法显影、定影. 利用Tanon凝胶成像系统采集图像并进行吸光度测定, 以目的条带与内参照条带的灰度值比值代表目的蛋白的表达水平.
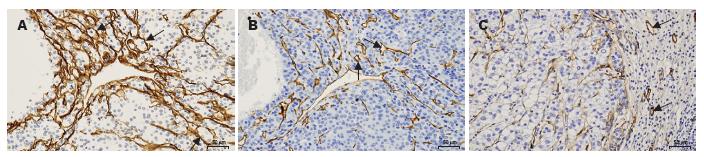
1.2.4 免疫组织化学方法检测肝癌组织中VM表达: 151例经病理证实为肝细胞癌的组织标本蜡块来自安徽省立医院肝脏外科2003-2008年手术切除标本. 对甲醛溶液固定、石蜡包埋的标本进行4 μm切片, 经二甲苯脱碏, 梯度酒精水化后以3%过氧化氢阻断内源性过氧化物酶活性. 柠檬酸盐缓冲液抗原热修复用于对CD34、HIF-1α、MMP-2和MMP-9检测. 蛋白酶K修复用于对层粘连蛋白检测. PBS冲洗后以3%山羊血清封闭20 min, 每张切片滴加50 μL一抗(层粘连蛋白1∶100、CD34 1∶100、HIF-1α 1∶300、MMP-2 1∶300、MMP-9 1∶300), 4 ℃孵育过夜或37 ℃孵育2 h. PBS冲洗3次, 滴加生物素化的山羊抗鼠二抗, DAB显色, 苏木素复染, 自来水冲洗, 返蓝, 酒精脱水, 二甲苯透明, 中性树胶封片. 结果判定: 每张切片在400倍视野下随机选择10个视野, 每个视野计数100个肿瘤细胞, 共计1 000个细胞, 计算每张切片阳性染色细胞百分率. 阳性细胞数<10%为0分, 10%-25%为1分, 25%-50%为2分, >50%为3分. 细胞不着色为0分, 淡黄色为1分, 中等黄色为2分, 深黄色为3分. 每张切片染色综合得分为染色强度与阳性细胞百分率得分之和[2].
统计学处理 采用SPSS13.0统计软件进行分析, 计量资料结果以mean±SD表示, 组间比较采用两样本t检验. 非正态分布资料采用Mann-Whitney U检验. P<0.05为差异有统计学意义.
在常氧条件下三维培养48 h, 生长在厚胶(每孔200 μL)上的肝癌细胞不能形成基质型VM(patterned matrix VM), 而在缺氧条件下则形成明显的基质型VM(图1A, B). 生长在薄胶(每孔25 μL)上的肝癌细胞都能形成管形VM(tubular VM), 但缺氧条件下形成的管道明显较常氧条件下长(图1C-E).
三维培养48 h后, 缺氧组HIF-1α、MMP-2和MMP-9 mRNA表达水平均显著高于常氧组(0.70±0.05 vs 0.51±0.10, P = 0.03; 0.90±0.09 vs 0.67±0.09, P = 0.013; 0.64±0.10 vs 0.42±0.07, P = 0.01, 图2).
三维培养48 h后, 缺氧组HIF-1α、MMP-2和MMP-9蛋白表达水平显著高于常氧组(0.52±0.09 vs 0.41±0.09, P = 0.035; 0.63±0.11 vs 0.50±0.11, P = 0.023; 0.50±0.14 vs 0.38±0.09, P = 0.008, 图3).
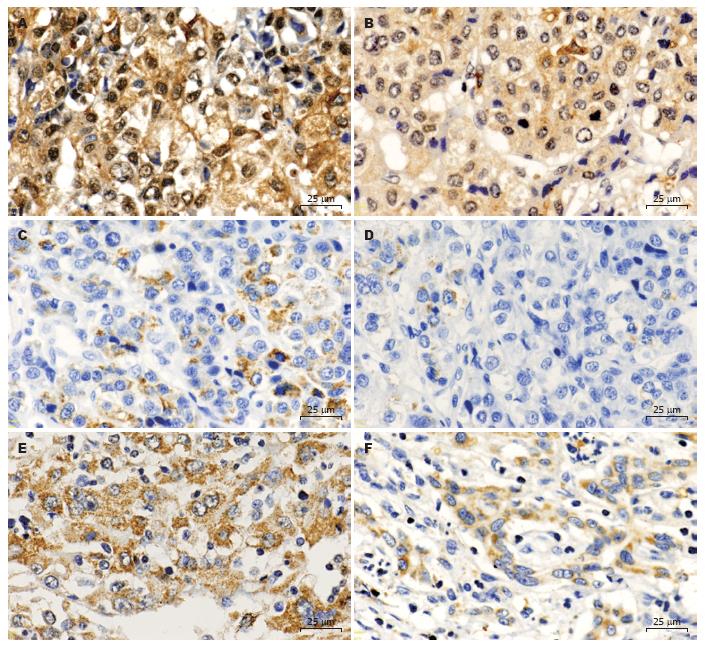
肝癌组织中基质型VM通过包绕3-15个肿瘤细胞的层粘连蛋白阳性环来识别. VM的同一位置不显示内皮细胞标志物CD34, 这表明层粘连蛋白阳性环不是肝血窦, 而CD34阳性者为肝血窦(图4). 比较图4A与图4B, 似乎层粘连蛋白阳性环与肝血窦相连通. 在151例肝癌组织标本中有31例存在基质型VM表达.
我们应用免疫组织化学方法对存在VM(VM组)和不存在VM(非VM组)的两组肝癌组织中HIF-1α、MMP-2和MMP-9进行检测, 发现HIF-1α在细胞核或细胞质中表达(图5A, B), MMP-2和MMP-9表达于细胞质(图5C-F). 综合肿瘤细胞染色强度和阳性细胞百分率进行半定量处理, 显示VM组HIF-1α、MMP-2和MMP-9染色综合得分明显较非VM组高(P = 0.001, 0.030, 0.007, 表1).
| 分组 | Z值 | P值 | ||
| VM组 | 非VM组 | |||
| HIF-1α | 4.5±1.6 | 3.4±1.7 | -3.470 | 0.001 |
| MMP-2 | 4.5±1.6 | 3.4±1.7 | -2.168 | 0.030 |
| MMP-9 | 3.9±1.9 | 2.9±1.8 | -2.682 | 0.007 |
肿瘤内微环境明显不同于正常组织, 其主要差别在于肿瘤血管结构缺陷, 肿瘤细胞生长快于血管生成, 造成肿瘤内许多区域血液供应不足, 并因此而缺氧[13]. 缺氧不仅可以诱导肿瘤细胞对放疗、化疗的耐受性, 而且可以促进肿瘤细胞的生长、侵袭和转移等恶性生物学行为的发生. 缺氧调控的一系列基因和蛋白的表达正是这些现象发生的根本原因, 而HIF家族是调控这一系列基因和蛋白的关键因素. 在HIF家庭中, HIF-1α是一种缺氧依赖性的蛋白质, 在正常氧分压时被泛素依赖的蛋白水解酶水解. 缺氧时HIF-1α在细胞内很快稳定下来, 与一系列缺氧反应靶基因上的特定结合位点缺氧反应元件结合, 可在转录水平上调控细胞增殖, 激活许多缺氧反应性基因的表达, 与肿瘤的能量代谢、血管生成、浸润和转移等密切相关[14-16].
研究表明, 缺氧也能促进肿瘤细胞VM的形成, 其对VM的调控可能涉及多种机制[9,17-19]. 在黑色素瘤鼠模型中, 缺氧环境使肿瘤细胞HIF-1α表达增加, 诱导VM通道形成, 以获得充足的血液供应[10]. 缺氧也是卵巢上皮性癌细胞形成VM的重要诱导因素, 而西罗莫司通过抑制HIF-1α mRNA的表达阻断VM的形成[11]. 在尤因肉瘤组织中, VM周围的肿瘤细胞内存在着缺氧并高表达HIF-1α及其靶基因葡萄糖载体GLUT1; 当尤因肉瘤细胞被培养在低氧条件下, 一些与VM相关的基因表达增加. 表明缺氧可能通过激活HIF-1α而促进尤因肉瘤VM形成[9]. 我们通过对肝癌细胞系MHCC97-H进行常氧和缺氧条件下三维培养, 发现在缺氧条件下, 在厚胶上培养48 h的肝癌细胞能形成基质型VM, 而常氧环境下的细胞48 h未见基质型VM形成. 在薄胶上三维培养48 h, 常氧组与缺氧组的肝癌细胞均能形成管形VM, 但缺氧组形成的管道长度明显较常氧组长. 表明缺氧能促进肝癌VM的形成. 我们同时也发现, 在缺氧条件下, 伴随着VM的形成HIF-1α也显著地被缺氧环境所上调.
影响VM通道形成的因素包括肿瘤细胞的可塑性、细胞外基质(extracellular matrix, ECM) 重塑和VM与宿主微循环的连结[18,20]. ECM重塑为VM形成提供了所需的空间, 其与肿瘤细胞分泌的MMP有关. 在MMP中, MMP-2和MMP-9是最主要的MMP, 能降解各种ECM蛋白, 促进肿瘤血管生成、侵袭和转移, 并能促进VM形成[2,5,20-25]. 尽管一些关于缺氧或HIF-1α对MMP-2和MMP-9作用的研究结果还存在着争议, 但似乎缺氧更可能会诱导MMP-2和MMP-9表达[23,26,27]. 因此, 我们推测MMP-2和MMP-9可能涉及缺氧诱导的VM形成机制. 我们的三维培养实验也证实, 伴随着VM的形成, MMP-2和MMP-9基因和蛋白表达水平均明显升高, 这表明缺氧也可能通过诱导MMP-2和MMP-9表达而促进肝癌VM形成.
肝癌由肝炎病毒的慢性感染或在肝硬化基础上发展而来, 因肝内纤维化破坏脉管系统及癌基因激活和(或)抑癌基因失活等使癌细胞增殖失控导致缺氧. HIF-1是特异性低氧状态下发挥活性的转录因子, 其中HIF-1α是唯一的氧调节亚基, 广泛参与细胞缺氧诱导的特异性应答[28]. 鉴于肝癌组织中基质型VM能通过包绕3-15个肿瘤细胞的层粘连蛋白阳性环来识别[4,29], 我们先用层粘连蛋白免疫组织化学方法证实了151例肝癌标本中31例存在VM, 接着发现存在VM的肝癌组织中HIF-1α表达水平明显高于不存在VM的肝癌组织, 表明相比后者, 存在VM的肝癌组织缺氧可能更严重. MMP-2和MMP-9表达水平在存在VM的肝癌组织中也明显较高. 此结果与最近Li等[30]在胃腺癌中的报道相似. 这也从另一个角度说明缺氧可能促进了肝癌VM的形成.
总之, 缺氧能够促进肝癌VM形成, 诱导HIF-1α、MMP-2和MMP-9表达可能是其机制之一. 然而缺氧是否通过激活HIF-1α、MMP-2和MMP-9酶活性而诱导肝癌VM形成, 还有待进一步证实. 肝癌VM形成缺氧机制的阐明可能对肝癌靶向治疗具有一定的临床意义.
多年来, 肿瘤血管被认为是由血管内皮细胞单独排列而成. 然而, 近些年的一些研究表明, 除了血管内皮细胞之外, 可塑性肿瘤细胞也可能贡献于肿瘤的血管化作用. 由可塑性肿瘤细胞形成的血管生成拟态(VM)是对传统肿瘤血管生成理论的重要补充, 为抗肿瘤血管生成治疗提供了崭新的思路.
徐泱, 副教授, 上海复旦大学附属中山医院肝肿瘤外科
VM的现象在黑色素瘤、胶质瘤、乳癌、结直肠癌和肝癌等多种肿瘤中均有报道. VM在肿瘤生物学中可能具有十分重要的意义. 然而, 形成VM的机制目前还不清楚, 亟待进一步研究.
相比不存在VM的肝癌组织, 存在VM的肝癌组织缺氧可能更严重. MMP-2和MMP-9表达水平在存在VM的肝癌组织中也明显较高. 此结果与最近Li等在胃腺癌中的报道相似.
本研究采用三维培养模型, 观察常、缺氧条件下肝癌细胞VM形成以及HIF-1α、MMP-2和MMP-9表达的差异, 并结合肝癌组织进行免疫组织化学检测, 首次探讨了缺氧对肝癌VM形成的影响及其可能机制.
本研究表明缺氧能够促进肝癌VM形成, 诱导HIF-1α、MMP-2和MMP-9表达可能是其机制之一. 这可能对肝癌分子靶向治疗具有一定的临床意义.
本文选题较好, 设计合理, 结果可靠, 具有很好的学术价值.
编辑 李薇 电编 何基才
| 1. | Maniotis AJ, Folberg R, Hess A, Seftor EA, Gardner LM, Pe'er J, Trent JM, Meltzer PS, Hendrix MJ. Vascular channel formation by human melanoma cells in vivo and in vitro: vasculogenic mimicry. Am J Pathol. 1999;155:739-752. [PubMed] |
| 2. | Sun B, Zhang S, Zhang D, Du J, Guo H, Zhao X, Zhang W, Hao X. Vasculogenic mimicry is associated with high tumor grade, invasion and metastasis, and short survival in patients with hepatocellular carcinoma. Oncol Rep. 2006;16:693-698. [PubMed] |
| 3. | Zhao H, Gu XM. Study on vasculogenic mimicry in malignant esophageal stromal tumors. World J Gastroenterol. 2008;14:2430-2433. [PubMed] [DOI] |
| 4. | Guzman G, Cotler SJ, Lin AY, Maniotis AJ, Folberg R. A pilot study of vasculogenic mimicry immunohistochemical expression in hepatocellular carcinoma. Arch Pathol Lab Med. 2007;131:1776-1781. [PubMed] |
| 5. | Robertson FM, Simeone AM, Lucci A, McMurray JS, Ghosh S, Cristofanilli M. Differential regulation of the aggressive phenotype of inflammatory breast cancer cells by prostanoid receptors EP3 and EP4. Cancer. 2010;116:2806-2814. [PubMed] [DOI] |
| 6. | El Hallani S, Boisselier B, Peglion F, Rousseau A, Colin C, Idbaih A, Marie Y, Mokhtari K, Thomas JL, Eichmann A. A new alternative mechanism in glioblastoma vascularization: tubular vasculogenic mimicry. Brain. 2010;133:973-982. [PubMed] [DOI] |
| 7. | Baeten CI, Hillen F, Pauwels P, de Bruine AP, Baeten CG. Prognostic role of vasculogenic mimicry in colorectal cancer. Dis Colon Rectum. 2009;52:2028-2035. [PubMed] |
| 9. | van der Schaft DW, Hillen F, Pauwels P, Kirschmann DA, Castermans K, Egbrink MG, Tran MG, Sciot R, Hauben E, Hogendoorn PC. Tumor cell plasticity in Ewing sarcoma, an alternative circulatory system stimulated by hypoxia. Cancer Res. 2005;65:11520-11528. [PubMed] [DOI] |
| 10. | Sun B, Zhang S, Zhang D, Gu Y, Zhang W, Zhao X. The influence of different microenvironments on melanoma invasiveness and microcirculation patterns: an animal experiment study in the mouse model. J Cancer Res Clin Oncol. 2007;133:979-985. [PubMed] [DOI] |
| 12. | Yamamoto K, Takahashi T, Asahara T, Ohura N, Sokabe T, Kamiya A, Ando J. Proliferation, differentiation, and tube formation by endothelial progenitor cells in response to shear stress. J Appl Physiol (1985). 2003;95:2081-2088. [PubMed] |
| 13. | Crowther M, Brown NJ, Bishop ET, Lewis CE. Microenvironmental influence on macrophage regulation of angiogenesis in wounds and malignant tumors. J Leukoc Biol. 2001;70:478-490. [PubMed] |
| 14. | Huang GW, Yang LY, Lu WQ. Expression of hypoxia-inducible factor 1alpha and vascular endothelial growth factor in hepatocellular carcinoma: Impact on neovascularization and survival. World J Gastroenterol. 2005;11:1705-1708. [PubMed] |
| 15. | 李 月明, 姚 登福, 姜 华, 邱 历伟, 李 姗姗, 钱 静, 卞 银珠. 肝癌组织中HIF-1α的表达与HIF-1α mRNA的扩增分析. 胃肠病学和肝病学杂志. 2009;18:327-331. |
| 16. | 华 杰, 施 瑞华, 张 红杰, 于 莲珍, 朱 宏, 肖 斌, 张 国新, 郝 波. RNA干扰HIF-1α对血管生成拟态相关基因表达的影响. 世界华人消化杂志. 2009;17:1913-1918. [DOI] |
| 17. | Zhang S, Li M, Zhang D, Xu S, Wang X, Liu Z, Zhao X, Sun B. Hypoxia influences linearly patterned programmed cell necrosis and tumor blood supply patterns formation in melanoma. Lab Invest. 2009;89:575-586. [PubMed] [DOI] |
| 18. | Zhang S, Zhang D, Sun B. Vasculogenic mimicry: current status and future prospects. Cancer Lett. 2007;254:157-164. [PubMed] [DOI] |
| 20. | Sood AK, Fletcher MS, Coffin JE, Yang M, Seftor EA, Gruman LM, Gershenson DM, Hendrix MJ. Functional role of matrix metalloproteinases in ovarian tumor cell plasticity. Am J Obstet Gynecol. 2004;190:899-909. [PubMed] [DOI] |
| 21. | Sood AK, Seftor EA, Fletcher MS, Gardner LM, Heidger PM, Buller RE, Seftor RE, Hendrix MJ. Molecular determinants of ovarian cancer plasticity. Am J Pathol. 2001;158:1279-1288. [PubMed] |
| 22. | Sun T, Zhao N, Zhao XL, Gu Q, Zhang SW, Che N, Wang XH, Du J, Liu YX, Sun BC. Expression and functional significance of Twist1 in hepatocellular carcinoma: its role in vasculogenic mimicry. Hepatology. 2010;51:545-556. [PubMed] |
| 23. | Sun B, Zhang D, Zhang S, Zhang W, Guo H, Zhao X. Hypoxia influences vasculogenic mimicry channel formation and tumor invasion-related protein expression in melanoma. Cancer Lett. 2007;249:188-197. [PubMed] [DOI] |
| 24. | Sun B, Qie S, Zhang S, Sun T, Zhao X, Gao S, Ni C, Wang X, Liu Y, Zhang L. Role and mechanism of vasculogenic mimicry in gastrointestinal stromal tumors. Hum Pathol. 2008;39:444-451. [PubMed] [DOI] |
| 25. | Xu X, Jia R, Zhou Y, Song X, Fan X. Investigation of vasculogenic mimicry in sebaceous carcinoma of the eyelid. Acta Ophthalmol. 2010;88:e160-e164. [PubMed] [DOI] |
| 26. | Annabi B, Lee YT, Turcotte S, Naud E, Desrosiers RR, Champagne M, Eliopoulos N, Galipeau J, Béliveau R. Hypoxia promotes murine bone-marrow-derived stromal cell migration and tube formation. Stem Cells. 2003;21:337-347. [PubMed] [DOI] |
| 27. | Ottino P, Finley J, Rojo E, Ottlecz A, Lambrou GN, Bazan HE, Bazan NG. Hypoxia activates matrix metalloproteinase expression and the VEGF system in monkey choroid-retinal endothelial cells: Involvement of cytosolic phospholipase A2 activity. Mol Vis. 2004;10:341-350. [PubMed] |
| 30. | Li M, Gu Y, Zhang Z, Zhang S, Zhang D, Saleem AF, Zhao X, Sun B. Vasculogenic mimicry: a new prognostic sign of gastric adenocarcinoma. Pathol Oncol Res. 2010;16:259-266. [PubMed] [DOI] |