修回日期: 2010-09-03
接受日期: 2010-09-13
在线出版日期: 2010-10-28
目的: 观察PTEN、 HER-2/neu和PKB在胆管癌组织中的表达, 并探讨其与胆管癌发生、发展的关系及其意义.
方法: 应用免疫组织化学SP法检测80例胆管癌组织和24例正常胆管组织(取自其他良性疾病行胆管切除者)中PTEN、HER-2/neu和PKB的表达.
结果: 胆管癌组织中PTEN表达显著低于正常胆管组织(40.00% vs 79.17%, χ2 = 11.33, P = 0.001), HER-2/neu的表达显著高于正常胆管组织(73.75% vs 33.33%, χ2 = 13.16, P = 0.000), PKB的表达显著高于正常胆管组织(80.00% vs 54.17%, χ2 = 6.41, P = 0.01). PTEN和HER-2/neu蛋白表达呈明显负相关(r = -0.456, P = 0.000); PTEN与PKB蛋白表达呈明显负相关(r = -0.355, P = 0.001); HER-2/neu与PKB蛋白表达呈明显正相关(r = 0.374, P = 0.001).
结论: PTEN表达的缺失和HER-2/neu过表达可能导致细胞增殖失控, 与胆管癌的发生、发展密切相关, 二者均与PKB呈相关性, 提示二者均可能通过PI3K-PKB信号转导参与胆管癌的发生发展.
引文著录: 崔东旭, 于艳龙. PTEN、HER-2/neu和PKB在胆管癌组织中的表达及其意义. 世界华人消化杂志 2010; 18(30): 3262-3266
Revised: September 3, 2010
Accepted: September 13, 2010
Published online: October 28, 2010
AIM: To investigate the expression of PTEN, HER-2 and protein kinase B (PKB) in cholangiocarcinoma and to analyze their correlation with the tumorigenesis and progression of cholangiocarcinoma.
METHODS: The expression of PTEN, HER-2/neu and PKB in 80 cholangiocarcinoma specimens and 24 normal bile duct tissue specimens was detected by immunohistochemistry.
RESULTS: The positive rate of PTEN expression in cholangiocarcinoma was significantly lower than that in normal bile duct tissue (40.00% vs 79.17%, χ2 = 11.33, P = 0.001). The positive rates of HER-2/neu and PKB expression were significantly higher in cholangiocarcinoma than in normal bile duct tissue (HER-2: 73.75% vs 33.33%, χ2 = 13.16, P = 0.000; PKB; 80.00% vs 54.17%, χ2 = 6.41, P = 0.01). There was a negative correlation between PTEN and HER-2/neu expression (r = -0.456, P = 0.000) and between PTEN and PKB expression (r = -0.355, P = 0.001) but a positive correlation between HER-2/neu and PKB expression (r = 0.374, P = 0.001) in cholangiocarcinoma.
CONCLUSION: Loss of PTEN expression and HER-2/neu overexpression may lead to deregulated cell proliferation, which is closely related with the development and progression of cholangiocarcinoma. Both PTEN expression and HER-2/neu expression are associated with PKB expression, suggesting that PTEN and HER-2/neu regulate the development and progression of cholangiocarcinoma perhaps via the PI3K-PKB signaling pathway.
- Citation: Cui DX, Yu YL. Significance of expression of PTEN, HER-2/neu and PKB in cholangiocarcinoma. Shijie Huaren Xiaohua Zazhi 2010; 18(30): 3262-3266
- URL: https://www.wjgnet.com/1009-3079/full/v18/i30/3262.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i30.3262
胆管癌是起源于胆管上皮细胞的恶性肿瘤, 近年来其发病率呈上升趋势[1]. 胆管癌恶性程度高、发展迅速, 临床上难于早期发现; 另外由于胆管癌所在解剖部位复杂使得手术切除率很低; 加上一般的放、化疗疗效不满意, 所以胆管癌预后非常差. 鉴于胆管癌的上述特性, 有必要对其发生、发展机制进行更深入地研究. 研究证实, PTEN、人表皮生长因子受体2(human epidermal growth factor receptor 2, HER-2)和蛋白激酶B(protein kinase B, PKB)在人类多种肿瘤, 如神经胶质瘤、前列腺癌、子宫内膜癌、黑色素瘤及胃肠道肿瘤、肝癌、胰腺癌、上皮性卵巢癌等[2-4]均存在异常表达, 提示PTEN、HER-2/neu和PKB的改变与肿瘤的发生、发展有关. 本研究旨在探讨PTEN、HER-2/neu和PKB在胆管癌组织中的表达和三者在胆管癌发生发展中的关系及意义.
收集2005-01/2008-10在中国医科大学附属盛京医院普通外科住院并行手术治疗的胆管癌患者资料, 选择其中临床资料完整的胆管癌患者80例, 均经病理检查确诊, 术前均未行放化疗. 另收集同期24例经病理证实的正常胆管组织标本(取自其他良性疾病行胆管切除者)作为正常对照. 标本均用10%甲醛溶液固定, 石蜡包埋, 4 μm连续切片. 兔抗人HER-2/neu多克隆抗体(DAKOUSA)、鼠抗人PTEN单克隆抗体、SP和DAB(购自北京中杉金桥生物技术有限公司), 鼠抗人PKB多克隆抗体为Santa Cruz公司产品.
1.2.1 免疫组织化学检测: 所有标本均经石蜡包埋、切片, 常规脱蜡, 水化后经3%过氧化氢处理, 微波抗原修复, 其余染色步骤按各试剂说明书分别进行PTEN、HER-2/neu和PKB免疫组织化学SP法检测. 以PBS代替一抗作阴性对照, 用已知阳性片为阳性对照.
1.2.2 结果判定: (1)PTEN与PKB蛋白结果判定: 在显微镜下(×400)观察, 随机计数10个高倍视野, 无阳性或阳性细胞<25%为(-), 阳性细胞25%-50%为(+), 阳性细胞数50%-75%为(++), 阳性细胞数≥75%为(+++), +或++视为PTEN、PKB过表达阳性, +++视为PTEN、PKB过表达强阳性. 不以染色深浅作为判断阳性程度指标, 以排除一抗浓度、DAB染色时间、标本保存时间等因素的干扰; (2)HER-2/neu结果判定: 按照DAKO标准进行染色强度分级: 在显微镜下(×400)观察, 随机计数10个高倍视野, 阴性(-):未着色或<10%的肿瘤细胞膜着色; (+): >10%的肿瘤细胞膜呈微弱的着色且仅为细胞膜的不完全着色; (++): >10%的肿瘤细胞呈弱到中等强度的细胞膜完全着色; 强阳性(+++): >10%的肿瘤细胞呈强的细胞膜着色, +或++视为HER-2/neu过表达阳性, +++视为HER-2/neu过表达强阳性.
统计学处理 采用SPSS13.0软件包进行统计学分析, 计数资料以χ2检验和Fisher精确概率法进行统计分析, PTEN、HER-2/neu和PKB之间的相关性采用Spearman等级相关分析, 均以P<0.05认定为有统计学意义.
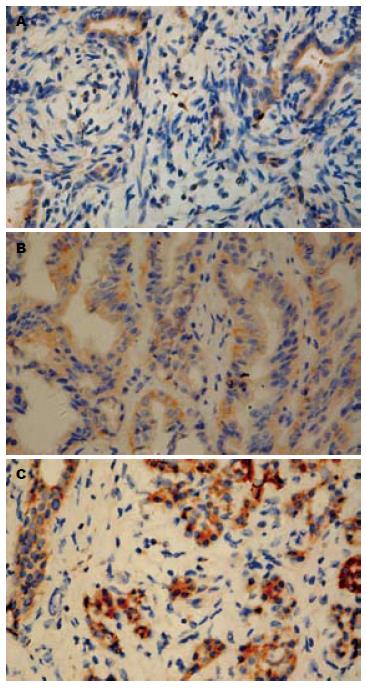
PTEN蛋白在胆管癌组织阳性表达率为40.00%, 多表达于胞质, 少数表达于细胞核, 出现明显棕黄色颗粒; 正常组织阳性表达率为79.17%, 两者存在显著性差异(χ2 = 11.33, P = 0.001). HER-2/neu蛋白在胆管癌组织阳性表达率为73.75%, 细胞膜和细胞质出现棕黄色颗粒; 正常组织阳性表达率为33.33%, 两者存在显著性差异(χ2 = 13.16, P = 0.000). PKB蛋白在胆管癌组织阳性表达率为80.00%, 多表达于胞质, 少数表达于细胞核, 出现明显棕黄色颗粒; 正常组织阳性表达率为54.17%, 两者存在显著性差异(χ2 = 6.41, P = 0.01, 图1, 表1).
| 分组 | n | PTEN(n) | 表达率(%) | χ2值 | P值 | HER-2/neu | 表达率(%) | χ2值 | P值 | PKB | 表达率(%) | χ2值 | P值 | |||
| 阴性 | 阳性 | 阴性 | 阳性 | 阴性 | 阳性 | |||||||||||
| 正常组 | 24 | 5 | 19 | 79.17 | 11.33 | 0.001 | 16 | 8 | 33.33 | 13.16 | 0.00 | 11 | 13 | 54.17 | 6.41 | 0.01 |
| 病例组 | 80 | 48 | 32 | 40.00 | 21 | 59 | 73.75 | 16 | 64 | 80.00 | ||||||
PTEN和HER-2/neu表达存在显著的负相关(r = -0.456, P = 0.000); PTEN和PKB表达亦存在显著的负相关(r = -0.355, P = 0.001); HER-2/neu和PKB表达则存在显著的正相关(r = 0.374, P = 0.001, 表2-4).
| HER-2/neu | PTEN | 合计 | ||
| 阴性 | 阳性 | 强阳性 | ||
| 阴性 | 4 | 7 | 10 | 21 |
| 阳性 | 20 | 3 | 5 | 28 |
| 强阳性 | 24 | 5 | 2 | 31 |
| 合计 | 48 | 15 | 17 | 80 |
| PKB | HER-2/neu | 合计 | ||
| 阴性 | 阳性 | 强阳性 | ||
| 阴性 | 5 | 6 | 5 | 16 |
| 阳性 | 15 | 4 | 5 | 24 |
| 强阳性 | 1 | 18 | 21 | 40 |
| 合计 | 21 | 28 | 31 | 80 |
| PTEN | PKB | 合计 | ||
| 阴性 | 阳性 | 强阳性 | ||
| 阴性 | 7 | 10 | 31 | 48 |
| 阳性 | 2 | 8 | 5 | 15 |
| 强阳性 | 7 | 6 | 4 | 17 |
| 合计 | 16 | 24 | 40 | 80 |
癌基因和抑癌基因的表达失常或失衡所导致的细胞信号转导紊乱、细胞无控增殖在肿瘤的发生、发展和转归上具有关键性作用. 如前所述, 大量研究表明, 抑癌基因PTEN、癌基因HER-2/neu在多种肿瘤中均有异常表达, 并且在调节肿瘤细胞生长、分化、侵袭转移和肿瘤血管新生等各方面均有重要作用[5,6]. 另一方面, 细胞信号转导通路紊乱是肿瘤细胞的重要生物学特性之一, 其中三磷酸肌醇激酶(phosphatidyl inositol 3-kinase, PI3K)/PKB信号转导通路在维持细胞恶性生物学特性中起着重要作用[7].
PTEN是迄今为止发现的第1个具有磷酸酶活性的抑癌基因, 定位于人染色体10q23[8], 其表达产物是PI3K/PKB信号转导通路上的关键蛋白. Furnari等[9]在对脑胶质瘤细胞系的研究中也发现外源性野生型PTEN能显著抑制脑胶质瘤细胞系的生长. PTEN基因缺失和突变率非常高, 在人类多种肿瘤中均有PTEN杂合性丢失或突变致畸失活, 如在神经胶质瘤、子宫内膜癌、前列腺癌、在乳腺癌、卵巢癌、肾细胞癌、甲状腺癌、淋巴瘤、肝细胞癌, 肺癌等多种恶性组织中均有PTEN表达的不同程度下降[10]. 本研究结果显示, PTEN蛋白在胆管癌组织中表达显著低于在正常胆管组织, 提示胆管癌的发生发展过程中同样可能存在PTEN基因的突变或杂合性缺失.
HER-2/neu基因则位于人染色体17q-12-21.3的一种细胞癌基因, 主要参与细胞的分裂和生长, 于胚胎发育时期开始表达, 成年后正常组织中仅可检测到少量的HER-2/neu基因. 在正常情况下该基因处于非激活状态, 其编码产物是具有酪氨酸酶活性的细胞跨膜糖蛋白(P185), 其在某些肿瘤的细胞信号转导中起着重要作用, 是肿瘤细胞生长、分化的重要调节因子[11]. 目前认为HER-2/neu主要通过对细胞转导通路的影响来参与细胞的增殖、分化、迁移、黏附、转化与凋亡, 使细胞增殖加快, 周期加速, 使细胞呈现恶性表现. 一些研究认为HER-2的过表达与临床进展相关系, 认为他是决定患者生存期的独立因素, 并且有人认为血清HER-2蛋白水平是复发后预期存活的最强因素[6]. 本试验研究结果显示, HER-2/neu蛋白在胆管癌组织表达明显高于正常胆管组织; 表明HER-2蛋白过表达同样与胆管癌发生、发展密切相关.
PKB是一个相对分子质量约60 000 Da的蛋白, 是一类调解细胞凋亡/存活的胞质信号转导蛋白[12], 其在多种细胞中充当抗凋亡信号激酶的作用, 参与调控细胞内若干程序信号转导, 介导肿瘤发生发展[13], 因此PKB被认为是一个潜在的癌基因. 细胞外生长信号通过PI3K作用产生磷脂酰肌醇3, 4, 5-三磷酸(phosphatidyl inositol 3, 4, 5-triphosphate, PIP3), 后者激活PKB从而启动一系列与细胞凋亡、细胞周期调控、端粒酶活性、血管生成、细胞亲信迁移相关的程序[14-16], 此信号转导通路即为PI3K/PKB信号转导通路. 本试验研究结果显示胆管癌组织中PKB蛋白明显高表达, 并与PTEN、HER-2表达均显著相关, 表明PTEN、HER-2亦可能通过PI3K/PKB信号转导通路参与胆管癌的发生、发展. 有研究表明, PTEN可催化PIP3和PIP2去磷酸化, 进而抑制PKB的活性, PTEN突变则可引起PKB活性增强[17]. HER-2/neu的激活多表现为野生型基因的扩增和过表达, 其激活后则可引起下游蛋白磷酸化而激活多条通路, 主要有Ras/Raf/MAPK、PI3K/PKB和cAMP等. HER-2/neu的激活可以活化PI3K, 在细胞膜内生成PIP3与PIP2, 进而与PKB相互作用介导细胞分化、迁移、存活、凋亡.
总之, 本研究结果表明PTEN、HER-2/neu和PKB与胆管癌的发生、发展密切相关, 并提示肿瘤的发生是多种癌基因活化与抑癌基因失活共同作用的结果. 检测胆管癌中不同基因的表达, 可为胆管癌的基因靶向药物治疗提供新的靶点.
胆管癌是起源于胆管上皮细胞的恶性肿瘤, 恶性程度高、发展迅速, 临床上难于早期发现, 因此对其发生、发展机制的研究有利于找出肿瘤发展过程中的标志物, 从而有利于早期诊断或是为肿瘤的生物治疗找到新的靶点.
荚卫东, 教授, 安徽省立医院肝胆外科
检测胆管癌中不同基因的表达, 进一步研究胆管癌发生发展机制一直以来是研究的热点与难点, 结合临床特征, 对未来判定胆管癌的恶性程度、侵袭性以及评价预后具有重要意义, 同时或可为胆管癌的靶向药物治疗提供新的靶点.
本研究探讨PTEN、HER-2/neu和PKB在胆管癌组织中的表达和三者在胆管癌发生发展中的关系及意义, 这在国内发表的相关文章中尚不多见.
本文为胆管癌发生发展的研究提供了一些线索, 并可能为胆管癌的靶向药物研究提供一些方向.
本文内容较新颖, 有一定的创新性, 学术价值较好, 为进一步研究胆管癌发生发展的相关机制以及治疗提供了新途径.
编辑: 李军亮 电编:李薇
| 1. | Khan SA, Thomas HC, Davidson BR, Taylor-Robinson SD. Cholangiocarcinoma. Lancet. 2005;366:1303-1314. [PubMed] [DOI] |
| 2. | Xu G, Zhang W, Bertram P, Zheng XF, McLeod H. Pharmacogenomic profiling of the PI3K/PTEN-AKT-mTOR pathway in common human tumors. Int J Oncol. 2004;24:893-900. [PubMed] |
| 3. | Kanamori Y, Kigawa J, Itamochi H, Shimada M, Takahashi M, Kamazawa S, Sato S, Akeshima R, Terakawa N. Correlation between loss of PTEN expression and Akt phosphorylation in endometrial carcinoma. Clin Cancer Res. 2001;7:892-895. [PubMed] |
| 4. | Chang F, Lee JT, Navolanic PM, Steelman LS, Shelton JG, Blalock WL, Franklin RA, McCubrey JA. Involvement of PI3K/Akt pathway in cell cycle progression, apoptosis, and neoplastic transformation: a target for cancer chemotherapy. Leukemia. 2003;17:590-603. [PubMed] [DOI] |
| 5. | Mutter GL, Lin MC, Fitzgerald JT, Kum JB, Baak JP, Lees JA, Weng LP, Eng C. Altered PTEN expression as a diagnostic marker for the earliest endometrial precancers. J Natl Cancer Inst. 2000;92:924-930. [PubMed] [DOI] |
| 6. | Krüger S, Weitsch G, Büttner H, Matthiensen A, Böhmer T, Marquardt T, Sayk F, Feller AC, Böhle A. HER2 overexpression in muscle-invasive urothelial carcinoma of the bladder: prognostic implications. Int J Cancer. 2002;102:514-518. [PubMed] [DOI] |
| 7. | Bianco R, Melisi D, Ciardiello F, Tortora G. Key cancer cell signal transduction pathways as therapeutic targets. Eur J Cancer. 2006;42:290-294. [PubMed] [DOI] |
| 8. | Nielsen-Preiss SM, Silva SR, Gillette JM. Role of PTEN and Akt in the regulation of growth and apoptosis in human osteoblastic cells. J Cell Biochem. 2003;90:964-975. [PubMed] [DOI] |
| 9. | Furnari FB, Lin H, Huang HS, Cavenee WK. Growth suppression of glioma cells by PTEN requires a functional phosphatase catalytic domain. Proc Natl Acad Sci U S A. 1997;94:12479-12484. [PubMed] [DOI] |
| 10. | Di Cristofano A, Pesce B, Cordon-Cardo C, Pandolfi PP. Pten is essential for embryonic development and tumour suppression. Nat Genet. 1998;19:348-355. [PubMed] [DOI] |
| 11. | Slamon DJ, Clark GM, Wong SG, Levin WJ, Ullrich A, McGuire WL. Human breast cancer: correlation of relapse and survival with amplification of the HER-2/neu oncogene. Science. 1987;235:177-182. [PubMed] [DOI] |
| 12. | Marte BM, Downward J. PKB/Akt: connecting phosphoinositide 3-kinase to cell survival and beyond. Trends Biochem Sci. 1997;22:355-358. [PubMed] [DOI] |
| 13. | Vivanco I, Sawyers CL. The phosphatidylinositol 3-Kinase AKT pathway in human cancer. Nat Rev Cancer. 2002;2:489-501. [PubMed] [DOI] |
| 14. | Datta SR, Brunet A, Greenberg ME. Cellular survival: a play in three Akts. Genes Dev. 1999;13:2905-2927. [PubMed] [DOI] |
| 15. | Kim D, Kim S, Koh H, Yoon SO, Chung AS, Cho KS, Chung J. Akt/PKB promotes cancer cell invasion via increased motility and metalloproteinase production. FASEB J. 2001;15:1953-1962. [PubMed] [DOI] |
| 16. | Zhong H, Chiles K, Feldser D, Laughner E, Hanrahan C, Georgescu MM, Simons JW, Semenza GL. Modulation of hypoxia-inducible factor 1alpha expression by the epidermal growth factor/phosphatidylinositol 3-kinase/PTEN/AKT/FRAP pathway in human prostate cancer cells: implications for tumor angiogenesis and therapeutics. Cancer Res. 2000;60:1541-1545. [PubMed] |
| 17. | Pore N, Liu S, Haas-Kogan DA, O'Rourke DM, Maity A. PTEN mutation and epidermal growth factor receptor activation regulate vascular endothelial growth factor (VEGF) mRNA expression in human glioblastoma cells by transactivating the proximal VEGF promoter. Cancer Res. 2003;63:236-241. [PubMed] |