修回日期: 2010-08-10
接受日期: 2010-08-17
在线出版日期: 2010-10-28
目的: 探讨胃癌中可能存在的Survivin通路以及IFN-γ对该通路可能存在的调控.
方法: 人胃癌组织经免疫组织化学染色行相关性分析, SGC7901细胞经IFN-γ及Survivin反义寡核苷酸处理, 应用RT-PCR和免疫细胞化学及图像分析的方法检测mRNA及蛋白水平的改变, 应用Hoechst33258染色观察细胞凋亡. 组织学指标相关性采用Spearman等级相关分析, 平均光密度值采用t检验分析.
结果: 人胃癌组织中Survivin与caspase-7正相关(P = 0.03); p21waf与caspase-7正相关(P = 0.02); 胃癌SGC7901细胞, 经不同浓度Survivin反义寡核苷酸处理后, Survivin蛋白表达明显下降(P<0.05), caspase-7和p21waf无明显变化. 经IFN-γ处理后, Survivin mRNA表达明显下降(P<0.05), p21waf和caspase-7 mRNA表达明显上升(P<0.05). 经IFN-γ和Survivin反义寡核苷酸处理后细胞无明显凋亡.
结论: 胃癌中Survivin表达与caspase-7及p21waf相关, 但不能通过调节caspase-7及p21waf的表达发挥其抑制凋亡作用; IFN-γ可使Survivin表达下调, 同时上调其下游促凋亡分子caspase-7以及p21waf的表达, 以发挥其生物学作用.
引文著录: 邓昊, 黄萱, 高友晶, 镇鸿燕, 刘丽江. IFN-γ对人胃腺癌Survivin分子通路的调控作用. 世界华人消化杂志 2010; 18(30): 3249-3253
Revised: August 10, 2010
Accepted: August 17, 2010
Published online: October 28, 2010
AIM: To characterize the role of survivin in the pathogenesis of gastric adenocarcinoma and to investigate the regulatory effect of interferon-γ (IFN-γ) on the survivin signaling pathway in gastric adenocarcinoma.
METHODS: Protein expression was examined by immunohistochemistry. After IFN-γ and antisense oligonucleotide against survivin were used to treat SGC7901 cells, mRNA and protein expression was tested by RT-PCR and immunocytochemistry, respectively, and apoptosis was determined by Hoechst 33258 staining. Statistical analysis was performed using the Spearman's rank correlation test and student's t-test.
RESULTS: There was a positive correlation between caspase-7 and survivin expression (P = 0.03) as well as between caspase-7 and p21waf (P = 0.02) expression in gastric adenocarcinoma. Treatment with survivin antisense oligonucleotide down-regulated the protein expression of survivin (P < 0.05) but had no significant impact on caspase-7 and p21waf protein expression (both P > 0.05). IFN-γ treatment down-regulated the mRNA expression of survivin (P < 0.05) but up-regulated the mRNA expression of caspase-7 and p21waf (both P < 0.05). Treatment with either IFN-γ or survivin antisense oligonucleotide had no significant impact on cell apoptosis.
CONCLUSION: Although the expression of survivin is correlated with that of caspase-7 and p21waf, survivin can not regulate apoptosis in gastric adenocarcinoma by regulating caspase-7 and p21waf expression. IFN-γ can regulate apoptosis in gastric adenocarcinoma by down-regulating survivin expression and up-regulating caspase-7 and p21waf expression.
- Citation: Deng H, Huang X, Gao YJ, Zhen HY, Liu LJ. Regulatory effect of IFN-γ on the survivin signaling pathway in gastric adenocarcinoma. Shijie Huaren Xiaohua Zazhi 2010; 18(30): 3249-3253
- URL: https://www.wjgnet.com/1009-3079/full/v18/i30/3249.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i30.3249
胃癌是严重威胁中国人群健康的恶性肿瘤之一. 临床资料和实验研究显示: 胃癌细胞的凋亡明显受阻[1]; 34.5%胃癌组织不同程度表达生存素(Survivin), 且其表达水平与胃癌凋亡指数呈负相关[2]. Survivin是迄今发现作用最强的肿瘤细胞凋亡抑制因子之一, 可通过不同途径保护细胞周期不受checkpoint调控, 并抑制内、外源性因素(如BAX、Fas和化疗药物等)所诱导的肿瘤细胞凋亡[3]. Survivin是凋亡抑制蛋白(inhibitor of apoptosis protein, IAP)家族的成员, 其具有调节细胞分化以及抑制凋亡的双重功能[4]. IAP家族最早是在对杆状病毒的研究中发现的, 具有在宿主细胞受到病毒感染时抑制其死亡的功能[5,6]. IAP家族是一个高度保守的抑制细胞死亡的家族, 其结构特征是, 具有1个到多个接近70个氨基酸的锌指结构, 即杆状病毒IAP重复序列(the baculoviral IAP repeat, BIR)[7], 该结构被认为与抗凋亡功能有关. Survivin是分子最小的仅有一个BIR结构的IAP家族成员[8]. 与IAP家族其他成员不同的是, Survivin在有丝分裂时表达达到峰值[9], 在胎儿组织中大量表达[4,10], 而在正常的分化成熟的组织中无表达[11], 在恶性肿瘤组织中过度表达. Survivin抑制凋亡的主要作用机制为: (1)Survivin直接与caspase-3和caspase-7结合, 通过抑制其酶活性而抑制凋亡[12]; (2)Survivin与细胞周期调节因子CDK4结合为复合物, 使p21waf从p21waf/CDK4复合物中释放, 并形成procaspase-3/p21waf复合物, 抑制procaspase-3水解为活化的caspase-3, 从而抑制凋亡[13]; (3)可在有丝分裂前期与纺锤体微管结合, 分裂中后期与纺锤体全长结合, 分裂末期与颗粒体结合, 通过保护有丝分裂过程中纺锤体和颗粒体的完整性, 间接抑制caspase对纺锤体的水解作用, 从而抑制细胞凋亡[14]. 近期的研究发现: 分别向胃癌细胞系HS-746T和MKN-45中导入Survivin反义寡核苷酸(antisense oligonucleotide, ASON), 胃癌细胞凋亡均明显增强[15,16]. 胃癌中Survivin的表达具有重要的临床意义[17,18], 但Survivin在胃癌中抑制凋亡的分子机制, 尚未明确. IFN-γ是Ⅱ型IFN中的唯一成员, 可促进肿瘤细胞凋亡[19], 所涉及的主要环节可能是IFN-γ可通过膜受体途径上调p21waf和caspase-7的表达而实现对细胞生长的调节[20,21]. 在前期研究中, 我们发现人胃腺癌中存在该现象[22]. Survivin和IFN-γ均可通过p21waf和caspase-7分子调控细胞凋亡, 提示IFN-γ信号途径可能存在对Survivin的调节作用或者两者之间存在相关性, 但胃癌中该方面的研究较少. 据此, 本研究拟首先通过临床病理学方法, 对人胃癌组织中Survivin、p21waf和caspase-7表达情况进行检测, 观察三者在人体组织中的相互关系; 其次, 通过细胞生物学及细胞病理学的方法, 使用Survivin ASON对胃癌细胞系SGC7901进行处理, 观察Survivin等分子在Survivin表达量改变时的变化及相互关系以及细胞凋亡情况, 以进一步明确人胃癌中存在的Survivin分子通路, 继而使用IFN-γ对胃癌细胞系SGC7901进行处理, 观察细胞凋亡以及Survivin和其相关分子的变化及相互关系, 探讨胃癌中IFN-γ对Survivin通路可能存在的调控作用.
收集江汉大学附属医院1989-2003年胃腺癌根治性手术切除并有完整病理学检查数据的标本102例. 所有病例术前均未进行放疗和化疗. 胃癌细胞株SGC7901用含10%小牛血清(Gibcol)的RMPI 1640培养基(Gibcol), 置于37 ℃, 50 mL/L CO2的培养箱中培养. 每2-3 d换1次液.
1.2.1 ASON转染以及药物处理: ASON及引物由赛百胜生物技术有限公司合成. 用阳离子脂质体Transfectin(TianGENE)进行转染. ASON的序列设计以及浓度根据已发表的文献. Survivin ASON: 5'-CCCAGCCTTCCAGCTCCTTG-3', 按照200和400 nmol/L的浓度转染[23], 处理细胞24 h. 细胞转染严格按照说明书操作, 反义寡核苷酸:脂质体 = 1:2-3. 使用1 000 IU/mL IFN-γ[24](102CY27, PEPROTECH EC)处理细胞0.5、3和24 h.
1.2.2 免疫组织化学及免疫细胞化学染色: 免疫组织化学及免疫细胞化学染色使用抗体为: 抗Survivin多克隆抗体(RAB-0536, Neomarker公司产品), 即用型鼠抗人caspase-7单克隆抗体(7CSP01, Neomarker公司产品), 即用型鼠抗人p21waf单克隆抗体(F-5, Santa Cruz, sc-6246)和SP法即用型检测试剂盒均购自福州迈新生物公司. 所有染色均经DAB显色. Survivin、caspase-7和p21waf以癌细胞质内呈棕黄色表达为阳性. 操作过程严格按照说明书要求进行. 各细胞处理组免疫细胞化学染色步骤保持严格一致, 并同时进行操作, 染色结果经MOTIC图像分析系统(Med-6)测量其平均光密度, 进行相对定量.
1.2.3 RT-PCR检测及图像分析: 用TRIzol(Invitrogen)提取总RNA, 样品纯度和浓度经核酸测定仪测定, A260/280值在1.8-2.0. 严格按照RT-PCR试剂盒(TaKaRa)说明书操作进行RT-PCR. 使用Primer 5.0引物设计软件分别设计Survivin、caspase-7、p21waf和β-actin的上游和下游引物(表1). 目的引物与β-actin用一管法进行PCR. PCR产物经1.5 g/L的琼脂糖凝胶电泳检测, 使用Biostep Photoimpact软件分析各组目的基因与β-actin条带的平均光密度值, 计算两者的比值, 进行相对定量.
| 基因 | 正义链 | 反义链 | 长度(bp) |
| Survivin | 5'-CAGACTTGGCCCAGTCTTTC-3' | 5'-TTTCTCCGCAGTTTCCTCA-3' | 236 |
| caspase-7 | 5'-ATTTGACAGCCCACTTTAGG-3' | 5'-GCATGATTTCCAGGTCTTTT-3' | 297 |
| p21waf | 5'-GCGACTGTGATGCGCTAATGG-3' | 5'-TAGAAATCTGTCATGCTGGTCTGC-3' | 358 |
| β-actin 1 | 5'-TGCTGTCCCTCTACGCCTCT-3' | 5'-GCTTCTCCTTGATGTCGC-3' | 234 |
| β-actin 2 | 5'-ATCATGTTTGAGACCTTCAACA-3' | 5'-CATCTCTTGCTCGAAGTCCA-3' | 318 |
1.2.4 Hoechst33258染色检测细胞凋亡: 无菌条件下取出细胞爬片并固定后, Hoechst33258孵育15 min, 0.01 mol/L PBS洗5 min. 水溶性封片剂封片, 荧光显微镜紫外光下观察, Hoechst33258染料呈现蓝色荧光. 高倍镜下观察, 凋亡细胞为蓝色亮点, 亮度明显强于未凋亡细胞, 形态学上出现核膜消失、核固缩、核碎裂等特征. 随机数取1 000个细胞进行凋亡细胞数的判定.
统计学处理 全部数据经SPSS12.0统计学软件处理, 相关因素分析采用Spearman等级相关分析, 各组平均吸光度值采用t检验分析. P<0.05有统计学意义.
全组102例胃癌, 男69例, 女33例. 年龄26-77岁, 中位年龄59岁. Survivin阳性率为51%(52/102), caspase-7阳性率为35.3%(36/102), p21waf阳性率为79.4%(81/102). 各指标表达情况经Spearman等级相关分析显示: Survivin与caspase-7正相关(P = 0.03, r = 0.21); p21waf与caspase-7正相关(P = 0.02, r = 0.22).
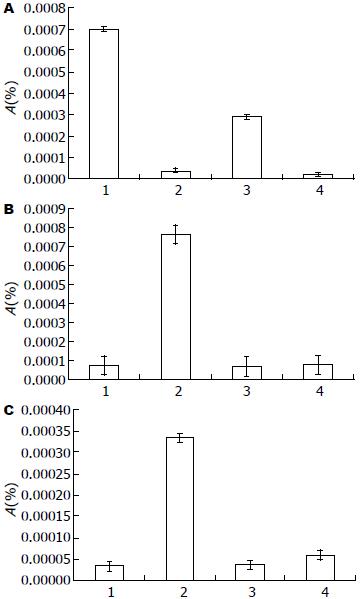
经Survivin ASON 200和400 nmol/L浓度抑制Survivin的表达后, Survivin蛋白表达量在200 nmol/L组(P = 0.0005)和400 nmol/L组(P<0.0001)较未处理组出现不同程度的降低. 且降低程度有浓度依赖性(P = 0.0005). caspase-7表达量在200 nmol/L组(P = 0.9)和400 nmol/L组(P = 0.7)较未处理组无明显变化. p21waf表达量在200 nmol/L组(P = 0.72)和400 nmol/L组(P = 0.11)较未处理组无明显变化(图1).
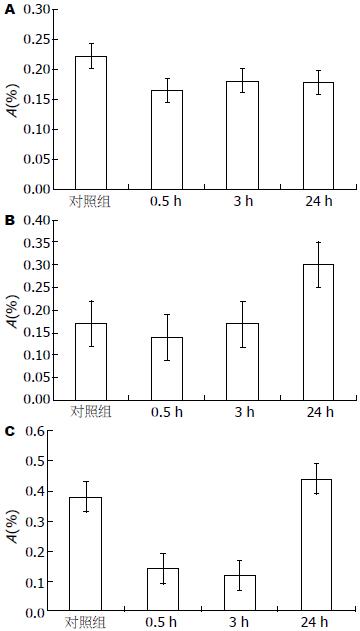
胃癌细胞SGC7901经IFN-γ处理0.5、3和24 h后, Survivin mRNA表达量下降(P<0.0001), caspase-7和p21waf mRNA的表达量均上升(均P = 0.03), 且均出现先下降后上升的趋势(图2).
SGC7901胃癌细胞在未处理组、IFN-γ处理组、Survivin ASON 200 nmol/L组和Survivin ASON 400 nmol/L组中, 凋亡细胞数无明显变化(P>0.05).
胃癌是我国最常见的恶性肿瘤之一, 一经发现多为进展期, 5年生存低. 胃癌细胞凋亡率较低,且Survivin表达水平与胃癌凋亡指数呈负相关[2]. Survivin是IAP家族的成员具有强抑制凋亡作用. Survivin主要存在与胚胎期及婴儿期, 在成熟的组织中完全下调或消失, 但是在恶性肿瘤中又会出现.
本研究在人体胃癌组织中发现Survivin与caspase-7正相关; p21waf与caspase-7正相关. 其结果提示人胃癌中Survivin的作用机制可能与其他肿瘤一致, 主要通过与caspase-7以及p21waf的结合, 实现抑制细胞凋亡功能. 为证实这一推测, 本研究选用了胃癌细胞系SGC7901作为研究模型. SGC7901是1981年建立的一株胃癌淋巴结转移癌细胞系, 该细胞系具有凋亡率低而Survivin表达高的特点[25], 是良好的符合本研究的体外模型.
通过使用不同浓度的Survivin ASON直接抑制Survivin的表达时, 我们发现Survivin表达出现明显抑制, 但是caspase-7以及p21waf表达并无明显变化. 印证了Survivin并非通过调控caspase-7以及p21waf的表达实现抑制细胞凋亡功能的理论推测.
通过IFN-γ刺激SGC7901细胞时, caspase-7以及p21waf表达上升, 同时, Survivin的表达明显下降. 结合前期研究[22], 该现象提示胃癌中, IFN-γ可抑制Survivin的表达, 同时促进caspase-7以及p21waf表达, 通过调控多条途径发挥其生物学作用, 其下游途径间调节机制及意义有待进一步研究.
在本研究中, IFN-γ作用于胃癌SGC7901细胞, 其细胞凋亡水平无明显变化, 该结果与Reed等研究结果一致[25]. 而当Survivin ASON抑制Survivin表达时, 细胞凋亡水平也无明显变化, 该结果与胃癌细胞系HS-746T和MKN-45中的实验结果不一致[17,18], 我们认为可能与本研究使用的Survivin ASON浓度有关, 并提示SGC7901细胞中可能存在多条凋亡抑制的途径.
Survivin是迄今发现作用最强的肿瘤细胞凋亡抑制因子之一. 34.5%胃癌组织不同程度表达Survivin, 且其表达水平与胃癌凋亡指数呈负相关. Survivin可与caspase-7和p21waf等结合抑制细胞凋亡. 干扰素γ(IFN-γ)是Ⅱ型干扰素中的唯一成员, 可通过上调p21waf和caspase-7的表达而促进细胞凋亡.
纪小龙, 教授, 武警总医院纳米医学研究所
近期的研究发现: 分别向胃癌细胞系HS-746T和MKN-45中导入Survivin反义寡核苷酸, 胃癌细胞凋亡均明显增强.
本研究证实IFN-γ对Survivin通路存在调控作用. 该结论可望进一步完善当前凋亡调控理论, 并为临床治疗提供新的角度和思考.
本文选题恰当, 对于治疗胃癌有一定的临床参考意义.
编辑: 曹丽鸥 电编:何基才
| 1. | Lauwers GY, Scott GV, Karpeh MS. Immunohistochemical evaluation of bcl-2 protein expression in gastric adenocarcinomas. Cancer. 1995;75:2209-2213. [PubMed] [DOI] |
| 2. | Lu CD, Altieri DC, Tanigawa N. Expression of a novel antiapoptosis gene, survivin, correlated with tumor cell apoptosis and p53 accumulation in gastric carcinomas. Cancer Res. 1998;58:1808-1812. [PubMed] |
| 3. | Giodini A, Kallio MJ, Wall NR, Gorbsky GJ, Tognin S, Marchisio PC, Symons M, Altieri DC. Regulation of microtubule stability and mitotic progression by survivin. Cancer Res. 2002;62:2462-2467. [PubMed] |
| 4. | Altieri DC, Marchisio PC. Survivin apoptosis: an interloper between cell death and cell proliferation in cancer. Lab Invest. 1999;79:1327-1333. [PubMed] |
| 5. | Birnbaum MJ, Clem RJ, Miller LK. An apoptosis-inhibiting gene from a nuclear polyhedrosis virus encoding a polypeptide with Cys/His sequence motifs. J Virol. 1994;68:2521-2528. [PubMed] |
| 6. | Crook NE, Clem RJ, Miller LK. An apoptosis-inhibiting baculovirus gene with a zinc finger-like motif. J Virol. 1993;67:2168-2174. [PubMed] |
| 7. | Deveraux QL, Reed JC. IAP family proteins--suppressors of apoptosis. Genes Dev. 1999;13:239-252. [PubMed] [DOI] |
| 8. | Verdecia MA, Huang H, Dutil E, Kaiser DA, Hunter T, Noel JP. Structure of the human anti-apoptotic protein survivin reveals a dimeric arrangement. Nat Struct Biol. 2000;7:602-608. [PubMed] [DOI] |
| 9. | Li F, Ambrosini G, Chu EY, Plescia J, Tognin S, Marchisio PC, Altieri DC. Control of apoptosis and mitotic spindle checkpoint by survivin. Nature. 1998;396:580-584. [PubMed] [DOI] |
| 10. | Adida C, Crotty PL, McGrath J, Berrebi D, Diebold J, Altieri DC. Developmentally regulated expression of the novel cancer anti-apoptosis gene survivin in human and mouse differentiation. Am J Pathol. 1998;152:43-49. [PubMed] |
| 11. | Ambrosini G, Adida C, Altieri DC. A novel anti-apoptosis gene, survivin, expressed in cancer and lymphoma. Nat Med. 1997;3:917-921. [PubMed] [DOI] |
| 12. | Riedl SJ, Renatus M, Schwarzenbacher R, Zhou Q, Sun C, Fesik SW, Liddington RC, Salvesen GS. Structural basis for the inhibition of caspase-3 by XIAP. Cell. 2001;104:791-800. [PubMed] |
| 13. | Monzó M, Rosell R, Felip E, Astudillo J, Sánchez JJ, Maestre J, Martín C, Font A, Barnadas A, Abad A. A novel anti-apoptosis gene: Re-expression of survivin messenger RNA as a prognosis marker in non-small-cell lung cancers. J Clin Oncol. 1999;17:2100-2104. [PubMed] |
| 14. | Swana HS, Grossman D, Anthony JN, Weiss RM, Altieri DC. Tumor content of the antiapoptosis molecule survivin and recurrence of bladder cancer. N Engl J Med. 1999;341:452-453. [PubMed] [DOI] |
| 15. | Adida C, Haioun C, Gaulard P, Lepage E, Morel P, Briere J, Dombret H, Reyes F, Diebold J, Gisselbrecht C. Prognostic significance of survivin expression in diffuse large B-cell lymphomas. Blood. 2000;96:1921-1925. [PubMed] |
| 16. | Kato J, Kuwabara Y, Mitani M, Shinoda N, Sato A, Toyama T, Mitsui A, Nishiwaki T, Moriyama S, Kudo J. Expression of survivin in esophageal cancer: correlation with the prognosis and response to chemotherapy. Int J Cancer. 2001;95:92-95. [PubMed] [DOI] |
| 17. | Deng H, Wu RL, Zhou HY, Huang X, Chen Y, Liu LJ. Significance of Survivin and PTEN expression in full lymph node-examined gastric cancer. World J Gastroenterol. 2006;12:1013-1017. [PubMed] |
| 18. | Deng H, Wu RL, Chen Y, Liu LJ. STAT1 and Survivin Expression in Full Lymph Node Examined Gastric Cancer by Using Tissue Microarray Technique. Chin Ger J Clin Oncol. 2006;5:249-252. [DOI] |
| 19. | Klampfer L. The role of signal transducers and activators of transcription in colon cancer. Front Biosci. 2008;13:2888-2899. [PubMed] [DOI] |
| 20. | Klampfer L. Signal transducers and activators of transcription (STATs): Novel targets of chemopreventive and chemotherapeutic drugs. Curr Cancer Drug Targets. 2006;6:107-121. [PubMed] [DOI] |
| 21. | Battle TE, Frank DA. The role of STATs in apoptosis. Curr Mol Med. 2002;2:381-392. [PubMed] [DOI] |
| 23. | Grandis JR, Drenning SD, Chakraborty A, Zhou MY, Zeng Q, Pitt AS, Tweardy DJ. Requirement of Stat3 but not Stat1 activation for epidermal growth factor receptor- mediated cell growth In vitro. J Clin Invest. 1998;102:1385-1392. [PubMed] [DOI] |