修回日期: 2010-08-22
接受日期: 2010-08-31
在线出版日期: 2010-10-28
目的: 研究组蛋白去乙酰化酶1(HDAC1)和组蛋白去乙酰化酶2(HDAC2)在大肠正常组织、腺瘤、腺癌组织中的表达, 探讨其可能的临床病理及预后的关系.
方法: 以免疫组织化学SP法检测HDAC1和HDAC2在正常大肠组织、腺瘤、腺癌组织中的表达. 通过计算染色指数(SI), 评估两者的表达水平与年龄、肿瘤大小、分期、分化等临床病理特征之间的关系. 采用Kaplan-Meier法进行生存分析.
结果: HDAC1和HDAC2在正常组织表达明显低于腺瘤及癌组织(14.3±9.3 vs 22.4±12.4, 22.8±8.5; 5.6±3.3, 12.3±4.2 vs 16.2±9.7, 均P<0.05). HDAC2在三者中的表达呈递增趋势. 直径≥5 cm的癌组织HDAC1的表达高于<5 cm的癌组织(25.1±8.2 vs 20.4±8.5), 差异均有统计学意义.
结论: HDAC1和HDAC2是大肠癌发生的早期事件, 两者共同促进大肠癌的发生发展, 可能成为大肠癌治疗的新靶点.
引文著录: 刘铁权, 孙明军, 魏敏杰. 组蛋白去乙酰化酶1、2在大肠癌及腺瘤组织中的表达及其与临床病理的关系. 世界华人消化杂志 2010; 18(30): 3195-3199
Revised: August 22, 2010
Accepted: August 31, 2010
Published online: October 28, 2010
AIM: To investigate the clinicopathological significance of expression of histone deacetylase 1 (HDAC1) and HDAC2 in colorectal adenoma and carcinoma.
METHODS: The expression of HDAC1 and HDAC2 in normal colorectal tissue, colorectal adenoma and carcinoma was determined by immunohistochemistry. Immunoreactivity was evaluated semiquantitatively using a staining index (SI). The correlation of the expression of the two epigenetic biomarkers with various clinicalpathological parameters in colorectal adenoma and carcinoma, such as age, tumor size and stage, was analyzed, and survival curves were calculated by the Kaplan-Meier method and the Log-rank test.
RESULTS: The expression of HDAC1 and HDAC2 was significantly lower in normal colorectal tissue than in colorectal adenoma and carcinoma (14.3 ± 9.3 vs 22.4 ± 12.4 and 22.8 ± 8.5; 5.6 ± 3.3 vs 12.3 ± 4.2 and 16.2 ± 9.7, all P < 0.05). The expression of HDAC2 increased in the following order: normal colorectal tissue, colorectal adenoma and carcinoma. The expression of HDAC1 was significantly higher in tumors ≥5 cm than in those < 5 cm (25.1 ± 8.2 vs 20.4 ± 8.5, P < 0.05).
CONCLUSION: Up-regulation of HDAC1 and HDAC2 expression plays a significant role in the development and progression of colorectal carcinoma.
- Citation: Liu TQ, Sun MJ, Wei MJ. Clinical pathological significance of expression of histone deacetylase 1 and 2 in colorectal adenoma and carcinoma. Shijie Huaren Xiaohua Zazhi 2010; 18(30): 3195-3199
- URL: https://www.wjgnet.com/1009-3079/full/v18/i30/3195.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i30.3195
大肠癌是常见的胃肠道恶性肿瘤, 近20年大肠癌发病呈现上升趋势[1]. 基因与环境因素在其发病中发挥重要作用. 普遍认为大肠癌的发病呈散发性. 然而, 散发的大肠癌中存在着遗传因素. 例如有大肠癌家族史的人发病率增高. 目前多数研究认为80%以上的大肠癌由大肠腺瘤演变而来, 内镜下摘除息肉可以降低大肠癌的发病率76%-90%[2]. 正常的肠上皮细胞经过多因素、多阶段和多种基因改变协同作用, 逐渐经由腺瘤发展成为癌. 所以癌基因的激活与抑癌基因的失活是大肠癌发生的分子基础[3]. 近年研究认为表观遗传修饰通过调控肿瘤相关基因的表达, 在大肠癌的发生和发展过程中起重要作用[4]. 表观遗传修饰主要包括组蛋白的乙酰化和去乙酰化修饰、DNA甲基化修饰、染色质重塑、非编码RNA调控等. 其中组蛋白去乙酰化酶(histone deacetylase, HDAC)是研究的热点之一. 本研究采用免疫组织化学的方法, 研究HDAC1和HDAC2在大肠腺瘤及癌组织中的表达, 并探索其可能的临床病理联系, 为大肠癌的诊治提供新的线索.
收集中国医科大学附属第一医院2003-2005年的大肠癌手术标本共94例, 同时选取大肠癌远端经病理证实的正常黏膜50例, 以及经肠镜电切的大肠腺瘤36例. 所有大肠癌患者均为第1次手术, 且术前未经放疗、化疗, 术后病理均为腺癌. 其中男54例, 女40例. 年龄36-76岁. 组织分化程度: 高分化35例、中分化30例、低分化29例. 伴淋巴结转移39例, 无淋巴结转移55例. 所有患者随访均满5年, 其中5例失访.
1.2.1 免疫组织化学染色: HDAC1、HDAC2均购自Santa Cruz生物技术有限公司, 通用型二抗及DAB显色液购自福州迈新生物技术公司. 进行常规免疫组织化学SP法染色. 采用微波修复10 min, HDAC1按照1:100稀释, HDAC2按1:50稀释, 二抗1:200稀释. 以PBS代替一抗作为阴性对照.
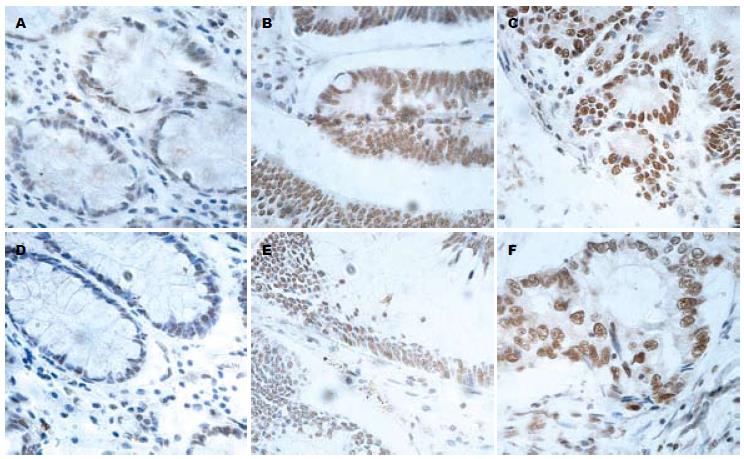
1.2.2 结果判定: HDAC1与HDAC2均为细胞核阳性表达, 染色为棕黄色颗粒状, 胞质、胞膜均不着色或着色很少. 根据多数细胞的染色状况判定染色结果. 根据细胞核染色强度, 分别记为0, 1, 2, 4, 6分. 根据阳性染色细胞比例评分, 记为1-6分. 以染色强度评分与细胞比例评分的乘积作为染色指数(staining index, SI)[5-8].
统计学处理 采用SPSS13.0统计软件, 所得数据以mean±SD表示, 各组之间的HDAC SI采用t检验或ANOVA方差分析, 采用Kaplan-Meier法分析HDAC1和HDAC2表达与生存率的关系, Log-rank检验, P<0.05有统计学意义.
HDAC1表达可见于正常组织, 腺瘤及腺癌组织中, 主要定位于细胞核中, 细胞质中着色很少(图1). 在正常组织中的表达较少(图1A); 而在腺瘤、癌组织中的表达明显增加(图1B, C), 三者的SI分别为14.3±9.3, 22.8±8.52, 24.1±2.4(表1). 癌组织及腺瘤中的表达明显高于正常组织(P<0.01), 但腺瘤和癌组织中的表达没有统计学意义(P>0.05). HDAC2表达与HDAC1类似, 可见于正常组织, 腺瘤及癌组织中, 主要定位于细胞核中, 细胞质中着色很少(图1). 在正常组织中表达很少(图1D); 而在腺瘤、癌组织中的表达逐渐增加(图1E, F). 三者的SI分别为5.6±3.3, 12.3±4.2, 16.2±9.7, 呈现逐渐递增的趋势(表1). 经ANOVA方差分析, 可以认为三者间差异有统计学意义(P<0.01).
在不同大小肿瘤中, 直径≥5 cm病变组的HDAC1表达高于直径<5 cm病变组, 两组SI分别为20.4±8.5, 25.1±8.2(表2), 差异有统计学意义(P<0.05). 而HDAC2在不同大小肿瘤中的表达没有明显差异. HDAC1和HDAC2的表达与大肠癌的其他临床病理特征间, 包括性别、年龄、肿瘤的分化程度、浸润深度以及临床分期间差别均没有统计学意义. 淋巴结转移阳性组的HDAC2表达强度高于淋巴结转移阴性组, 但差异无统计学意义.
| 临床病理参数 | n | HDAC1 | HDAC2 |
| 性别 | |||
| 男 | 54 | 22.7±8.1 | 17.1±10.1 |
| 女 | 40 | 22.9±9.2 | 15.4±9.4 |
| 年龄(岁) | |||
| ≤60 | 46 | 24.6±8.9 | 16.6±9.6 |
| >60 | 48 | 21.3±8.0 | 15.8±10.1 |
| 肿瘤大小(cm) | |||
| <5 | 43 | 20.4±8.5 | 15.1±9.8 |
| ≥5 | 51 | 25.1±8.2 | 17.4±9.6 |
| 肿瘤分化程度 | |||
| 高分化 | 35 | 18.8±7.1 | 14.0±10.1 |
| 中分化 | 30 | 23.1±9.8 | 16.1±8.8 |
| 低分化 | 29 | 25.6±7.5 | 10.4±2.0 |
| 淋巴结转移 | |||
| 阴性 | 55 | 22.6±8.3 | 14.6±8.4 |
| 阳性 | 39 | 22.5±8.7 | 18.3±11.0 |
| 浸润深度 | |||
| M, SM, MP | 16 | 21.8±9.3 | 15.8±10.7 |
| SS, SE, SI | 78 | 23.1±8.4 | 16.3±9.6 |
| TNM分期 | |||
| Ⅰ | 18 | 21.8±10.4 | 13.0±9.0 |
| Ⅱ | 28 | 23.3±8.0 | 15.1±8.2 |
| Ⅲ | 44 | 23.0±8.8 | 18.7±11.0 |
| Ⅳ | 4 | 17.0±6.0 | 26.0±7.0 |
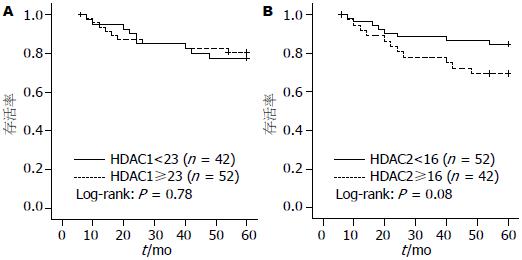
通过对患者手术后5年的随访, 我们进行了Kaplan-Meier法生存分析. 分别以HDAC1和HDAC2的SI平均值为界限, 将患者分为两组. 分析结果显示, HDAC2低表达组生存率高于HDAC2高表达组, 但差异无统计学意义(P = 0.08). HDAC1高表达组与低表达组生存率几乎相同(图2).
组蛋白修饰, 最主要的是组蛋白的乙酰化与去乙酰化, 受到组蛋白乙酰化酶(histone acetylase, HAT)和HDAC的调控, 两者是可逆的. 在肿瘤发生中, 组蛋白修饰主要是抑癌基因的低乙酰基化. 组蛋白去乙酰化后染色体处于关闭状态而不利于转录, 因此发生在抑癌基因的组蛋白低乙酰基化将抑制该基因的表达.
HDAC不仅对维持正常结直肠黏膜细胞的功能起着很重要的作用, 而且对于生长发育也发挥重要作用. HDAC1、2的主要作用是促进结肠细胞的增殖, 阻碍其异常分化[9]. HDAC2突变小鼠的上皮细胞数和黏膜厚度明显减少[10]. 敲除HDAC1的小鼠胚胎由于增殖缺陷和发育障碍会导致死亡率增加[11]. 在HDAC2敲除的小鼠中, 发现广泛的HDAC2缺失会导致小鼠围产期死于一系列心脏缺陷[11]. 但HDAC的过表达或结构的异常能够通过使组蛋白、非组蛋白去除乙酰基, 从而减少基因转录子接近的途径, 导致参与细胞分化的蛋白表达减少, 细胞周期阻滞和受损细胞凋亡消失. HDAC的过度表达通过至少两种途径促进肿瘤的进展: 第一, HDAC的过表达通过诱导启动子核心区组蛋白去乙酰化而有助于基因的转录阻遏, 从而影响细胞的生长抑制、转化、凋亡; 第二, HDAC的过表达可以诱导去乙酰化, 调控多种非组蛋白功能, 包括转录因子和关键的胞质蛋白[12].
腺瘤是一种重要的癌前病变, 随着大肠镜技术的广泛开展, 其检出率逐渐上升. 我们研究了正常组织、腺瘤及癌组织中HDAC的表达, 显示HDAC1在正常组织中表达要明显低于腺瘤及癌组织, 腺瘤与癌组织中的表达差异不明显. HDAC2的表达在正常组织、腺瘤、癌组织中呈现逐渐递增趋势, 差异有统计学意义. 这种呈递增趋势的表达结果预示腺瘤的恶变可能与HDAC2的表达水平相关, 高水平的HDAC2表达可能预示着腺瘤的恶变率升高. Kim等[13]研究证实, HDAC1的过度表达抑制肿瘤抑制基因P53的表达, 促进内皮细胞血管生成, 促进肿瘤发生. 本试验结果显示, 大肠腺瘤中与大肠癌同样存在着明显的表观遗传改变. 腺瘤是发生大肠癌的一个独立的危险因素, 预防或治疗腺瘤对于预防大肠癌具有重要意义. 已有研究证实高纤维素饮食能降低大肠癌发病率, 其机制是纤维素能间接引起细胞核中高度乙酰化组蛋白的聚集, 从而抑制细胞的增殖[14]. 因此良好的饮食习惯也可以降低腺瘤的发病率, 从而降低大肠癌发生的风险.
本实验中, HDAC1和HDAC2的表达与年龄、性别、肿瘤的浸润深度、淋巴结转移、分化程度、分期等临床病理特征之间没有明显关系(P>0.05), 与Ashktorab等[7]和Ishihama等[8]的研究结果一致. 不同大小肿瘤的HDAC1表达不同, HDAC1在≥5 cm的肿瘤中的表达明显高于<5 cm的肿瘤, 而HDAC2在两者中的表达没有明显差异. 以上结果提示过度的HDAC1表达会刺激肿瘤细胞的生长, 缩短肿瘤细胞的倍增时间. Ⅰ型HDAC的过度表达会促进大肠癌细胞的生长, 基因敲除Ⅰ型HDAC的1, 2, 3会较少, 例如HCT-116[15], HT-29[16]和SW480[17]细胞株的生长. 张孟贤等[18]通过转染HDAC1 shRNA体外作用于大肠癌细胞SW480, 发现HDAC1基因沉默可以诱导细胞凋亡的发生, 从而抑制细胞的增殖. 同样, HDAC抑制剂MS-275能够抑制大肠癌细胞株的生长、激活抑癌基因P21的表达[18]. Wilson等[15]和Saito等[19]证实, HDAC的促增殖作用与P21的抑制相关. 制霉菌素A可使细胞阻滞在G1和G2期, 其中G1期阻滞表型是由于HDAC对P21等关键的细胞周期调控基因的转录阻滞作用被解除所致. 基因敲除HDAC的1、2、3会产生与HDAC抑制剂类似的P21诱导作用[20]. 这些数据均证实HDAC1使抑癌基因发生沉默, 促进肿瘤细胞生长.
通过我们对手术后患者5年的随访, 分析了HDAC1和HDAC2的表达与生存率的关系. 结果显示二者表达的差异不影响患者的远期生存率. 这与Ashktorab等[7]和Ishihama等[8]的研究结果一致. 提示HDAC的过度表达与疾病的进展不相关. 然而和以往试验一样, 由于早期进行大肠癌根治手术生存率较晚期明显升高, 且本试验TNMⅠ期和Ⅱ期患者占总数的50%, 中晚期患者例数较少, 因此进行生存率比较可能存在偏倚. HDAC的表达与肿瘤患者的预后是否相关, 还需要进一步地随访研究.
以往有实验检测大肠中HDAC1和HDAC2的表达, 但对于正常组织、腺瘤、癌组织三者的联合检测还未见报道. 本试验结果证实HDAC1和HDAC2在大肠癌的发生进展中发挥不同作用. 虽然作用机制尚不十分明确, 但HDAC的过度表达会影响一系列抑癌基因的表达, 从而引起上皮细胞的异型增生. 基因突变是不可逆的, 而表观遗传的改变是可以逆转的, 在散发的大肠癌在表观遗传可能起更主要的作用. 目前正在进行的HDAC抑制剂基础实验表现出了多种机制的抗肿瘤作用, 因此抗HDAC是未来肿瘤治疗的一个新靶点. 本试验研究结果进一步对HDAC抑制剂治疗大肠癌提供了理论依据.
表观遗传改变是大肠癌重要发病机制之一, 其中组蛋白乙酰化和去乙酰化是其中的一个研究热点. 已有资料表明肿瘤组织中组蛋白去乙酰化酶表达增加, 而组蛋白去乙酰化酶, 是肿瘤治疗的新靶点. 目前国内对于组蛋白去乙酰化酶在大肠癌及腺瘤中的表达还未见系统研究.
颜宏利, 教授, 中国人民解放军第二军医大学遗传学教研室
Stephan等研究了HDAC2变异小鼠的身体发育和肿瘤发展. 这些Ⅰ类HDAC变异的小鼠能够生长发育, 但是比正常小鼠小约25%, 并且结肠黏膜细胞数和厚度较正常小鼠少. 与野生型HDAC2相比, 由于HDAC2变异的胚胎成纤维细胞失去了对IGF的反应, IGF失去了诱导细胞增加的能力.
本试验在国内首先采用免疫组织化学法, 系统地研究了正常大肠组织、腺瘤及大肠癌组织中组蛋白去乙酰化酶的表达.
本试验证实了大肠癌中组蛋白去乙酰化酶的过度表达, 进一步为大肠癌的靶向治疗提供了理论依据.
本文选题恰当, 设计合理, 对于了解HDAC的作用机制和有针对性的选择治疗药物具有很重要的意义.
编辑: 李军亮 电编:何基才
| 1. | Jemal A, Siegel R, Ward E, Murray T, Xu J, Thun MJ. Cancer statistics, 2007. CA Cancer J Clin. 2007;57:43-66. [PubMed] [DOI] |
| 2. | Winawer SJ, Zauber AG, Ho MN, O'Brien MJ, Gottlieb LS, Sternberg SS, Waye JD, Schapiro M, Bond JH, Panish JF. Prevention of colorectal cancer by colonoscopic polypectomy. The National Polyp Study Workgroup. N Engl J Med. 1993;329:1977-1981. [PubMed] [DOI] |
| 3. | Vogelstein B, Kinzler KW. The multistep nature of cancer. Trends Genet. 1993;9:138-141. [PubMed] [DOI] |
| 4. | Kanwal R, Gupta S. Epigenetics and cancer. J Appl Physiol. 2010;109:598-605. [PubMed] [DOI] |
| 5. | Handa K, Yamakawa M, Takeda H, Kimura S, Takahashi T. Expression of cell cycle markers in colorectal carcinoma: superiority of cyclin A as an indicator of poor prognosis. Int J Cancer. 1999;84:225-233. [PubMed] [DOI] |
| 6. | King RJ, Coffer AI, Gilbert J, Lewis K, Nash R, Millis R, Raju S, Taylor RW. Histochemical studies with a monoclonal antibody raised against a partially purified soluble estradiol receptor preparation from human myometrium. Cancer Res. 1985;45:5728-5733. [PubMed] |
| 7. | Ashktorab H, Belgrave K, Hosseinkhah F, Brim H, Nouraie M, Takkikto M, Hewitt S, Lee EL, Dashwood RH, Smoot D. Global histone H4 acetylation and HDAC2 expression in colon adenoma and carcinoma. Dig Dis Sci. 2009;54:2109-2117. [PubMed] [DOI] |
| 8. | Ishihama K, Yamakawa M, Semba S, Takeda H, Kawata S, Kimura S, Kimura W. Expression of HDAC1 and CBP/p300 in human colorectal carcinomas. J Clin Pathol. 2007;60:1205-1210. [PubMed] [DOI] |
| 9. | Tou L, Liu Q, Shivdasani RA. Regulation of mammalian epithelial differentiation and intestine development by class I histone deacetylases. Mol Cell Biol. 2004;24:3132-3139. [PubMed] [DOI] |
| 10. | Zimmermann S, Kiefer F, Prudenziati M, Spiller C, Hansen J, Floss T, Wurst W, Minucci S, Göttlicher M. Reduced body size and decreased intestinal tumor rates in HDAC2-mutant mice. Cancer Res. 2007;67:9047-9054. [PubMed] [DOI] |
| 11. | Montgomery RL, Davis CA, Potthoff MJ, Haberland M, Fielitz J, Qi X, Hill JA, Richardson JA, Olson EN. Histone deacetylases 1 and 2 redundantly regulate cardiac morphogenesis, growth, and contractility. Genes Dev. 2007;21:1790-1802. [PubMed] [DOI] |
| 12. | Mariadason JM. HDACs and HDAC inhibitors in colon cancer. Epigenetics. 2008;3:28-37. [PubMed] [DOI] |
| 13. | Kim MS, Kwon HJ, Lee YM, Baek JH, Jang JE, Lee SW, Moon EJ, Kim HS, Lee SK, Chung HY. Histone deacetylases induce angiogenesis by negative regulation of tumor suppressor genes. Nat Med. 2001;7:437-443. [PubMed] [DOI] |
| 14. | Archer SY, Meng S, Shei A, Hodin RA. p21(WAF1) is required for butyrate-mediated growth inhibition of human colon cancer cells. Proc Natl Acad Sci U S A. 1998;95:6791-6796. [PubMed] [DOI] |
| 15. | Wilson AJ, Byun DS, Popova N, Murray LB, L'Italien K, Sowa Y, Arango D, Velcich A, Augenlicht LH, Mariadason JM. Histone deacetylase 3 (HDAC3) and other class I HDACs regulate colon cell maturation and p21 expression and are deregulated in human colon cancer. J Biol Chem. 2006;281:13548-13558. [PubMed] [DOI] |
| 16. | Zhu P, Martin E, Mengwasser J, Schlag P, Janssen KP, Göttlicher M. Induction of HDAC2 expression upon loss of APC in colorectal tumorigenesis. Cancer Cell. 2004;5:455-463. [PubMed] [DOI] |
| 17. | Spurling CC, Godman CA, Noonan EJ, Rasmussen TP, Rosenberg DW, Giardina C. HDAC3 overexpression and colon cancer cell proliferation and differentiation. Mol Carcinog. 2008;47:137-147. [PubMed] [DOI] |
| 19. | Saito A, Yamashita T, Mariko Y, Nosaka Y, Tsuchiya K, Ando T, Suzuki T, Tsuruo T, Nakanishi O. A synthetic inhibitor of histone deacetylase, MS-27-275, with marked in vivo antitumor activity against human tumors. Proc Natl Acad Sci U S A. 1999;96:4592-4597. [PubMed] [DOI] |
| 20. | Habold C, Poehlmann A, Bajbouj K, Hartig R, Korkmaz KS, Roessner A, Schneider-Stock R. Trichostatin A causes p53 to switch oxidative-damaged colorectal cancer cells from cell cycle arrest into apoptosis. J Cell Mol Med. 2008;12:607-621. [PubMed] [DOI] |