修回日期: 2010-09-29
接受日期: 2010-10-13
在线出版日期: 2010-10-28
目的: 探讨姜黄素对CCl4处理的大鼠肝组织中PAI-1和u-PA蛋白表达的影响.
方法: 100只♂SD大鼠, 随机分为5组: 正常对照组(N), 肝纤维化模型组(M), 姜黄素低剂量组(Cl), 姜黄素中剂量组(Cm), 姜黄素高剂量组(Ch). M组以CCl4腹腔注射造模, Cl、Cm、Ch组除腹腔注射CCl4外, 分别以不同剂量的姜黄素灌胃; 每组分别在实验第4、7、21、42天随机取大鼠5只处死, 留取同部位肝脏组织行HE染色, 用免疫组织化学法检测各组大鼠肝脏组织中PAI-1和u-PA蛋白的表达情况.
结果: 在M组, 随时间延长, PAI-1和u-PA蛋白表达均不同程度增加, 姜黄素低、中、高剂量干预组与M组相比, 姜黄素能降低PAI-1蛋白表达(42 d: 5.60±1.673, 3.40±1.673, 2.40±1.140 vs 8.80±2.168, 均P<0.05), 增加u-PA蛋白表达(42 d: 6.00±1.414, 9.20±1.643, 9.80±2.049 vs 4.20±1.095, P<0.05), 其作用强度具有剂量和时间依赖性.
结论: 姜黄素可通过调节肝纤维化大鼠PAI-1与u-PA蛋白表达, 发挥抗肝纤维化作用.
引文著录: 段雪辉, 汤绍辉, 杨冬华, 黄思敏. 姜黄素对CCl4处理的大鼠PAI-1与u-PA蛋白表达的影响. 世界华人消化杂志 2010; 18(30): 3181-3186
Revised: September 29, 2010
Accepted: October 13, 2010
Published online: October 28, 2010
AIM: To investigate the effects of curcumin on the expression of plasminogen activator inhibitor-1 (PAI-1) and urokinase-type plasminogen activator (u-PA) in carbon tetrachloride-induced hepatic fibrosis in rats.
METHODS: One hundred male Sprague-Dawley rats were randomly divided into five groups: normal group, model group, low-, medium- and high-dose curcumin group. Except the normal group, the rats of the other groups were intraperitoneally injected with carbon tetrachloride for 6 wk to induce liver fibrosis. The rats of the low-, medium- and high-dose curcumin groups were administrated different doses of curcumin. On days 4, 7, 21 and 42 after treatment, five rats randomly selected from each group were sacrificed to take liver specimens for pathological examination (HE). The expression of PAI-1 and u-PA in hepatic fibrosis was detected by immunohistochemistry.
RESULTS: The expression levels of PAI-1 and u-PA were much lower in the normal group than in the model group. Compared to the model group, PAI-1 expression was significantly down-regulated (42 d: 5.60 ± 1.673, 3.40 ± 1.673, 2.40 ± 1.140 vs 8.80 ± 2.168, all P < 0.05) and u-PA expression was significantly up-regulated (42 d: 6.00 ± 1.414, 9.20 ± 1.643, 9.80 ± 2.049 vs 4.20 ± 1.095, P < 0.05) in the low-, medium- and high-dose curcumin groups. Curcumin treatment altered the expression of PAI-1 and u-PA in a dose- and time-dependent manner.
CONCLUSION: Curcumin exerts anti-fibrotic effects possibly by decreasing the expression of PAI-1 and increasing the expression of u-PA.
- Citation: Duan XH, Tang SH, Yang DH, Huang SM. Curcumin down-regulates PAI-1 expression but up-regulates u-PA expression in carbon tetrachloride-induced hepatic fibrosis in rats. Shijie Huaren Xiaohua Zazhi 2010; 18(30): 3181-3186
- URL: https://www.wjgnet.com/1009-3079/full/v18/i30/3181.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i30.3181
肝纤维化是进一步向肝硬化发展的主要中间环节. 目前认为, 肝脏慢性损伤过程中细胞外基质(extracellular matrix, ECM)累积所形成的肝纤维化是可逆的. 随着对肝纤维化发生机制认识地不断深入, 特别是对ECM的合成与降解的调控有了更多的了解, 近年来的研究认为加快降解比抑制合成更重要[1]. 纤溶系统, 特别是尿激酶型纤溶酶原激活物(urokinase-type plasminogen activator, u-PA)及1-型纤溶酶原激活抑制物(plasminogen activator inhibitor-1, PAI-1)与以ECM过多沉积为特征的纤维化疾病关系密切. 近年来, 大量国内外研究证实姜黄素通过抑制肝星状细胞(hepatic stellate cell, HSC)活化而具有抗肝纤维化作用, 但目前尚未见有关姜黄素对纤溶系统表达影响的研究报道. 本研究旨在探讨姜黄素通过对大鼠肝纤维化模型纤溶系统成分(PAI-1, u-PA)表达的影响, 以进一步明确姜黄素的抗肝纤维化作用机制.
实验动物: SPF(special pathogen free)级SD(Sprague-Dawley)♂大鼠, 购自广东省医学实验动物中心, 体质量190-220 g. 姜黄素为法国Fluka公司产品. 兔抗大鼠u-PA多克隆抗体、兔抗大鼠PAI-1多克隆抗体、即用型SABC免疫组织化学染色试剂盒和DAB显色试剂盒均购自武汉博士德生物工程有限公司.
1.2.1 分组及用药: 100只♂SD大鼠, 随机分为5组: 正常对照(N)组, 腹腔注射生理盐水, 生理盐水灌胃; 模型(M)组, 腹腔注射40% CCl4溶液1 mL/kg, 每周2次, 羧甲基纤维素钠(姜黄素配料)灌胃, 每天1次, 共6 wk; 姜黄素低剂量(Cl)组, 造模同时给低剂量(100 mg/kg)姜黄素灌胃, 每天1次; 姜黄素中剂量(Cm)组, 造模同时给中剂量(200 mg/kg)姜黄素灌胃; 姜黄素高剂量(Ch)组, 造模同时给高剂量(300 mg/kg)姜黄素灌胃. 分别在实验第4、7、21、42天, 每组随机处死5只大鼠, 切除同一解剖部位的肝脏于3.33 mol/L的甲醛溶液中固定, 石蜡包埋, 行HE染色.
1.2.2 检测方法: 按SABC免疫组织化学染色试剂盒说明操作, 阳性反应呈棕黄色. 结果判断: 所有病理切片均由资深病理医师在不知病例资料的前提下阅片. 每张免疫组织化学染色切片至少在镜下(×100)观察10个不重复视野, 判断细胞显色部位、显色强度和显色范围. 结果判断参照免疫组织化学显色标准[2]: PAI-1及u-PA蛋白阳性表达部位均位于细胞质, 显色程度分呈浅棕色、棕色、深棕色, 用+、++ 、+++记录; 细胞显色范围占高倍视野<25%时记录为+、25%-50%为++、50%-75%为+++、>75%为++++. 并将显色程度和范围换算成显色指数: 显色指数 = 显色程度×显色范围(+、++、+++、++++分别按1、2、3、4分计算).
统计学处理 计量资料采用mean±SD表示, 使用SPSS11.50统计软件进行统计分析. 多组数据间比较采用单因素方差分析(One-way ANOVA), 进行方差齐性检验, 若各组总体方差齐同, 采用Tukey(分组≥5)检验; 若各组总体方差不齐同, 采用Tamhane's T2检验. P<0.05为差异具有统计学意义.
100只SPF级SD♂大鼠中死亡7只, 其中, N组第31天死亡1只, M组第3天死亡1只, Cl组第11天死亡1只, Cm组第6、11、17、31天各死亡1只, 死亡率为7%.
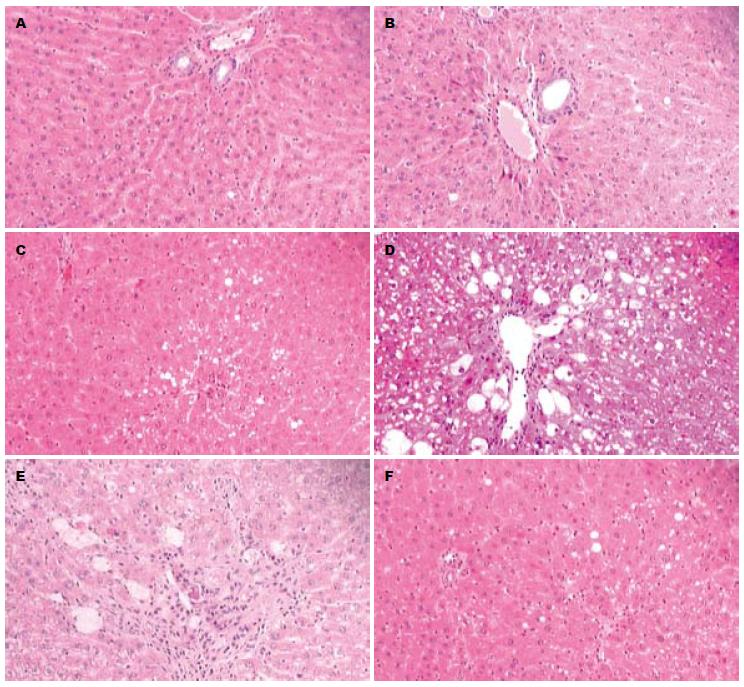
N组: 各时间段无明显区别, 肝组织结构清晰, 肝细胞大小均匀, 无变性、坏死, 肝小叶结构清晰, 小叶内肝细胞索排列较整齐; M组: 4 d时与N组无明显区别; 7 d时肝小叶中央区中央静脉周围出现较多坏死细胞, 还有少量细胞气球样变和脂肪变性; 21 d时见大量气球样变性和脂肪变性, 汇管区见纤维组织汇集; 42 d时可见肝细胞明显脂肪变性、气球样变性, 汇管区纤维组织增生明显, 形成小的条索, 但未形成假小叶. Cl组: 各时间段肝细胞发生气球样变和脂肪样变较M组少. Cm组: 各时间段肝细胞变性坏死情况介于Cl组和Ch组之间, 可见少量肝细胞气球样变性. Ch组: 各时间段肝细胞的脂肪变性和气球样变性明显减轻, 接近N组, 纤维组织增生不明显(图1).
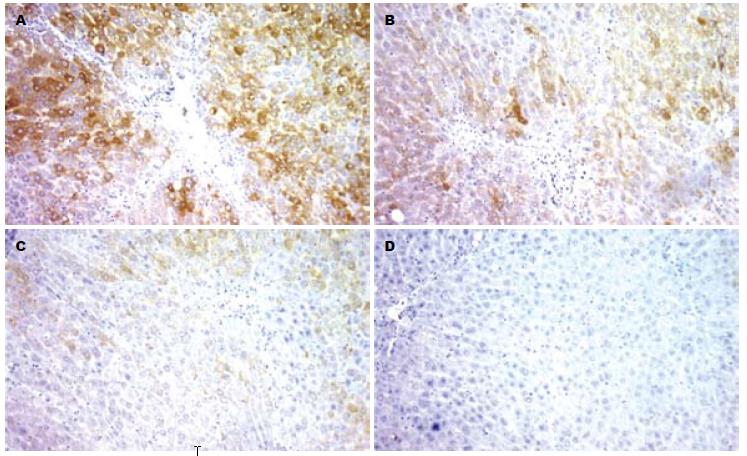
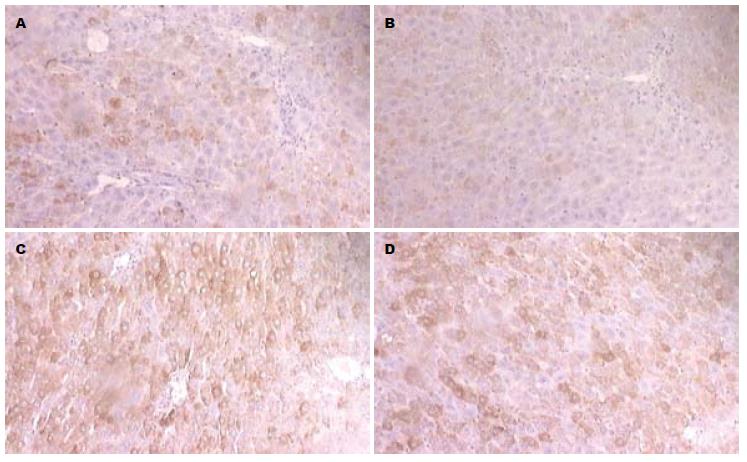
N组PAI-1蛋白表达很低; M组随造模时间延长, PAI-1表达逐渐增多, 42 d时于汇管区、纤维间隔、血管和肝窦可见大量PAI-1呈阳性染色, 毗邻的肝细胞质内亦可见阳性染色; 与M组相比, 姜黄素干预组显色指数均降低, 以42 d时明显(P<0.05, 表1, 图2)
肝纤维化的实质是慢性肝损伤的修复反应, 导致以胶原为主的ECM各成分合成增多, 降解相对不足, 致使ECM在肝内过多沉积. 因此, 阻抑ECM增生与沉积, 促进ECM各成分的降解无疑是抗肝纤维化治疗的一条重要途径.
纤溶系统主要包括纤溶酶原、纤溶酶、纤溶酶原激活物(plasminogen activator, PA)、纤溶酶原激活物抑制剂(plasminogen activator inhibitor, PAI). PA分为u-PA和组织纤溶酶原激活物(tissue-type plasminogen activator t-PA). u-PA前体广泛存在于结缔组织中, 内皮细胞、成纤维细胞和单核细胞均可合成和分泌u-PA, 培养的人肝细胞亦可分泌u-PA. u-PA主要作用于生理和病理条件下细胞迁移、组织重建、肿瘤浸润及转移等过程, 其中包括ECM的降解过程[3]. PAI有多种, PAI-1和PAI-2是其中最重要的亚型, 正常人血浆中主要是PAI-1, PAI-1是PA高效的抑制因子, 其组织内水平的升高和活性的增强能有效抑制PA的活化, 从而显著抑制纤维蛋白水解和ECM降解, 促进肝纤维化. 研究表明PAI-1的含量及活性在肝脏中最高[4], 正常大鼠肝脏中u-PA和PAI-1极少或检测不到其表达量, 而部分肝切除后肝再生时, 纤溶酶、PAI-1表过显著增多[5]. 研究显示PAI-1表达于病变肝组织肝纤维化活动活跃的部位, 随肝纤维化程度的加重, PAI-1蛋白表达的着色积分明显增加. 血浆中PAI-1的抗原水平随肝纤维化程度的增加而明显增加[6]. u-PA可激活纤溶酶原使之成为纤溶酶, 两者可以直接或经激活胶原酶降解ECM及基底膜中胶原成分[7]. u-PA还可激活纤溶酶原并调节基质金属蛋白酶(matrix metalloproteinases, MMPs)活性以降解ECM, 而PAI-1则可特异性抑制u-PA的这种作用. MMPs是参与ECM降解的主要酶家族, 能降解多种胶原性和非胶原性蛋白. 金属蛋白酶组织抑制物(tissue inhibitor of metalloproteinase, TIMPs)可抑制MMPs的活性, MMPs和TIMPs主要由HSC生成, 当HSC被激活后, 最终使MMPs表达减少, TIMPs表达增加, 致ECM降解减少、沉积增加[8,9]. 而u-PA可通过u-PA-纤溶酶-MMPs级联反应途径上调纤溶酶和MMPs活性, 降解多种ECM成分, 抑制肝纤维化进程[10]. 在u-PA、纤溶酶及MMPs构成的级联激活途径中, u-PA活性的改变会直接影响纤维化进程. 因此通过调节u-PA和PAI-1表达很有可能成为抗纤维化治疗的有效方法[11].
本研究用CCl4制造大鼠肝纤维化模型, 同时使用姜黄素干预, 观察在病理条件下肝组织PAI-1和u-PA蛋白表达变化, 以进一步明确姜黄素的抗肝纤维化作用机制.
经病理组织学证实, 持续恒浓度腹腔注射CCl4 6 wk能成功制造大鼠肝纤维化模型, 同时使用姜黄素干预发现, 各个剂量的姜黄素均能明显减少肝细胞变性、坏死, 纤维组织增生程度较M组明显减轻, 且仅局限于血管周围, 以上作用强度随着剂量增大而增强, Ch组接近N组, 与刘永刚等[12]的研究报道结果一致, 提示姜黄素能够明显改善实验性大鼠肝纤维化. 在明确姜黄素具有抗肝纤维化情况下, 本研究详细分析了姜黄素对纤溶系统的影响. 我们的结果显示, 在N组, 各时间段大鼠肝组织PAI-1和u-PA蛋白表达极少, 与Thornton等[5]的研究结果一致. 对M组测定结果显示, PAI-1蛋白表达随肝纤维化程度的增强而明显增加, 结果导致ECM的大量合成; u-PA蛋白表达随肝纤维化程度的增加而先升高后降低, 以7 d时为最大值, 然后下降, 与Leyland等[10]报道的结果相似, 出现这种情况的可能原因是: 肝纤维化形成早期u-PA大量表达, 随着肝纤维化的逐渐形成, PAI-1蛋白表达逐渐增加, 对u-PA蛋白表达的抑制作用逐渐增强, 继而抑制纤溶酶原的激活, 因而u-PA对ECM的降解作用减弱, 这提示u-PA蛋白表达早期增加可能会导致肝纤维化早期ECM成分的降解, 但是由于随着肝纤维化的进展, PAI-1对u-PA的抑制作用加强, 导致ECM的合成增加, 降解减少, 促进肝纤维化的形成. 在姜黄素干预组, 不同剂量的姜黄素均可不同程度降低肝组织PAI-1蛋白表达, 且降低程度与剂量呈正相关. 随时间推移, Cl和Ch组中u-PA蛋白表达增加, 表明姜黄素在降低PAI-1蛋白表达, 使PAI-1抑制u-PA作用减弱的同时, 促进u-PA蛋白表达, 但Cl组作用不明显, 可能与低剂量姜黄素主要降低PAI-1蛋白表达的作用, 尚未达到促进u-PA蛋白表达增加的有效作用浓度有关. 总之, 在ECM合成与降解之间的动态平衡中, 姜黄素一方面能够通过增加u-PA蛋白表达, 而u-PA可通过u-PA-纤溶酶-MMPs级联反应途径上调纤溶酶和MMPs活性, 降解多种ECM成分, 抑制肝纤维化进程; 另一方面能够通过降低PAI-1蛋白表达, 使PAI-1抑制u-PA/u-PAR和纤溶酶的作用减弱, 阻抑ECM增生与沉积, 达到抗肝纤维化的作用.
肝纤维化是向肝硬化发展的中间环节, 近年已明确肝星状细胞(HSC)是肝纤维化的中心环节, 是肝纤维化时细胞外基质(ECM)过多产生和沉积的主要细胞来源. 正常情况下, ECM的合成与降解处于动态平衡, 肝纤维化时这种平衡被打破, 导致胶原生成增多、ECM过多沉积的肝纤维化病理改变.
吴俊华, 副主任医师, 南京大学医学院功能评价中心
目前, 国内外对细胞外基质方面的研究主要是集中在抑制肝星状细胞活化、阻止胶原生成和促进胶原降解方面; 关于肝纤维化过程中纤溶系统所受影响的研究文献较少, 国内外尚未见有关姜黄素对肝纤维化纤溶系统表达影响方面的研究报道.
沃兴德等研究发现姜黄醇提取物不仅使PAI-1含量显著降低, 而且也能提高u-PA的含量, 故认为姜黄醇提取物具有很好的促纤溶活性.
姜黄素通过抑制HSC增殖达到抗肝纤维化的作用已被证实, 本研究是首次探讨姜黄素对肝纤维化纤溶系统成分表达的影响, 以进一步探讨姜黄素抗肝纤维化的作用机制.
姜黄素可通过调节肝纤维化大鼠PAI-1与u-PA蛋白表达, 发挥抗肝纤维化作用.
本文选题新颖, 具有一定的研究意义.
编辑: 李薇 电编:何基才
| 3. | Saksela O, Rifkin DB. Cell-associated plasminogen activation: regulation and physiological functions. Annu Rev Cell Biol. 1988;4:93-126. [PubMed] [DOI] |
| 4. | Simpson AJ, Booth NA, Moore NR, Bennett B. Distribution of plasminogen activator inhibitor (PAI-1) in tissues. J Clin Pathol. 1991;44:139-143. [PubMed] [DOI] |
| 5. | Thornton AJ, Bruzdzinski CJ, Raper SE, Gelehrter TD. Plasminogen activator inhibitor-1 is an immediate early response gene in regenerating rat liver. Cancer Res. 1994;54:1337-1343. [PubMed] |
| 6. | Inuzuka S, Ueno T, Torimura T, Tamaki S, Sugawara H, Sakata R, Kusaba N, Sata M, Tanikawa K. The significance of colocalization of plasminogen activator inhibitor-1 and vitronectin in hepatic fibrosis. Scand J Gastroenterol. 1997;32:1052-1060. [PubMed] [DOI] |
| 7. | Fitch P, Bennett B, Booth NA, Croll A, Ewen SW. Distribution of plasminogen activator inhibitor in normal liver, cirrhotic liver, and liver with metastases. J Clin Pathol. 1994;47:218-221. [PubMed] [DOI] |
| 8. | Takahara T, Furui K, Funaki J, Nakayama Y, Itoh H, Miyabayashi C, Sato H, Seiki M, Ooshima A, Watanabe A. Increased expression of matrix metalloproteinase-II in experimental liver fibrosis in rats. Hepatology. 1995;21:787-795. [PubMed] [DOI] |
| 9. | Arthur MJ, Mann DA, Iredale JP. Tissue inhibitors of metalloproteinases, hepatic stellate cells and liver fibrosis. J Gastroenterol Hepatol. 1998;13 Suppl:S33-S38. [PubMed] |
| 10. | Leyland H, Gentry J, Arthur MJ, Benyon RC. The plasminogen-activating system in hepatic stellate cells. Hepatology. 1996;24:1172-1178. [PubMed] [DOI] |