修回日期: 2010-09-18
接受日期: 2010-09-27
在线出版日期: 2010-10-28
目的: 探讨胰岛素抵抗(IR)在非酒精性脂肪肝(NAFL)大鼠脂肪肝模型中的作用机制.
方法: 大鼠随机分为空白对照组, 脂肪肝模型对照组(模型+生理盐水组)和脂肪肝实验组(模型+罗格列酮组). 其中脂肪肝模型对照组和脂肪肝实验组分别予生理盐水和马来酸罗格列酮干预治疗4 wk. 观察各组大鼠肝脏大体形态和组织学改变; 检测空腹血糖(FPG), 空腹血胰岛素水平(FINS), 计算胰岛素抵抗指数(IRI); 检测血浆ApoCⅡ、ApoCⅢ水平及血浆脂蛋白脂肪酶(LPL)、肝脂肪酶(HL)活性和大鼠肝组织ApoB-100 mRNA的表达量.
结果: 治疗前, 脂肪肝组大鼠(包括脂肪肝模型组和脂肪肝实验组)与空白对照组大鼠比较, 肝脏组织学改变达到脂肪肝诊断标准, FPG、FINS明显升高(6.46 mmol/L±0.75 mmol/L, 6.61 mmol/L±0.45 mmol/L vs 5.48 mmol/L±0.47 mmol/L; 78.82 mU/L±11.13 mU/L, 78.48 mU/L±12.94 mU/L vs 40.90 mU/L±7.76 mU/L), IR也明显升高(22.48±2.81, 22.98±3.47 vs 9.85±1.15), 血浆ApoCⅡ水平降低、ApoCⅢ水平升高, LPL和HL酶活性均降低, 肝组织ApoB-100 mRNA的表达量降低. 马来酸罗格列酮干预治疗4 wk后, 与脂肪肝模型对照组比较, 脂肪肝实验组大鼠肝脏大体标本和组织学脂肪变性情况明显减轻, FPG, FINS降低(6.01 mmol/L±0.56 mmol/L vs 6.43 mmol/L±0.47 mmol/L, 68.11 mU/L±10.52 mU/L vs 82.48 mU/L±15.20 mU/L), IR降低(18.49±2.44 vs 23.39±3.16), 血浆ApoCⅡ水平升高, ApoCⅢ水平降低, LPL和HL酶活性均增加, 肝组织ApoB-100 mRNA的表达量上升.
结论: 高脂肪高胆固醇饮食可以成功造成SD大鼠有IR的NAFL模型. 通过改善脂肪肝大鼠的IR, 可以改变血浆ApoCⅡ、ApoCⅢ水平来提高LPL和HL的酶活性, 加速外周VLDL和TG的降解, 促使肝组织ApoB-100 mRNA的表达量上升, VLDL在肝脏合成加快, 从而加快内源性TG的转运, 减轻肝细胞脂肪浸润.
引文著录: 王炳芳, 田培营, 冯堃, 吴福荣, 陆永高, 杨英. 胰岛素抵抗在非酒精性脂肪肝发病中的作用. 世界华人消化杂志 2010; 18(30): 3175-3180
Revised: September 18, 2010
Accepted: September 27, 2010
Published online: October 28, 2010
AIM: To investigate the role of insulin resistance (IR) in the pathogenesis of nonalcoholic fatty liver disease in rats.
METHODS: Spraque-Dawley rats were randomly divided into normal control group and model group. The model group was fed a high-fat cholesterol-rich diet for 8 wk to induce nonalcoholic fatty liver disease and insulin resistance. The model group was further divided randomly into two equal subgroups: model control subgroup and therapeutic subgroup. Physiological saline and rosiglitazone maleate were given to the model control subgroup and therapeutic subgroup for 4 wk, respectively. Hepatic histological changes were then observed. Fasting plasma glucose, fasting insulin, plasma ApoC II and ApoC III were determined to calculate insulin resistance index. The activity of lipoprotein lipase and hepatic lipase was measured, and the expression of ApoB-100 mRNA was detected.
RESULTS: Compared with the normal control group, the body mass, fasting plasma glucose, fasting insulin and insulin resistance index were significantly higher in the model control subgroup and therapeutic subgroup (fasting plasma glucose: 6.46 mmol/L ± 0.75 mmol/L, 6.61 mmol/L ± 0.45 mmol/L vs 5.48 mmol/L ± 0.47 mmol/L; fasting insulin: 78.82 mU/L ± 11.13 mU/L, 78.48 mU/L ± 12.94 mU/L vs 40.90 mU/L ± 7.76 mU/L; insulin resistance index: 22.48 ± 2.81, 22.98 ± 3.47 vs 9.85 ± 1.15; all P < 0.05). Histological analysis revealed that the rats of the model control subgroup and therapeutic subgroup met the diagnostic criteria for fatty liver. Compared with the model control subgroup, hepatic histological changes were milder in the therapeutic subgroup. Treatment with rosiglitazone maleate significantly lowered the fasting plasma glucose (6.01 mmol/L ± 0.56 mmol/L vs 6.43 mmol/L ± 0.47 mmol/L), fasting insulin (68.11 mU/L ± 10.52 mU/L vs 82.48 mU/L ± 15.20 mU/L), insulin resistance index (18.49 ± 2.44 vs 23.39 ± 3.16) and plasma ApoC III level, but increased plasma ApoC II level and the activity of lipoprotein lipase.
CONCLUSION: Improvement of insulin resistance in fatty liver rats can improve the activity of lipoprotein lipase and hepatic lipase by altering plasma ApoC II and ApoC III levels, promote the degradation of peripheral very low-density lipoprotein and triglycerides, up-regulate hepatic expression of ApoB-100 mRNA, facilitate the synthesis of very low-density lipoprotein in the liver and the transport of endogenous triglycerides, and lessen fatty infiltration of the liver.
- Citation: Wang BF, Tian PY, Feng K, Wu FR, Lu YG, Yang Y. Role of insulin resistance in the pathogenesis of nonalcoholic fatty liver disease. Shijie Huaren Xiaohua Zazhi 2010; 18(30): 3175-3180
- URL: https://www.wjgnet.com/1009-3079/full/v18/i30/3175.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i30.3175
非酒精性脂肪肝(nonalcoholic fatty liver, NAFL)是一种代谢综合征性疾病, 脂质代谢紊乱, 致使三酰甘油(triglyceride, TG)在肝细胞内沉积, 其发病率逐年增高, 是目前研究的热点. 近年来, 胰岛素抵抗(insulin resistance, IR)在NAFL发病中的作用备受关注[1], 新近的研究表明[2], 在极低密度脂蛋白(very low density lipoprotein, VLDL)的分解转化过程中, 其关键酶脂蛋白脂肪酶(lipoprotein lipase, LPL)和肝脂肪酶(hepatic lipase, HL)的分泌受胰岛素的调控, 这两种酶的活化, 必须由载脂蛋白CⅡ(apolipoprotein C Ⅱ, Apo CⅡ)激活, 而ApoCⅢ则抑制其活化[3,4]. 据文献[5]报道, ApoCⅡ和ApoCⅢ的合成亦受胰岛素的调控, 并且ApoB-100与脂肪分解代谢间有重要关联[6]. 本研究以此为思路, 旨在探讨IR在NAFL大鼠模型中的作用机制.
健康清洁级SD大鼠, 24只, ♂, 体质量190-250 g, 由中国科学院上海实验动物中心提供. 许可证号: SCXX(沪)2002-0010. TRIzol: Invitrogen公司; PCR扩增试剂盒: Fermentas公司; 逆转录试剂盒: Fermentas公司; 引物: 上海生工生物工程公司; DNA Marker: 100 bp DNA Ladder, TaKaRa公司; DEPC: Sigma公司; 大鼠胰岛素检测ELISA试剂盒、大鼠ApoCⅡ检测ELISA试剂盒、大鼠ApoCⅢ检测ELISA试剂盒: 上海元象医疗器械有限公司. 罗氏便捷血糖仪: 德国罗氏乐康全活力型血糖仪; PCR反应仪: 德国Eppendorf公司; 凝胶电泳仪(水平): BIO-RAD公司; GENE®凝胶图像处理系统: 美国GENE公司.
1.2.1 分组与处理: 将24只健康SD大鼠进行标记编号并称质量, 随机分为正常对照组(N组)和脂肪肝模型组(M组). N组6只, 正常喂养. M组18只, 高脂肪高胆固醇饮食8 wk[7]. 进行8 wk的高脂肪高胆固醇喂养后, 对所有的大鼠进行肝页部分切除术, 肉眼及光镜下观察肝脏形态学改变. 实验过程中2只大鼠因肝页部分切除死亡, 死亡的2只大鼠均为M组大鼠. 实验结束时共存活大鼠22只, M组16只, N组6只, 将16只有IR的NAFL大鼠随机等分为2组, 每组8只, 分别称为脂肪肝模型对照组(D组)和脂肪肝实验组(S组), 仍予高脂肪高胆固醇饮食. 胰岛素增敏剂马来酸罗格列酮3 mg/(kg•d)[8]对S组大鼠每天定时进行灌胃干预治疗, D组每天与S组同时进行安慰剂(生理盐水)的灌胃干预治疗, 历时4 wk. N组不予处理.
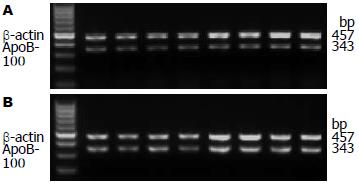
1.2.2 指标检测: (1)肝组织学检查: HE染色观察肝组织脂肪变性程度; (2)采用罗氏便捷血糖仪检测空腹血糖(fasting plasma glucose, FPG), ELISA法测定空腹血胰岛素(fasting insulin, FINS)水平, 利用HOMA-IR公式计算IR值, IR = FPG(mmol/L)×FINS(mIU/L)/22.5[7]; (3) ELISA法检测血浆ApoCⅡ、ApoCⅢ水平; (4)酶法检测血浆LPL、HL活性; (5)RT-PCR法检测大鼠肝组织ApoB-100 mRNA的表达量. 引物序列与PCR反应条件分别为: β-actin: 引物序列上游5'-TTC TTT GCA GCT CCT TCG TTG CCG-3', 下游5'-TGG ATG GCT ACG TAC ATG GCT GGG-3', 反应条件: 退火温度59 ℃, 共25个循环. 合成目的片断长度: 457 bp; ApoB: 引物序列上游5'-CAG TAG TAG TGG TGC GTC TT-3' , 下游5'-CCT GGA TTT GTC GGT CT-3', 反应条件: 退火温度56.2 ℃, 共25个循环. 合成目的片断长度为343 bp.
统计学处理 实验数据用mean±SD表示, 同一组大鼠不同时间之间比较用配对t检验; 不同组大鼠之间比较用独立样本t检验; 所有数据均在SPSS15.0统计软件进行分析处理, P<0.05被认为差异有统计学意义.
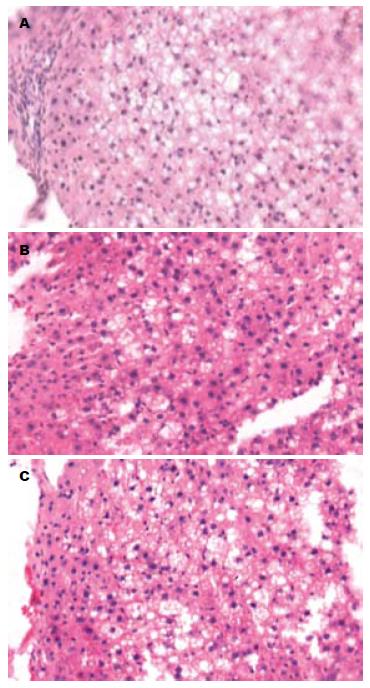
M组大鼠(高脂饮食8 wk后)肝脏HE染色显示: 肝小叶界限不清, 肝细胞索排列紊乱, 多数肝细胞出现严重的脂肪变性, 以小叶周边部最为严重, 肝细胞肿胀成圆形, 胞质内可见大小不一, 数量不等的脂滴空泡, 说明造模成功(图1A). S组大鼠在经过4 wk的罗格列酮干预治疗之后, 大鼠肝脏HE染色发生了一定的改变: 肝细胞脂肪变性有所减轻, 并且出现脂肪变性的细胞数量较治疗前减少(图1B). D组在经过4 wk的安慰剂(生理盐水)治疗之后未见明显变化, 仍存在较严重的脂肪变性(图1C).
在经过4 wk的干预治疗后, S组FPG、FINS和IR都较治疗前降低(P<0.01), D组FPG、FINS和IR较治疗前无明显变化(P>0.05). 说明胰岛素增敏剂马来酸罗格列酮可以通过降低NAFL大鼠的FPG和FINS来改善IR(表1).
造模成功后(干预治疗前), D组和S组的ApoCⅡ含量较N组降低(P<0.05), ApoCⅢ含量较N组升高(P<0.05), 在经过4 wk的干预治疗后, S组大鼠的ApoCⅡ含量较治疗前升高(P<0.05), ApoCⅢ含量较治疗前降低(P<0.05); 而D组的ApoCⅡ、ApoCⅢ含量较治疗前无明显变化(P>0.05). N组大鼠的ApoCⅡ和ApoCⅢ含量较8 wk时无明显变化(P>0.05, 表2).
造模8 wk后, D组和S组的LPL和HL的酶活性均较N组降低(P<0.01). 在经过4 wk的干预治疗后, S组大鼠的LPL和HL的酶活性较治疗前升高(P<0.05); D组大鼠的LPL、HL的酶活性与治疗前相比无明显变化(P>0.05). N组大鼠的LPL和HL酶活性在治疗前后无明显变化(P>0.05). 说明造模成功后D组和S组大鼠的LPL和HL的酶活性较N组大鼠降低, S组大鼠在经罗格列酮干预治疗后升高, D组大鼠在安慰剂治疗后无明显变化(表3).
高脂喂养大鼠8 wk后, D组和S组大鼠分别与N组大鼠比较目的基因ApoB-100与管家基因β-actin的RT-PCR产物灰度值比值, D组和S组大鼠的比值较N组明显降低(P<0.01). 在经过4 wk的干预治疗后, S组大鼠的RT-PCR产物灰度值比值较治疗前明显升高(P<0.01, 图2), D组大鼠的RT-PCR产物灰度值比值较治疗前无明显变化(P>0.05). N组大鼠的RT-PCR产物灰度值比值在治疗前后无明显变化(P>0.05, 表4).
近年来国内外进行了大量的动物实验和临床研究, 研究证明IR在脂肪肝的发生发展中起重要作用[9-11]. 肝脏摄取组织中游离脂肪酸后使之转变成TG, TG再与特异的载脂蛋白结合生成VLDL, VLDL分泌入血后在LPL和HL的作用下逐步水解, 在此过程中, ApoCⅡ是LPL和HL的激活剂, 在ApoCⅡ存在的情况下, LPL的活性可以提高10-50倍, 而ApoCⅢ则有抑制LPL的作用. TG被逐步水解后, ApoB-100及ApoE含量相对增加, 转变为中间密度脂蛋白, 被LPL及HL进一步水解, 最后仅剩下ApoB-100, 中间密度脂蛋白即转变为低密度脂蛋白, 低密度脂蛋白被肝细胞膜表面低密度脂蛋白受体摄取代谢, 形成VLDL. ApoB-100在VLDL的合成中起重要作用, ApoB-100为VLDL合成所必需[12], 如果ApoB-100合成减少, 就会减少VLDL的合成, 肝脏合成的内源性TG向肝外的转运减少, 导致TG在肝细胞中沉积. 且ApoB-100在肝细胞的脂质排泄过程中起限速作用, 因此, ApoB-100合成减少在NAFL的发生发展过程中可能也有重要作用[6,13]. IR状态下, 胰岛素抑制TG水解, 而脂肪组织过度分解释放大量游离脂肪酸被肝细胞摄取, 加速TG及VLDL合成[14], 同时减弱胰岛素刺激LPL的作用, 使LPL酶活性下降, TG分解减慢, 导致VLDL降解减少, 加重高TG血症. TG水平增加会加重IR, 产生恶性循环[14,15]. IR发生时肝细胞内出现氧应激反应, 由于TG在肝细胞内蓄积, 大量的游离脂肪酸在线粒体内氧化, 肝细胞对脂肪酸的高摄入导致肝细胞线粒体氧化超载, 反过来影响游离脂肪酸代谢, 进一步加重肝脏的脂质蓄积, 造成肝细胞内脂肪堆积及肝细胞变性、肿大, 形成脂肪肝[16,17].
我们的研究是健康SD大鼠在经过8 wk的高脂饮食喂养后, 从肝脏病理切片发现不同程度的肝细胞脂肪浸润, 达到了脂肪肝的组织学诊断标准[8]; 通过对大鼠FPG和FINS的测定, 根据HOMA-IR公式, 发现脂肪肝大鼠的FPG、FINS、IR都明显高于N组, 说明脂肪肝大鼠发生了明显的IR, 同时都存在高胰岛素血症和血糖升高. 从VLDL的代谢途径入手, 分别检测血浆ApoCⅡ和ApoCⅢ, 血浆中LPL和HL的酶活性, 以及肝组织中ApoB-100 mRNA的表达量, 结果显示, 脂肪肝大鼠血浆中LPL和HL的酶活性较正常大鼠降低, 导致VLDL在外周降解减少, 同时, 脂肪肝大鼠血浆ApoCⅡ含量降低, ApoCⅢ含量升高, 可以认为ApoCⅡ含量降低和ApoCⅢ含量升高会使大鼠的LPL和HL的酶活性降低; 而且脂肪肝大鼠肝组织的ApoB-100 mRNA表达量较正常大鼠明显降低. 这说明发生了胰岛素抵抗的脂肪肝大鼠由于外周LPL和HL的酶活性下降, 以致VLDL的外周降解减少, 反馈性抑制了VLDL在大鼠肝组织中的合成, 进而抑制了ApoB-100 mRNA在肝组织中的表达, 使ApoB-100在肝脏的合成减少, 抑制了运输内源性TG的VLDL的合成, 造成内源性TG运输受阻, 加重TG在肝脏的沉积. 我们通过酶法检测大鼠血浆LPL的活性变化发现, 脂肪肝组大鼠的LPL活性较空白对照组下降. 脂肪肝组大鼠LPL活性下降, 会减少血液中VLDL的降解, 加重大鼠的高TG血症, 促进大鼠脂肪肝的形成.
罗格列酮为噻唑烷二酮类胰岛素增敏药, 可通过提高胰岛素的敏感性而有效的控制血糖, 其机制包括可以改善IR[18-20]. 在我们的研究中, 采用安慰剂(生理盐水)作为对照的方法, 发现进行过8 wk高脂饮食饲养的S组大鼠在经过4 wk、3 mg/(kg•d)的马来酸罗格列酮(文迪雅)干预治疗后, FPG、FINS和IR较脂肪肝对照组明显减低; 血浆ApoCⅡ含量较脂肪肝对照组降低, 血浆ApoCⅢ含量较脂肪肝对照组升高; 血浆LPL和HL的酶活性较脂肪肝对照组降低; 肝组织ApoB-100 mRNA表达量也较脂肪肝对照组明显升高. N组各指标较治疗前(饲养8 wk时)无明显变化. 说明马来酸罗格列酮能明显减轻脂肪肝实验组大鼠的FPG、FINS, 改善脂肪肝大鼠的IR, 并且能通过提高血浆ApoCⅡ水平和降低血浆ApoCⅢ水平来提高LPL和HL的酶活性, 增加外周VLDL的降解, 增加肝组织ApoB-100 mRNA的表达, 减轻肝细胞内TG沉积和肝细胞脂肪浸润, 改善肝细胞脂肪变性, 对脂肪肝起到一定的治疗作用.
NAFL人群发病率约为5%左右, 将成为21世纪最常见的疾病之一[21-24]. 通过本研究结果, 我们可以尝试将针对胰岛素增敏治疗, 调控ApoCⅡ、ApoCⅢ的表达等治疗手段作为治疗脂肪肝的方法, 将对脂肪肝的临床治疗研究起到一定的启示作用.
脂肪肝的主要发病机制是脂质代谢紊乱, 极低密度脂蛋白(VLDL)的分解代谢较为关键. VLDL在分解转化过程中, 其关键酶脂蛋白脂肪酶(LPL)和肝脂肪酶(HL)的分泌受胰岛素的调控, 这两种酶的活化, 必须由ApoCⅡ激活, 而ApoCⅢ则抑制其活化.
范建高, 教授, 上海交通大学医学院附属新华医院消化内科
非酒精性脂肪肝(NAFL)是一种代谢综合征性疾病, 脂质代谢紊乱, 致使三酰甘油(TG)在肝细胞内沉积, 其发病率逐年增高, 是目前研究的热点. 近年来, 胰岛素抵抗(IR)在NAFL发病中的作用备受关注.
Cho等报道极低密度脂蛋白(VLDL)的分解转化过程中, 其关键酶脂蛋白脂肪酶(LPL)和肝脂肪酶(HL)的分泌受胰岛素的调控, 这两种酶的活化, 必须由载脂蛋白CⅡ(ApoCⅡ)激活, 而载脂蛋白CⅢ(ApoCⅢ)则抑制其活化, ApoCⅡ和ApoCⅢ的合成亦受胰岛素的调控.
本实验应用高脂饮食喂养法制造具有胰岛素抵抗的脂肪肝大鼠模型, 并检测胰岛素增敏药罗格列酮干预前后, 大鼠模型组及对照组血浆ApoCⅡ、ApoCⅢ含量和LPL及HL的含量和活性, 并分析其与Apo B-100 mRNA在肝细胞表达的关系, 研究胰岛素抵抗在非酒精性脂肪肝发病中的作用.
采用针对胰岛素增敏治疗、调控ApoCⅡ、ApoCⅢ的表达等, 可作为治疗脂肪肝的手段之一, 对脂肪肝的临床治疗研究起到较大的作用, 将产生较好的社会效益和经济效益.
本文选题新颖, 设计合理, 数据详实, 结论可靠, 可读性好.
编辑: 李军亮 电编:何基才
| 1. | Raszeja-Wyszomirska J, Lawniczak M, Marlicz W, Miezyńska-Kurtycz J, Milkiewicz P. [Non-alcoholic fatty liver disease--new view]. Pol Merkur Lekarski. 2008;24:568-571. [PubMed] |
| 2. | Cho YS, Go MJ, Han HR, Cha SH, Kim HT, Min H, Shin HD, Park C, Han BG, Cho NH. Association of lipoprotein lipase (LPL) single nucleotide polymorphisms with type 2 diabetes mellitus. Exp Mol Med. 2008;40:523-532. [PubMed] [DOI] |
| 3. | Pulawa LK, Jensen DR, Coates A, Eckel RH. Reduction of plasma triglycerides in apolipoprotein C-II transgenic mice overexpressing lipoprotein lipase in muscle. J Lipid Res. 2007;48:145-151. [PubMed] [DOI] |
| 4. | Nicolay A, Lombard E, Arlotto E, Saunier V, Lorec-Penet AM, Lairon D, Portugal H. Evaluation of new apolipoprotein C-II and apolipoprotein C-III automatized immunoturbidimetric kits. Clin Biochem. 2006;39:935-941. [PubMed] [DOI] |
| 5. | Blackett PR, Blevins KS, Quintana E, Stoddart M, Wang W, Alaupovic P, Lee ET. ApoC-III bound to apoB-containing lipoproteins increase with insulin resistance in Cherokee Indian youth. Metabolism. 2005;54:180-187. [PubMed] [DOI] |
| 6. | Skogsberg J, Dicker A, Rydén M, Aström G, Nilsson R, Bhuiyan H, Vitols S, Mairal A, Langin D, Alberts P. ApoB100-LDL acts as a metabolic signal from liver to peripheral fat causing inhibition of lipolysis in adipocytes. PLoS One. 2008;3:e3771. [PubMed] [DOI] |
| 7. | Feng WQ, Zeng ZH, Zhuo LS. [Influence of electroacupuncture on insulin-resistance in nonalcoholic fatty liver rats]. Zhenci Yanjiu. 2008;33:111-115. [PubMed] |
| 8. | Varanasi KK, Potharaju S, Rajak S, Veeraraghavan S, Mallick P, Vakkalanka SK. Effect of pentoxifylline on the pharmacokinetics of rosiglitazone in Wistar rats. Methods Find Exp Clin Pharmacol. 2008;30:537-542. [PubMed] [DOI] |
| 9. | Zhou WD, Yang YL, Che ZH. [Non-alcoholic fatty liver, high sensitivity C reactive protein and insulin resistance]. Zhongnan Daxue Xuebao Yixueban. 2008;33:565-570. [PubMed] |
| 10. | Sakurai M, Takamura T, Ota T, Ando H, Akahori H, Kaji K, Sasaki M, Nakanuma Y, Miura K, Kaneko S. Liver steatosis, but not fibrosis, is associated with insulin resistance in nonalcoholic fatty liver disease. J Gastroenterol. 2007;42:312-317. [PubMed] [DOI] |
| 11. | Park SH, Kim BI, Kim SH, Kim HJ, Park DI, Cho YK, Sung IK, Sohn CI, Kim H, Keum DK. Body fat distribution and insulin resistance: beyond obesity in nonalcoholic fatty liver disease among overweight men. J Am Coll Nutr. 2007;26:321-326. [PubMed] |
| 12. | Chen Z, Newberry EP, Norris JY, Xie Y, Luo J, Kennedy SM, Davidson NO. ApoB100 is required for increased VLDL-triglyceride secretion by microsomal triglyceride transfer protein in ob/ob mice. J Lipid Res. 2008;49:2013-2022. [PubMed] [DOI] |
| 13. | Li G, Schonfeld G. [The molecular mechanisms of apolipoprotein B mediating the atherogenic lipoprotein metabolism]. Zhonghua Xinxueguanbing Zazhi. 2006;34:571-573. [PubMed] |
| 14. | Duez H, Lamarche B, Valéro R, Pavlic M, Proctor S, Xiao C, Szeto L, Patterson BW, Lewis GF. Both intestinal and hepatic lipoprotein production are stimulated by an acute elevation of plasma free fatty acids in humans. Circulation. 2008;117:2369-2376. [PubMed] [DOI] |
| 15. | Yan HM, Gao X, Liu M, Gu Q, Zhang B, Li X. [Relationship of liver fat content to insulin resistance and metabolic syndrome]. Zhonghua Yixue Zazhi. 2008;88:1255-1258. [PubMed] |
| 16. | Guidorizzi de Siqueira AC, Cotrim HP, Rocha R, Carvalho FM, de Freitas LA, Barreto D, Gouveia L, Landeiro L. Non-alcoholic fatty liver disease and insulin resistance: importance of risk factors and histological spectrum. Eur J Gastroenterol Hepatol. 2005;17:837-841. [PubMed] [DOI] |
| 17. | Videla LA, Rodrigo R, Araya J, Poniachik J. Insulin resistance and oxidative stress interdependency in non-alcoholic fatty liver disease. Trends Mol Med. 2006;12:555-558. [PubMed] [DOI] |
| 18. | Fracanzani AL, Valenti L, Bugianesi E, Andreoletti M, Colli A, Vanni E, Bertelli C, Fatta E, Bignamini D, Marchesini G. Risk of severe liver disease in nonalcoholic fatty liver disease with normal aminotransferase levels: a role for insulin resistance and diabetes. Hepatology. 2008;48:792-798. [PubMed] [DOI] |
| 19. | Xu P, Zhang XG, Li YM, Yu CH, Xu L, Xu GY. Research on the protection effect of pioglitazone for non-alcoholic fatty liver disease (NAFLD) in rats. J Zhejiang Univ Sci B. 2006;7:627-633. [PubMed] [DOI] |
| 20. | Yang WY. [Insulin resistance as an early marker of non-alcoholic fatty liver]. Zhonghua Neike Zazhi. 2007;46:177-178. [PubMed] |
| 21. | Qin S, Li L, Yang GY, Li RZ, Li K, Qi XY, Li SB, Chen WW, Liu H, Tang Y. [Effects of visfatin gene overexpression on insulin sensitivity in the insulin-resistant rats induced by high-fat diet]. Zhonghua Yixue Zazhi. 2008;88:365-368. [PubMed] |
| 22. | Csont T, Bereczki E, Bencsik P, Fodor G, Görbe A, Zvara A, Csonka C, Puskás LG, Sántha M, Ferdinandy P. Hypercholesterolemia increases myocardial oxidative and nitrosative stress thereby leading to cardiac dysfunction in apoB-100 transgenic mice. Cardiovasc Res. 2007;76:100-109. [PubMed] [DOI] |
| 23. | Millar JS, Brousseau ME, Diffenderfer MR, Barrett PH, Welty FK, Faruqi A, Wolfe ML, Nartsupha C, Digenio AG, Mancuso JP. Effects of the cholesteryl ester transfer protein inhibitor torcetrapib on apolipoprotein B100 metabolism in humans. Arterioscler Thromb Vasc Biol. 2006;26:1350-1356. [PubMed] [DOI] |
| 24. | Griffin MD, Mok ML, Wilson LM, Pham CL, Waddington LJ, Perugini MA, Howlett GJ. Phospholipid interaction induces molecular-level polymorphism in apolipoprotein C-II amyloid fibrils via alternative assembly pathways. J Mol Biol. 2008;375:240-256. [PubMed] [DOI] |