修回日期: 2009-12-28
接受日期: 2009-12-29
在线出版日期: 2010-01-28
目的: 评价Caco-2细胞对酯类药物的水解活性及羧酸酯酶(CES)表达的影响.
方法: 采用人类CES1(hCE-1)和CES2(hCE-2)特异性底物咪达普利和伊立替康(CPT-11)与Caco-2细胞S9组分共同孵育, HPLC法测定原药及代谢产物浓度, 评价Caco-2细胞的药物水解活性, 并通过RT-PCR法测定细胞内hCE-1和hCE-2表达.
结果: Caco-2细胞与正常小肠微粒体酶相比, 更倾向于代谢咪达普利, 而几乎不水解CPT-11. RT-PCR结果发现, Caco-2细胞CES表达与正常肠道上皮组织不同, 表现为hCE-1高表达, 而几乎不表达hCE-2.
结论: Caco-2细胞CES表达与正常肠道上皮组织存在较大差异, 因此在使用Caco-2细胞评价酯类药物口服吸收时应十分谨慎.
引文著录: 刘东, 张程亮, 杨燕, 向道春, 高静, 王新桃. 人结肠癌Caco-2细胞羧酸酯酶的表达及代谢活性. 世界华人消化杂志 2010; 18(3): 294-297
Revised: December 28, 2009
Accepted: December 29, 2009
Published online: January 28, 2010
AIM: To investigate the expression of carboxylesterases (CEs) in human colorectal carcinoma Caco-2 cells and evaluate their catalytic activity for hydrolysis of ester-containing drugs.
METHODS: The hydrolytic capacity of Caco-2 cells were evaluated using two substrates, imidapril and irinotecan (CPT-11), the specific substrates of human CE-1 and human CE-2, respectively. After co-incubation of the two substrates with Caco-2 cell 9 000 g supernatant (S9 fraction), the two drugs and their metabolic products were assayed by high-performance liquid chromatography (HPLC). Furthermore, the major CE isoforms expressed in Caco-2 cells were detected by reverse transcription-polymerase chain reaction (RT-PCR).
RESULTS: Compared with the human small intestinal microsomes, Caco-2 cells tend to hydrolyze imidapril instead of CPT-11. RT-PCR results indicated that hCE-1 was highly expressed in Caco-2 cells. In contrast, the expression of hCE-2 mRNA was hardly detected in Caco-2 cells.
CONCLUSION: The expression pattern of CEs in Caco-2 cells is completely different from that in human small intestine and colon. Therefore, caution should be exercised in predicting human intestinal absorption of ester-containing drugs based on transport results obtained using Caco-2 cells.
- Citation: Liu D, Zhang CL, Yang Y, Xiang DC, Gao J, Wang XT. Expression and metabolic activity of carboxylesterases in human colorectal carcinoma Caco-2 cells. Shijie Huaren Xiaohua Zazhi 2010; 18(3): 294-297
- URL: https://www.wjgnet.com/1009-3079/full/v18/i3/294.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i3.294
近年来研究发现[1]由于肠道上皮表达众多代谢酶, 部分口服药物在胃肠道上皮吸收过程中可被代谢, 从而影响其体内过程. 目前, 有关肠道上皮细胞色素P450酶系对于药物吸收影响的研究报道较多, 主要为小肠黏膜上皮中CYP3A4的表达减少了部分药物的吸收[2]. 同样, 肠道上皮羧酸酯酶(carboxylesterase, CES)的表达对部分酯类药物吸收的影响不可忽视[3]. 由于CES存在不同的亚型(主要为CES1和CES2), 而各种亚型在体内组织分布及活性表达各异, 且代谢底物特征存在较大差别, 因此对于CES组织分布和药物代谢能力的研究可为药物设计和开发提供有效依据. Van Gelder等对酯类前药在不同部位肠段吸收过程中的代谢特征做了初步的研究[4]. 但是, 在新药开发过程中, Caco-2细胞更多地用于新药的口服吸收评价. 由于该细胞结构和生理生化功能类似于人体小肠上皮细胞, 因此已经成为药物吸收研究的快速筛选工具并被广泛应用[5]. 尽管CES2在人体肠道上皮有表达, 但Caco-2细胞中CES的表达类型及药物代谢活性尚未明确[6]. 基于此, 本研究体外培养Caco-2细胞, 分别采用hCE-1(人类CES1家族同工酶, CES1A1)、hCE-2(人类CES2家族同工酶, CES2A1, hiCE)的特异性底物咪达普利(Imidapril)和伊立替康(CPT-11)来评价Caco-2细胞的药物代谢活性, 并通过RT-PCR法测定细胞内hCE-1和hCE-2表达, 以期为进一步认识Caco-2细胞的生理功能提供实验依据.
Caco-2细胞购自武汉大学细胞库; CPT-11及代谢产物SN-38、咪达普利及代谢产物咪达普利拉(imidaprilat)购自Toronto Research Chemicals公司(加拿大); 人类小肠微粒体酶购自BD Gentest公司(美国); 人类小肠和结肠总RNA(批号分别为2071337和2090016)购自BD Biosciences Clontech公司(美国); 低温高速离心机, HERMLE公司(德国); XDS-1B倒置显微镜, 重庆光电仪器有限公司; CO2恒温培养箱, Napco公司(法国); DTC基因扩增热循环仪(西安天隆科技有限公司); JS-380A自动凝胶图像分析仪(上海培清科技有限公司); 高效液相色谱仪, Waters公司(美国); 色谱柱(大连依利特, 200 mm×4.6 mm).
1.2.1 Caco-2细胞培养: Caco-2细胞生长在含100 mL/L胎牛血清(FBS), 100 kU/L青霉素和100 mg/L链霉素的高糖DMEM培养液中, 37 ℃, 50 mL/L CO2培养箱中培养, 隔日换液, 长至瓶底80%时用含0.2 g/L EDTA+2.5 g/L胰酶消化细胞, 按1:2传代. 取对数生长期细胞进行实验.
1.2.2 CES酶代谢特征研究: 刮取培养7 d的Caco-2细胞, 重悬于冰冷的PBS缓冲液中, 超声裂解, 匀浆后于4 ℃下9 000 g离心20 min, 得上层液体为S9组分, 采用BCA试剂测定蛋白浓度. Caco-2细胞S9组分和人小肠微粒体酶使用50 mmol/L的HEPES缓冲液稀释, 蛋白终浓度为30 mg/L, 37 ℃预热5 min. 分别加入终浓度为12 mg/L的CPT-11和5 mg/L的咪达普利, 37 ℃恒温水浴孵育, 同时加入NADPH 1 mg启动反应, 在不同时间点从体系中取样200 μL, 加入200 μL冰冷乙腈中止反应. 样品按参考文献方法[7,8]经高效液相色谱(HPLC)检测原药和代谢产物浓度.
1.2.3 RT-PCR方法检测CES表达: Caco-2细胞采用TRIzol一步法提取总RNA. RNA浓度和纯度使用分光光度法测定. 1 mg的总RNA采用5 pmol的Oligo(dT) primer, 2 mmol的dNTP以及RNA酶H进行1 wk的逆转录反应, 42 ℃, 1 h. 随后进行RT-PCR. hCE-1的正向引物: 5'-TCCCCTTGTTTGCATTGCTA; 反向引物: 5'-AAAGAGGTTGGTCCAGAAAG; PCR条件为: 95 ℃, 15 s, 54 ℃, 30 s, 72 ℃, 45 s, 共25个循环. hCE-2的正向引物: 5'-AGCCTGTCCCTAGCATTGTT; 反向引物5'-GCCCCCAAAGAAACTTCTGA; PCR条件为: 95 ℃, 15 s, 56 ℃, 30 s, 72 ℃, 45 s, 共25个循环. 扩增产物经琼脂糖凝胶电泳分离, EB染色, 拍照并分析结果.
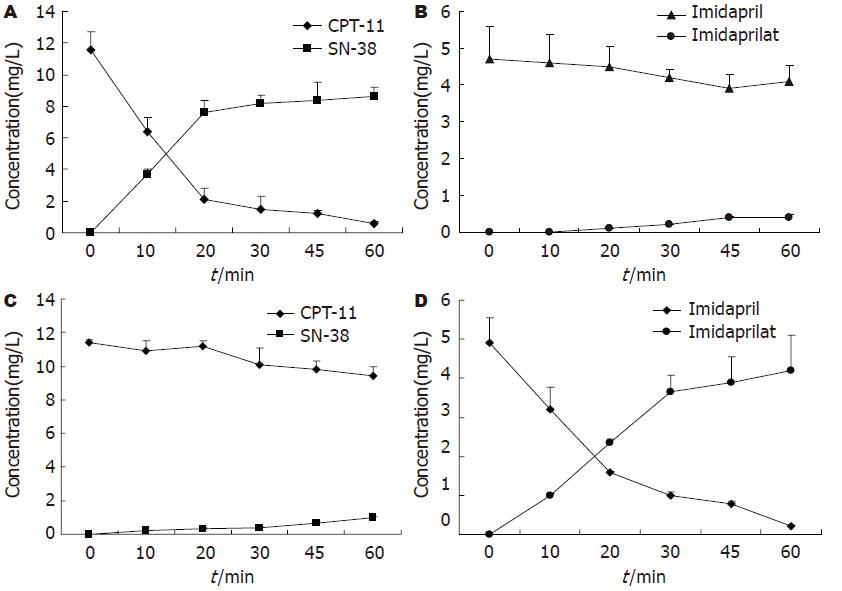
CPT-11在正常小肠微粒体中迅速代谢为SN-38, 咪达普利在该微粒体酶体系中基本以原药形式存在. 而在Caco-2细胞S9组分中, CPT-11代谢甚微, 咪达普利则快速代谢为咪达普利拉(图1). 这说明两种体系对酯类药物的代谢特征存在差异.
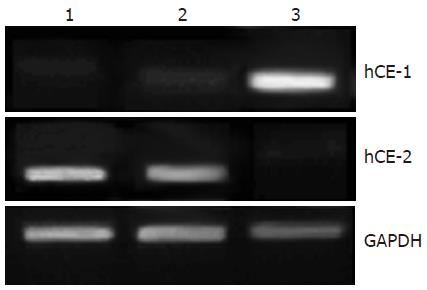
hCE-1 mRNA水平在Caco-2细胞中有较强表达, 在小肠和结肠组织中几乎不可测得. 而Caco-2细胞却很少表达正常小肠和结肠组织中的hCE-2(图2). 可见Caco-2细胞的CES酶表达与正常肠道上皮组织存在较大差异.
Caco-2细胞是人结肠癌上皮细胞系(human colon carcinoma cell line: Caco-2), 自上个世纪80年代起就广泛用于药物的吸收、分配、代谢以及毒性研究. Caco-2细胞模型作为药物吸收研究的一种快速筛选工具, 可在细胞水平上提供药物分子透过小肠黏膜的吸收、代谢、转运以及毒性的综合信息, 为药物研究提供依据.
由于药物经过Caco-2单细胞层的渗透特征与人类小肠黏膜上皮细胞相似, 因此目前Caco-2细胞已经被广泛用于药物口服吸收的筛选研究[9]. 尽管拥有以上的优势, 但是Caco-2细胞在黏蛋白和代谢酶表达方面仍然与正常小肠上皮细胞存在一定的差异. 随着近年来对Caco-2研究的深入, 发现虽然该细胞表达一定量的代谢酶, 但在模拟体内小肠吸收代谢方面尚存在很多局限性, 例如Caco-2细胞未能表达与体内相应量的CYP3A4[10]. 而在评价酯类药物中, 肠道CES对此类药物的代谢发挥着重要的作用. 因此对Caco-2细胞生理特征的进一步探究可为酯类药物筛选提供必要的理论基础.
CES为机体中一类非常重要的水解酶, 在水解许多内源性化合物和外源性化学物质过程中发挥着关键作用. 哺乳动物CES组成一个多基因家族, 其基因产物定位于多种组织的内质网中. CES同工酶可分为5个亚族[11], 其中CES1和CES2为水解外源性化合物的主要酶. CES1和CES2在组织分布、免疫学特征和基因调节方面存在差异. 例如, 人类hCE-1, 广泛分布于体内多种组织, 但是在小肠中几乎不可测得; hCE-2, 则分布于小肠、肝脏和肾脏[12]. 此外, 两者尽管拥有40%-50%的氨基酸同源序列, 底物间却存在明显的差异. hCE-1倾向于水解酰基端较大而羟基端较小的酯类化合物, 例如替莫普利、咪达普利、哌甲酯和可卡因甲酯等药物. 相反, hCE-2则易于水解一些拥有小酰基端和大羟基端的药物, 例如CPT-11、戊酸倍他米松和可卡因苯甲酰酯等[13].
S9是一种含有多种代谢酶的混合酶系. 为评价Caco-2细胞CES的代谢特征, 本研究采用hCE-1和hCE-2特异性底物咪达普利和伊立替康(CPT-11)与Caco-2细胞S9组分共同孵育, HPLC法测定原药和代谢产物浓度. 同时使用人小肠微粒体酶作为对照, 观测Caco-2细胞与正常小肠上皮细胞CES表达特征是否有差异. 结果显示, 正常人类小肠微粒体酶仅对hCE-2底物CPT-11存在水解活性. Caco-2细胞对于hCE-1底物咪达普利的水解活性较强, 却对CPT-11代谢甚微. 因此, 本研究进一步采用RT-PCR法测定Caco-2细胞中CES表达特征. 我们发现, 正常人类小肠和结肠表达hCE-2, 几乎不表达hCE-1, 这与文献报道结果一致[13]. 然而, Caco-2细胞表达特征正好与正常肠道上皮组织相反, 含有较高量的hCE-1, 却很少表达hCE-2.
Marsh等报道了正常人与肿瘤患者之间CES基因单核苷酸多态(SNP)现象, 认为CES2基因内SNP(IVSlO-88)与肿瘤部位CES2的mRNA表达减少有关[14]. 但是, 本研究发现结肠癌Caco-2细胞中不仅CES2表达下降, CES1还异常高表达, 其原因尚不清楚.
根据本研究结果, 作为hCE-1底物的部分酯类前药, 在使用Caco-2细胞评价口服吸收时则容易被代谢, 尽管此类药物在正常人类小肠中很少被代谢. 这一结论或可为Vimon Tantishaiyakul等的研究结果提供解释, 在他们的研究中, 采用Caco-2细胞评价了甲芬那酸愈创木酚酯的口服吸收, 却发现该药在Caco-2细胞和肝脏微粒体中存在代谢[15]. 甲芬那酸愈创木酚酯酰基端较大, 羟基端较小, 是hCE-1的良好代谢底物.
因为人类hCE-1和hCE-2底物的差异性, 而根据本研究结论, Caco-2细胞内CES酶表达不同于正常人小肠上皮细胞, 所以在使用Caco-2细胞模型考察酯类前药口服吸收中所得到的结果应谨慎分析, 并结合体内药物吸收代谢的数据综合评价.
Caco-2细胞在新药的口服吸收评价中被广泛应用, 但是该细胞仍然存在较多局限性. 对于Caco-2细胞中羧酸酯酶(CES)的表达类型和活性尚不明确.
黄园, 教授, 四川大学华西药学院药剂系.
Tantishaiyakul等采用Caco-2细胞评价了甲芬那酸愈创木酚酯的口服吸收, 却发现作为hCE-1底物的该药在Caco-2细胞存在代谢. 但是在正常人肠道组织中只表达hCE-2, 几乎检测不到hCE-1.
本研究提示, Caco-2细胞内CES酶表达与正常人小肠上皮细胞存在较大差异, 因此在评价酯类药物口服吸收中选择Caco-2细胞模型作为实验工具时应十分谨慎.
本文对人结肠癌Caco-2细胞羧酸酯酶表达及代谢活性进行了研究, 有一定创新性和参考价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Galetin A, Gertz M, Houston JB. Potential role of intestinal first-pass metabolism in the prediction of drug-drug interactions. Expert Opin Drug Metab Toxicol. 2008;4:909-922. [PubMed] [DOI] |
| 2. | Mouly S, Meune C, Bergmann JF. Mini-series: I. Basic science. Uncertainty and inaccuracy of predicting CYP-mediated in vivo drug interactions in the ICU from in vitro models: focus on CYP3A4. Intensive Care Med. 2009;35:417-429. [PubMed] [DOI] |
| 3. | Imai T. Human carboxylesterase isozymes: catalytic properties and rational drug design. Drug Metab Pharmacokinet. 2006;21:173-185. [PubMed] [DOI] |
| 4. | Van Gelder J, Shafiee M, De Clercq E, Penninckx F, Van den Mooter G, Kinget R, Augustijns P. Species-dependent and site-specific intestinal metabolism of ester prodrugs. Int J Pharm. 2000;205:93-100. [PubMed] [DOI] |
| 5. | Frontela C, Scarino ML, Ferruzza S, Ros G, Martínez C. Effect of dephytinization on bioavailability of iron, calcium and zinc from infant cereals assessed in the Caco-2 cell model. World J Gastroenterol. 2009;15:1977-1984. [PubMed] [DOI] |
| 6. | Masaki K, Hashimoto M, Imai T. Intestinal first-pass metabolism via carboxylesterase in rat jejunum and ileum. Drug Metab Dispos. 2007;35:1089-1095. [PubMed] [DOI] |
| 7. | Hyatt JL, Tsurkan L, Wierdl M, Edwards CC, Danks MK, Potter PM. Intracellular inhibition of carboxylesterases by benzil: modulation of CPT-11 cytotoxicity. Mol Cancer Ther. 2006;5:2281-2288. [PubMed] [DOI] |
| 8. | Yamanaka K, Morikawa S, Murata K, Banno K, Sato T, Takai T, Suzuki T, Mizobe M, Ito M, Ishibashi K. Radioimmunoassay for imidapril, a new angiotensin-converting enzyme inhibitor, and imidaprilat, its active metabolite, in human plasma and urine. J Pharm Biomed Anal. 1996;14:281-287. [PubMed] [DOI] |
| 10. | Balimane PV, Chong S. Cell culture-based models for intestinal permeability: a critique. Drug Discov Today. 2005;10:335-343. [PubMed] [DOI] |
| 11. | Satoh T, Hosokawa M. Structure, function and regulation of carboxylesterases. Chem Biol Interact. 2006;162:195-211. [PubMed] [DOI] |
| 12. | Imai T, Taketani M, Shii M, Hosokawa M, Chiba K. Substrate specificity of carboxylesterase isozymes and their contribution to hydrolase activity in human liver and small intestine. Drug Metab Dispos. 2006;34:1734-1741. [PubMed] [DOI] |
| 13. | Taketani M, Shii M, Ohura K, Ninomiya S, Imai T. Carboxylesterase in the liver and small intestine of experimental animals and human. Life Sci. 2007;81:924-932. [PubMed] [DOI] |