修回日期: 2009-12-13
接受日期: 2009-12-21
在线出版日期: 2010-01-28
目的: 探讨7种不同胆汁酸对AR42J胰腺腺泡细胞的损伤作用, 检测在各种胆汁酸作用下胰腺腺泡细胞的存活率和凋亡/坏死的改变.
方法: 以大鼠AR42J胰腺腺泡细胞系为研究对象, 应用MTT法检测7种不同胆汁酸对细胞存活率的影响和剂量与时间依赖性, 采用光学显微镜和荧光显微镜观察细胞形态学改变与凋亡/坏死的变化, 流式细胞术AV/PI双染法检测细胞的凋亡/坏死率.
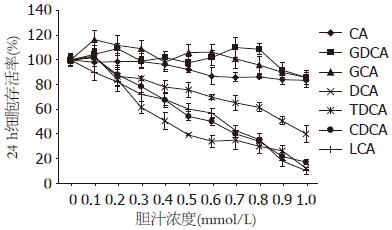
结果: CA, GCA和GDCA在0.1-1.0 mmol/L内对AR42J细胞不具有损伤作用; 而DCA, CDCA和LCA分别从0.3 mmol/L开始, TDCA从0.4 mmol/L开始, 呈剂量依赖性对AR42J细胞产生损伤作用. 0.8 mmol/L CA组细胞凋亡率与坏死率同CON组无明显区别(1.2% vs 0.9%; 1.0% vs 1.0%, 均P>0.05); 0.4 mmol/L DCA组细胞凋亡率和坏死率分别为45.2%和8.9%; 0.8 mmol/L DCA组细胞凋亡率和坏死率分别为18.6%和45.4%.
结论: 7种胆汁酸对AR42J细胞的损伤作用不同, 主要表现为凋亡或/和坏死, 同剂量相关.
引文著录: 张桂信, 陈海龙, 纪军, 张利, 吴圆圆, 王永鹏, 尚东. 不同胆汁酸诱导AR42J细胞凋亡与坏死的作用. 世界华人消化杂志 2010; 18(3): 284-289
Revised: December 13, 2009
Accepted: December 21, 2009
Published online: January 28, 2010
AIM: To investigate the cytotoxic effects of seven different bile acids on pancreatic acinar AR42J cells by detecting the survival, necrosis and apoptosis of AR42J cells incubated with different bile acids.
METHODS: The effects of different bile acids on the survival of rat AR42J cells were detected by methyl thiazolyl tetrazolium (MTT) assay. Cell morphological changes were observed by microscopy and fluorescence microscopy. Cell apoptosis and necrosis were determined by annexin-V and propidium iodide double staining and flow cytometry.
RESULTS: Cholic acid (CA), glycocholic acid (GCA), and glycodeoxycholic acid (GDCA) at doses ranging from 0.1 to 1.0 mmol/L had no cytotoxic effects on AR42J cells. Deoxycholic acid (DCA), chenodeoxycholic acid (CDCA) and lithocholic acid (LCA) at doses ≥ 0.3 mmol/L, and taurodeoxycholic acid (TDCA) at doses ≥ 0.4 mmol/L induced cytotoxic effects on AR42J cells in a dose-dependent manner. No significant differences were noted in the apoptotic rate and necrotic rate between untreated AR42J cells and those treated with 0.8 mmol/L of CA (apoptotic rate: 1.2% vs 0.9%; necrotic rate: 1.0% vs 1.0%). The apoptotic rate and necrotic rate of AR42J cells treated with 0.4 mmol/L of DCA were 45.2% and 8.9%, respectively, while those treated with 0.8 mmol/L of DCA were 18.6% and 45.4%, respectively.
CONCLUSION: Different bile acids exert different cytotoxic effects on AR42J cells. Some bile acids induce the apoptosis and/or necrosis of AR42J cells in a dose-dependent manner.
- Citation: Zhang GX, Chen HL, Ji J, Zhang L, Wu YY, Wang YP, Shang D. Cytotoxic effects of different bile acids on pancreatic acinar AR42J cells. Shijie Huaren Xiaohua Zazhi 2010; 18(3): 284-289
- URL: https://www.wjgnet.com/1009-3079/full/v18/i3/284.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i3.284
急性胆源性胰腺炎(acute biliary pancreatitis, ABP)在我国发病率较高, 占急性胰腺炎(acute pancreatitis, AP)总数的50%-80%[1]. 目前普遍认为, ABP是由于胆管炎症等病理因素使胆管内压力升高, 胆汁通过共同通道反流入胰管, 激活胰酶原, 导致胰腺自身消化而引起胰腺炎, 但其确切的发病机制尚未完全明确[2-4]. 人们在20世纪中期便利用胆胰管逆行性注射胆汁酸而成功复制了AP动物模型, 该模型同AP的临床发病特点和病理性改变均符合, 成为研究AP发病机制和治疗的常用动物模型之一[5]. 正常人胆汁中的胆汁酸(bile acid)按结构可分为两大类: 一类为游离型胆汁酸, 包括胆酸(cholic acid, CA)、脱氧胆酸(deoxycholic acid, DCA)、鹅脱氧胆酸(chenodeoxy cholic acid, CDCA)和少量的石胆酸(litho chalic acid, LCA). 另一类是上述游离胆汁酸与甘氨酸或牛磺酸结合的产物、称结合型胆汁酸. 主要包括甘氨胆酸(glycocholic acid, GCA)、甘氨鹅脱氧胆酸(glycochenodeoxycholic acid, GCDCA), 牛黄胆酸(taurocholic acid, TCA)及牛黄脱氧胆酸(taurodeoxycholic acid, TDCA)等. 有研究表明在胆汁淤积所致肝脏损害的病理过程中胆汁酸的毒性作用起重要作用[6,7]. 刘昌等[8]的研究显示胆汁中的胆酸对人胰腺癌细胞PANC 1和MIAPaCa 2细胞株体外增殖有显著抑制作用, 导致细胞表面微绒毛变短变疏, 细胞内线粒体、粗面内质网发生空泡变性的改变, 其抑制机制在于胆酸的细胞膜毒性作用. 然而各种胆汁酸成分的细胞毒性作用是否相同, 特别是对胰腺腺泡细胞具有怎样的作用, 还未见相关的报道. 因此, 我们以大鼠AR42J胰腺腺泡细胞系为研究对象, 选用人胆汁中4种游离胆汁酸CA、DCA、CDCA和LCA, 及3种结合胆汁酸TDCA、GDCA和GCA, 观察他们对细胞存活的影响, 并进一步探讨胆汁酸诱导胰腺腺泡细胞损伤的机制.
AR42J大鼠胰腺腺泡细胞系, 购自中科院上海细胞库. Ham's F12K培养基购自美国Sigma-Aldrich公司, FBS购自美国Gibco公司; CA, DCA, GCA, LCA购自美国Alfa Aesar公司; CDCA, TDCA, GDCA购自美国Sigma-Aldrich公司; MTT购自美国Sigma-Aldrich公司; 碘-淀粉法淀粉酶活性检测试剂盒购自南京建成生物工程研究所; Annexin V-FITC/PI细胞凋亡检测试剂盒购自北京创根胜泰科技有限公司.
1.2.1 细胞培养: 大鼠胰腺腺泡细胞系AR42J细胞于含200 mL/L的胎牛血清、100 kU/L青霉素、100 mg/L链霉素的Ham's F12K培养液中, 在37 ℃、50 mL/L CO2及饱和湿度的培养箱中培养. 细胞每3-4 d换液1次, 用0.125%胰酶+0.02% EDTA消化, 以1:3-1:5传代1次.
1.2.2 四甲基偶氮唑盐(MTT)实验检测胆汁酸对AR42J细胞生长和增殖的影响: 取对数生长期的AR42J细胞, 消化后成单个细胞悬液, 以2×104/100 μL细胞密度接种96孔板, 24 h后换液, 设立对照(CON)组, CA组, DCA组, GCA组, CDCA组, TDCA组, GCDCA组和LCA组. 以上7个胆汁酸处理组, 每组分别设立10个浓度梯度: 0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9和1.0 mmol/L. 每个浓度设3个复孔, 置于培养箱中培养24 h后, 每孔加MTT溶液(5 g/L in PBS)10 μL, 继续孵育4 h. 终止培养, 小心吸弃孔内培养上清液, 每孔加150 μL DMSO, 振荡10 min, 使结晶物充分融解. 选择490 nm波长, 应用酶标仪测定各孔吸光度(A)值, 记录结果. 按以下公式计算细胞存活率: 细胞存活率(%) = (实验组A值-空白组/(对照组A值-空白组A值)×100%. 以检测胆汁酸作用的浓度依赖性关系.
取对数生长期的AR42J细胞, 消化后成单个细胞悬液, 以1×104/100 μL细胞密度接种96孔板, 24 h后换液, 设立CON组和三个胆汁酸处理组: CA组、DCA组和CDCA组, 各处理组胆汁酸浓度为0.4 mmol/L, 各处理组按照以下培养时间分为5个亚组: 12、24、36、48和60 h, 每组设3个复孔, 于相应时间点应用MTT法测定各组细胞存活率, 具体方法同上. 以检测胆汁酸作用的时间依赖性关系.
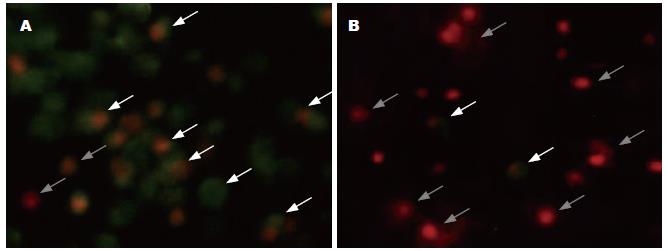
1.2.3 AV/PI双染色观察AR42J细胞凋亡/坏死的改变: 磷脂酰丝氨酸(phosphatidylserine, PS)正常位于细胞膜的内侧, 但在细胞凋亡的早期, PS可从细胞膜的内侧翻转到细胞膜的表面, 暴露在细胞外环境中. Annexin-V是一种相对分子质量为35-36 kDa的Ca2+依赖性磷脂结合蛋白, 能与PS高亲和力特异性结合. 碘化丙啶(propidine iodide, PI)是一种核酸染料, 他不能透过完整的细胞膜, 但在凋亡中晚期的细胞和死细胞, PI能够透过细胞膜而使细胞核红染. 因此将Annexin-V与PI匹配使用, 就可以将凋亡早晚期的细胞以及死细胞区分开来. 取对数生长期的AR42J细胞, 使其浓度为1×106/mL接种6孔板, 分为4组, 分别为CON组, 0.8 mmol/L CA处理组, 0.4 mmol/L DCA处理组和0.8 mmol/L DCA处理组. 置于培养箱中培养24 h后, 消化收集细胞成单细胞悬液. 收集细胞, 1 000 r/min离心5 min, 弃上清. 用PBS洗2次, 1 000 r/min离心5 min. 用200 μL的1×孵育缓冲液(Binding buffer)重悬细胞. 分别加入10 μL Annexin V-FITC和10 μL碘化丙啶(propidium iodide), 室温避光孵育15 min. 再加入300 μL 1×孵育缓冲液重悬细胞, 离心后取细胞沉淀涂片, 在荧光显微镜下观察. 正常活细胞胞膜完整, 不能被荧光染色; 早期凋亡细胞胞膜为绿色荧光(Annexin-V染色阳性); 晚期凋亡和死细胞胞膜为绿色荧光, 胞核红色荧光(AV与PI染色双阳性); 胞膜已破碎的坏死细胞为胞核红色(PI染色阳性).
1.2.4 流式细胞术检测细胞凋亡/坏死率: 取对数生长期的1×106/mL AR42J细胞, 分为4组, CON组, 0.8 mmol/L CA处理组, 0.4 mmol/L DCA处理组和0.8 mmol/L DCA处理组. 置于培养箱中培养24 h后, 消化收集细胞成单细胞悬液, 通过流式细胞仪(FCM)采用Annexin-V/PI双染法对其进行凋亡率和坏死率检测, 按照试剂盒说明书进行操作.
统计学处理 采用SPSS12.0统计软件进行单因素方差分析, 组间比较采用LSD法.
CA, GCA和GDCA在浓度为0.1-1.0 mmol/L内对AR42J细胞的存活率没有显著影响, 对细胞的生长和存活没有损害作用; 而DCA, CDCA和LCA分别从0.3 mmol/L浓度开始, TDCA从0.4 mmol/L浓度开始, AR42J细胞的存活率明显下降, 均显著抑制细胞的生长和存活, 具有细胞毒作用, 且呈剂量依赖性增强(图1).
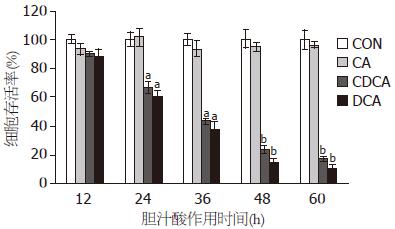
0.4 mmol/L的CA在对AR42J细胞作用60 h的时间内, 对细胞存活率没有明显的影响, 不损伤细胞. 而DCA和CDCA对细胞作用12 h就使细胞存活率下降, 24 h开始且随时间延长, 细胞存活率下降越来越显著, 对AR42J细胞损伤的细胞毒作用呈时间依赖性(图2).
在相差光学显微镜下观察胆汁酸作用24 h的AR42J细胞变化. 发现0.8 mmol/L CA组细胞同CON组相比细胞密度和形态均无明显改变; 0.4 mmol/L DCA组和0.4 mmol/L CDCA组细胞变化相似, 同CON组细胞相比细胞密度明显降低, 出现较多悬浮的凋亡细胞和死细胞; 0.8 mmol/L DCA组和0.8 mmol/L CDCA组细胞变化相似, 同CON相比细胞密度更低, 贴壁的活细胞很少, 出现大量悬浮的凋亡细胞、死细胞和细胞碎片(图3). 在荧光显微镜下进一步观察AR42J细胞在胆汁酸CA或DCA作用24 h, 经Annexin-V/PI双染后, 凋亡与坏死的改变. 发现0.8 mmol/L CA组细胞和CON组细胞相同, 均未出现凋亡与坏死细胞; 0.4 mmol/L DCA组细胞则出现较多的凋亡早期细胞和凋亡晚期细胞(分别为胞膜绿色荧光和胞膜绿色荧光+核红色荧光)和少量坏死细胞(核红色荧光); 0.8 mmol/L DCA组细胞出现更多的坏死细胞和较少的凋亡细胞(图4).
0.8 mmol/L CA组细胞凋亡率与坏死率同CON组无明显区别(1.2% vs 0.9%; 1.0% vs 1.0%); 0.4 mmol/L DCA组细胞凋亡率和坏死率分别为45.2%和8.9%, 均明显高于CON组细胞; 0.8 mmol/L DCA组细胞凋亡率为18.6%, 明显高于CON组而低于0.4 mmol/L DCA组, 坏死率为45.4%, 明显高于CON组和0.4 mmol/L DCA组.
ABP在我国占AP总数的一半以上, 在美国占25%-45%, 但世界各地不同作者的病因统计结果差别极大, 最低的仅为3%, 最高的达75%[4]. 1901年Opie在1例死于AP患者的尸检中, 发现一结石嵌塞于Vater壶腹, 因而表明结石嵌塞于胆胰管共同通道末端使胆汁反流到胰管能引起AP. 这一发现直到20世纪70年代中期才被接受, 使ABP成为一个独立的疾病[9], 揭开了对其研究的序幕. 此后, 尽管人们对ABP发病机制形成了多种认识, 但还没有完全达成共识. 因其发病率高、发病独特、重症型救治棘手死亡率高, 而成为亟待攻克的难题.
可以认为, 随胆汁异常反流入胰管的胆汁酸, 造成胰腺腺泡细胞功能与结构损害是大多数ABP发病的一个关键性因素. 人们在20世纪中期便利用胆胰管逆行性注射胆汁酸而成功复制了AP动物模型, 该模型同AP的临床发病特点和病理性改变均符合, 成为研究AP发病机制和治疗的常用动物模型之一[5,10,11]. 在此基础之上, 我们进一步深入研究各种胆汁酸成分对胰腺腺泡细胞的损伤性作用和功能的影响. 大鼠AR42J胰腺腺泡细胞系具有胰腺腺泡细胞的绝大多数功能, 而成为进行AP体外实验研究的标准胰腺腺泡细胞系[12-14]. 因此, 我们以大鼠AR42J胰腺腺泡细胞系为研究对象, 选用人胆汁酸中4种主要的游离胆汁酸CA、DCA、CDCA和LCA, 及3种结合胆汁酸TDCA、GDCA和GCA, 观察他们对细胞存活的影响, 并进一步探讨胆汁酸诱导胰腺腺泡细胞损伤的机制.
本研究证实了胆汁酸对胰腺腺泡细胞的直接损伤性作用, 并首次对比研究了各种不同成分的作用特点, 发现DCA、CDCA和LCA的细胞毒作用最强, 0.3 mmol/L作用24 h即显著降低细胞存活率; TDCA其次, 0.4 mmol/L作用24 h显著降低细胞存活率; 而初级胆汁酸CA和甘氨结合型胆汁酸(GCA、GDCA)则在0.1-1.0 mmol/L浓度范围内作用24 h不具有细胞毒作用, 不影响细胞的存活率. 显示次级胆汁酸和游离型胆汁酸的细胞毒作用可能更强一些, 但又不是绝对的, 同各种胆汁酸特异的结构和理化性质有关. 胆汁酸具有表面活性作用, 因为他的分子结构有两性, 一端为烷基, 具有亲油性, 可以和油脂类结合; 另一端为羟基和羧基, 具有亲水性. 因此, 体内胆汁酸最重要的功能是消化食物中的脂肪和脂溶性物质(油溶性维生素和胆固醇等). 另一方面, 胆汁酸具有多种毒性作用, 包括细胞毒作用及急、慢性毒性作用[15]. 胆汁酸的毒性作用在胆汁淤积所致肝脏损害的病理过程中起重要作用[6,7]. 刘昌等[8]的研究显示胆汁中的胆酸对人胰腺癌细胞PANC 1和MIAPaCa 2细胞株体外增殖有显著抑制作用, 导致细胞表面微绒毛变短变疏, 细胞内线粒体、粗面内质网发生空泡变性的改变, 其抑制机制在于胆酸的细胞膜毒性作用. 大量的研究表明, 胆汁酸作用途径与作用效果具有多样性, 不仅依靠其"去污性"溶解细胞膜导致细胞崩解坏死, 还可以诱导细胞内基因表达的改变, 诱导肝癌细胞、结肠癌细胞、卵巢癌细胞、食管癌细胞等多种细胞发生凋亡[16-21]. 另有研究发现, 熊脱氧胆酸(ursodeoxycholic acid)还具有对抗其他胆汁酸诱导的细胞凋亡作用[22,23].
本研究继续深入探讨胆汁酸对胰腺腺泡细胞的作用特点和功能影响, 发现DCA和CDCA对细胞的损伤作用相同, 高浓度时主要表现为细胞膜崩解、破碎, 细胞溶解坏死, 较低浓度时除坏死外还表现为细胞凋亡的改变. 显示胆汁酸对胰腺腺泡细胞的损伤作用呈现双重性, 与以往的动物模型实验表现相符[24,25], 即低浓度胆汁酸导致胰腺腺泡细胞凋亡较多而坏死较少, 病情较轻, 反之则坏死较多凋亡较少, 病情较重. 细胞凋亡是受基因调控的细胞自主的有序的死亡, 包含了复杂的调控机制, 与细胞坏死有着本质区别, 不引起炎症刺激.
总之, 我们研究发现, 人胆汁酸内的7种成分对大鼠AR42J胰腺腺泡细胞的损伤作用不同, 其中DCA、CDCA、LCA和TDCA具有明显的细胞毒作用, 在较低浓度时表现为凋亡和坏死, 较高浓度时则主要表现为细胞坏死. 本研究将为进一步揭示胆源性AP的发病机制和探寻防治措施提供有益的启示.
急性胆源性胰腺炎在我国发病率较高, 占急性胰腺炎的50%-80%, 而其发病机制至今未完全阐明, 重症型临床救治非常棘手.
周晓东, 副教授, 南昌大学第一附属医院消化内科.
目前普遍认为急性胰腺炎的始发事件为胰腺腺泡细胞的损伤, 胰腺腺泡细胞凋亡与坏死的发生及其机制成为当前研究的热点.
自从1901年Opie提出"胆汁反流共同通道学说"以来, 人们对于胆汁在胰腺炎发病中的作用有了较深入的认识, 相关的动物模型研究非常多. 系统深入的细胞与分子水平研究报道还不多见.
本研究从不同胆汁酸成分对胰腺腺泡细胞不同损伤特点, 将为深入探寻胆源性胰腺炎的发病机制和临床诊治措施提供有益的线索.
本研究证实, 7种胆汁酸对AR42J细胞的损伤作用不同, 主要表现为凋亡或/和坏死, 同剂量相关. 为揭示胆源性胰腺炎的发病机制提供了启示.
本研究通过体外实验比较分析了胆汁酸的各种成份对胰腺腺泡细胞的毒性作用, 具有一定的创新性和可读性.
编辑: 李军亮 电编:吴鹏朕
| 2. | Tarnasky PR, Linder JD. Acute biliary pancreatitis: what have we learned? Clin Gastroenterol Hepatol. 2006;4:803; author reply 803. [PubMed] [DOI] |
| 3. | Grandadam S, Compagnon P, Boudjema K. [Acute biliary pancreatitis]. Rev Prat. 2007;57:2139-2148. [PubMed] |
| 5. | Chan YC, Leung PS. Acute pancreatitis: animal models and recent advances in basic research. Pancreas. 2007;34:1-14. [PubMed] [DOI] |
| 9. | 张 跃, 王 代科. 胆石性胰腺炎的发病机制和诊治进展. 国外医学·外科学分册. 1992;19:273-276. |
| 10. | 张 桂信, 陈 海龙, 曲 淑贤, 宫 爱霞. 清胰汤对大鼠急性坏死性胰腺炎时胰腺腺泡细胞凋亡的影响. 中国中西医结合外科杂志. 2008;14:38-42. |
| 11. | Laukkarinen JM, Van Acker GJ, Weiss ER, Steer ML, Perides G. A mouse model of acute biliary pancreatitis induced by retrograde pancreatic duct infusion of Na-taurocholate. Gut. 2007;56:1590-1598. [PubMed] [DOI] |
| 12. | Long YM, Chen K, Liu XJ, Xie WR, Wang H. Cell-permeable Tat-NBD peptide attenuates rat pancreatitis and acinus cell inflammation response. World J Gastroenterol. 2009;15:561-569. [PubMed] [DOI] |
| 13. | Folch-Puy E, Granell S, Dagorn JC, Iovanna JL, Closa D. Pancreatitis-associated protein I suppresses NF-kappa B activation through a JAK/STAT-mediated mechanism in epithelial cells. J Immunol. 2006;176:3774-3779. [PubMed] |
| 14. | Yu JH, Seo JY, Kim KH, Kim H. Differentially expressed proteins in cerulein-stimulated pancreatic acinar cells: implication for acute pancreatitis. Int J Biochem Cell Biol. 2008;40:503-516. [PubMed] [DOI] |
| 16. | Yui S, Saeki T, Kanamoto R, Iwami K. Characteristics of apoptosis in HCT116 colon cancer cells induced by deoxycholic acid. J Biochem. 2005;138:151-157. [PubMed] [DOI] |
| 17. | Zhang R, Gong J, Wang H, Wang L. Bile salts inhibit growth and induce apoptosis of human esophageal cancer cell line. World J Gastroenterol. 2005;11:5109-5116. [PubMed] |
| 18. | Rust C, Wild N, Bernt C, Vennegeerts T, Wimmer R, Beuers U. Bile acid-induced apoptosis in hepatocytes is caspase-6-dependent. J Biol Chem. 2009;284:2908-2916. [PubMed] [DOI] |
| 19. | Katona BW, Anant S, Covey DF, Stenson WF. Characterization of enantiomeric bile acid-induced apoptosis in colon cancer cell lines. J Biol Chem. 2009;284:3354-3364. [PubMed] [DOI] |
| 20. | Shant J, Cheng K, Marasa BS, Wang JY, Raufman JP. Akt-dependent NF-kappaB activation is required for bile acids to rescue colon cancer cells from stress-induced apoptosis. Exp Cell Res. 2009;315:432-450. [PubMed] [DOI] |
| 21. | Horowitz NS, Hua J, Powell MA, Gibb RK, Mutch DG, Herzog TJ. Novel cytotoxic agents from an unexpected source bile acids and ovarian tumor apoptosis. Gynecol Oncol. 2007;107:344-349. [PubMed] [DOI] |
| 22. | Carubbi F, Guicciardi ME, Concari M, Loria P, Bertolotti M, Carulli N. Comparative cytotoxic and cytoprotective effects of taurohyodeoxycholic acid (THDCA) and tauroursodeoxycholic acid (TUDCA) in HepG2 cell line. Biochim Biophys Acta. 2002;1580:31-39. [PubMed] |
| 23. | Perez MJ, Briz O. Bile-acid-induced cell injury and protection. World J Gastroenterol. 2009;15:1677-1689. [PubMed] [DOI] |