修回日期: 2009-12-13
接受日期: 2009-12-14
在线出版日期: 2010-01-28
目的: 探讨CD83、CD1a和Ki-67在大肠癌组织中的表达及预后意义.
方法: 采用免疫组织化学和流式细胞术检测60例大肠癌组织中CD83、CD1a和Ki-67的表达情况, 并分析其与大肠癌临床病理特点和预后的关系.
结果: 免疫组织化学检测显示, 低Dukes分期、预后好的癌组织中CD83和CD1a阳性率均显著高于对应组(均P<0.05), 而FCM检测只显示CD1a阳性率显著高于对应组(均P<0.05); 两检测均显示, 高Dukes分期、预后差的癌组织中Ki-67阳性率显著高于对应组(均P<0.05).
结论: CD83、CD1a和Ki-67的表达与大肠癌Dukes分期和预后相关, 可以作为检测大肠癌预后的参考指标.
引文著录: 杨雪峰, 杨伟明, 刘宙, 赵洪远, 王超宇, 邬江华. CD83、CD1a和Ki-67在大肠癌中的表达及意义. 世界华人消化杂志 2010; 18(3): 256-261
Revised: December 13, 2009
Accepted: December 14, 2009
Published online: January 28, 2010
AIM: To analyze the prognostic significance of CD83, CD1a, and Ki-67 expression in colorectal carcinoma.
METHODS: The expression of CD83, CD1a, and Ki-67 in 60 cases of colorectal cancer was detected by immunohistochemistry and flow cytometry (FCM). The correlations of CD83, CD1a, and Ki-67 expression with clinicopathological parameters and prognosis in colorectal cancer were analyzed.
RESULTS: Immunohistochemistry analysis showed that the positive rates of CD83 and CD1a in early-stage (Dukes' stage) colorectal cancer patients and those with a good prognosis were significantly higher than those in advanced-stage patients and those with a poor prognosis, respectively (all P < 0.05). FCM analysis showed that the positive rate of CD1a was significantly higher in early-stage colorectal cancer patients and those with a good prognosis than in advanced-stage patients and those with a poor prognosis, respectively (both P < 0.05). Both immunohistochemistry and FCM results showed that the positive rate of Ki-67 was significantly lower in early-stage colorectal cancer patients and those with a good prognosis than in advanced-stage patients and those with a poor prognosis, respectively (both P < 0.05).
CONCLUSION: CD83, CD1a, and Ki-67 expression is correlated with the Dukes' stage and prognosis of colorectal cancer and can therefore be used as a prognostic parameter for the disease.
- Citation: Yang XF, Yang WM, Liu Z, Zhao HY, Wang CY, Wu JH. Prognostic significance of CD83, CD1a and Ki-67 expression in colorectal carcinoma. Shijie Huaren Xiaohua Zazhi 2010; 18(3): 256-261
- URL: https://www.wjgnet.com/1009-3079/full/v18/i3/256.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i3.256
大肠癌(colorectal cancer, CRC)是世界第三大常见的恶性肿瘤, 在欧美国家居恶性肿瘤死因的第2位[1-2]. 随着我国饮食结构、生活习惯和环境的改变, 其发病率逐年上升[3], 和大多数恶性肿瘤一样, 大肠癌的预后因素尚不清楚. 新近研究发现, 树突状细胞(dendritic cell, DC)是目前所知机体内功能最强的抗原提呈细胞(antigen-presenting cell, APC), 是机体免疫应答的始动者. 肿瘤组织内浸润性树突状细胞(tumor infiltrating dendritic cell, TIDC)的数量与功能对机体免疫有重要提示意义, 与肿瘤的临床分期和预后相关[4]. CD83和CD1a是鉴定人外周血中DC的特异标志. 本研究采用免疫组织化学和流式细胞术(flow cytometry, FCM)分别检测大肠癌原发病灶中TIDC的标志物CD83和CD1a的表达状况, 同时检测与肿瘤细胞增殖密切相关的抗原Ki-67在肿瘤细胞中的表达, 分析其与大肠癌临床病理特点和预后的关系, 进而了解大肠癌组织局部免疫状况对预后的影响.
收集遵义医学院附属医院普外科1990-06/2006-06经病理确诊的60例大肠癌石蜡标本, 均为原发病灶(临床资料完整), 男41例, 女29例, 年龄26-78(中位数52)岁; 高分化30例, 中分化9例, 低分化21例; Dukes分期: A期6例, B期25例, C期21例, D期8例; 伴有淋巴结转移14例, 无淋巴结转移46例; ≥5年生存者30例, <3年死亡者30例. 所有患者均为第1次手术, 术前未经任何放化疗, 随访至术后5年以上(随访资料完整). CD83单克隆抗体(HB15a: sc-19677)、CD1a单克隆抗体(GM357101/02/04)、Ki-67单克隆抗体(GM724001/02/04)、EnVision试剂盒(二抗、三抗试剂)均购于基因科技(上海)有限公司. 流式细胞仪(FACS Calibur, Becton Dickinson, USA). PE标记的抗CD83抗体、APC标记的抗CD1a抗体、FITC标记的抗Ki-67抗体, 均为美国BD公司产品.
1.2.1 免疫组织化学染色: 采用免疫组织化学SABC法, 操作按照说明书进行. 以试剂公司提供的阳性切片为阳性对照, 以PBS代替一抗作为阴性对照. 判定结果: CD83、CD1a均定位于胞膜或胞质, Ki-67定位于胞核、有丝分裂细胞胞质. 以细胞膜、细胞质或细胞核呈棕黄色颗粒为阳性. (1)CD83、CD1a计数: 选取癌组织中染色密集区域作为染色的观察重点. 对于DC, 只有确定树突细胞的细胞核者才能计数, 单纯看到细胞树突者不进行计数. 在癌组织中, 分别于每一切片取阳性细胞数量最多区域观察, 共观察30个高倍视野(放大400倍), 观察计数DC, 计算每个高倍视野的DC平均数. 根据每个高倍视野中DC的数目进行分组: 每个高倍视野中DC<10者为DC减少组, ≥10者为DC增多组. 根据以上标准, 将DC减少组定为阴性(-), DC增多组定为阳性(+)[5]. (2)Ki-67增殖指数计算: Ki-67阳性定位于细胞核中, 呈棕黄色颗粒, 在40倍镜下随机选取10个视野, 每个视野统计数500个细胞, 计算阳性细胞数占总细胞数的百分数, 即为Ki-67增殖指数. 以每10个高倍视野阳性细胞百分比>10%定为阳性.
1.2.2 FCM: 取10 g标本, 经脱蜡、水化、胰蛋白酶37 ℃恒温水浴震动消化30 min, 300目尼龙网过滤, 生理盐水10 min离心2次(500-800 r/min), 去除细胞碎片. 沉淀细胞PBS重悬并计数, 取106个细胞, 加入流式细胞检测管, 离心弃上清, 分别加入抗CD83-PE抗体、抗CD1a-APC抗体和抗Ki-67-FITC抗体, 混匀后室温避光孵育30 min, 1 mL PBS稀释, 离心弃上清, 加固定液150 μL上机检测.
统计学处理 采用SPSS13.0统计软件, 采用χ2检验, 以P<0.05为差异有显著性.
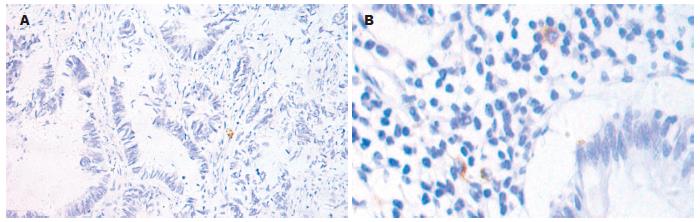
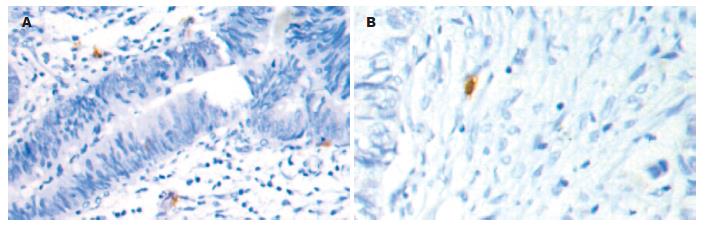
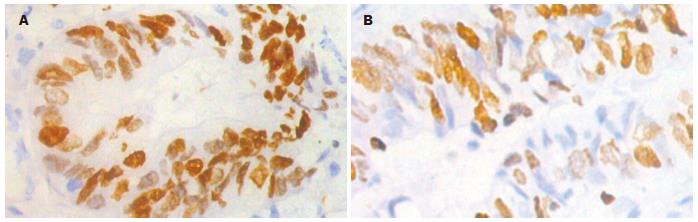
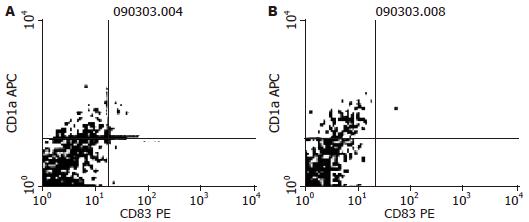
60例大肠癌组织进行免疫组织化学检测, CD83阳性表达19例. 各标本间阳性细胞分布不一, 肿瘤细胞间(图1A)或肿瘤边缘正常组织(图1B)中均有散在分布, 胞体较大, 圆形. CD1a阳性表达24例, 胞体较大, 圆形, 阳性细胞散在分布于癌巢内(图2A)、肿瘤周边及正常组织之间(图2B), 以癌巢组织区域分布较多. Ki-67阳性表达37例, Ki-67在大肠癌肿瘤细胞有表达, 阳性表达定位于细胞核或细胞质, 呈棕黄色或棕褐色(图3). 60例大肠癌组织经FCM法均检测到CD83、CD1a和Ki-67表达. CD83阳性表达率范围为0.06%-3.98%. CD1a阳性表达率范围为0.33%-9.45%. Ki-67阳性表达率范围为0.07%-6.39%.
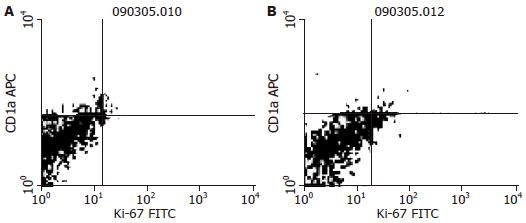
CD83、CD1a和Ki-67的表达与大肠癌患者分化程度、淋巴结转移无明显关系, 与Dukes分期、预后相关. 免疫组织化学检测显示(表1), 低Dukes分期、预后好的癌组织中CD83和CD1a阳性率显著高于对应组(P<0.05); 高Dukes分期、预后差的癌组织中Ki-67阳性率显著高于对应组(P<0.05). FCM检测显示, 低Dukes分期的癌组织中CD83和CD1a阳性率显著高于对应组(P<0.05, 图4, 5), 预后好的癌组织中CD1a阳性率显著高于对应组(P<0.05); 高Dukes分期、预后差的癌组织中Ki-67阳性率显著高于对应组(P<0.05).
肿瘤与机体相互作用的局部微环境, 特别是免疫微环境, 对肿瘤的发生、发展和转移有着重要的影响[6,7]. 局部癌组织中机体的免疫力和肿瘤细胞的增殖力是决定患者预后的重要因素之一. DC是目前所知机体内功能最强的APC, 是机体免疫应答的始动者. 研究表明同源结肠癌患者外周血DC和T淋巴细胞共孵后能抑制裸鼠体内移植瘤的生长[8]. 大肠癌中TIDC的浸润密度在一定程度上反映了机体抗肿瘤的免疫强度[9].
近年来, 许多研究围绕TIDC的浸润密度与肿瘤预后的关系这一课题展开, 但仍未有明确结论, 其中显示与预后呈正相关的报道有胃癌[10]、喉癌[11]、肝癌[12]、宫颈癌、膀胱癌[14]、肺癌[15]等. 但也有一些报道认为TIDC数量与肿瘤预后无关联: Coventry等[16]分别用CD1a、S-100、CD83标志51例乳腺癌TIDC, 发现CD1a+ TIDC或S-100+ TIDC的浸润密度与患者5年生存率无统计学意义上的相关性, 而CD83+ TIDC浸润密度与患者5年生存率呈正相关. Iwamoto等[5]用130例乳腺癌做了类似研究, 亦得出相同结论.
CD83是人成熟DC的主要特征性标志[17], 其激活淋巴细胞功能最强[18], 由于成熟DC的低水平表达, 不能使肿瘤抗原引起有效免疫应答, 从而诱导了T细胞的无能状态, 使得机体的免疫系统不能将肿瘤细胞清除, 是肿瘤无限制性生长的原因之一[19]. 研究显示大肠癌和胃癌中CD83表达与患者临床分期和预后显著相关[20,21].
CD1a+ DC是CD34+造血祖细胞在GM-CSF和TNF-α作用下分化出来的前体DC[22]. 目前研究表明, CD1a主要标记未成熟的DC, 能激活Naïve T细胞, 刺激CD8+ T细胞增殖; 在不成熟阶段就能表现出通过Mannose受体介导途径的抗原摄取能力[23], 已广泛应用于DC分离、纯化和体外培养的鉴定. 结直肠癌和胰腺癌中具有CD1a标记的TIDC浸润程度与患者生存期相关[24,25]. 本课题通过对大肠癌组织中CD1a、CD83的表达情况来评估TIDC与大肠癌临床病理特点的关系, 进而探讨观测大肠癌预后的更好检测指标.
本研究发现, 大肠癌组织中CD83和CD1a标记的TIDC与Dukes分期密切相关, Dukes分期早的肿瘤组织中TIDC浸润密度高, 容易激活机体产生有效地抗肿瘤免疫应答, 因而预后较好. ≥5年生存组的大肠癌组织中CD83和CD1a表达较<3年死亡组的大肠癌组织中CD83和CD1a表达高, 二者表达高的大肠癌患者预后好, 提示用CD83和CD1a标记的TIDC可以作为判断大肠癌预后的参考指标使用. FCM均检测到大肠癌组织CD83有低水平表达, 是因为FCM方法需消化肿瘤组织; 而研究发现, 成熟与未成熟DC存在分布差异[26], 成熟DC主要分布在肿瘤组织旁, 肿瘤组织内主要是未成熟DC[26-28]. 因此, FCM检测≥5年生存组和<3年死亡组间CD83表达无统计学差异, 其实是因为肿瘤组织内成熟DC表达太低的原因.
目前利用CD1a标记TIDC存在缺陷, CD1a只能代表TIDC其中的一个亚型, 本研究分别检测TIDC的标志物CD1a和CD83并不能反映局部癌组织中的全部TIDC. 下一步在研究大肠癌组织中TIDC浸润数量与预后的关系时, 应进一步寻找更特异的DC表面标记, 增加DC计数的准确性, 对大肠癌患者的预后能做出更好的判断.
研究肿瘤增殖动力学的一个重要方面是检测肿瘤细胞的增殖活性, 细胞增殖活性可以判断肿瘤恶性程度及评估肿瘤的生物学行为, 是判断肿瘤预后的指标之一. Ki-67的表达与细胞周期密切相关, 他代表的细胞群体包括G1、S、G2和M期的细胞, 并且在有丝分裂后可迅速降解或失去抗原决定簇, 是全面可靠评估增殖活性的客观指标, 成为临床上检测人类恶性肿瘤转归的一个重要指标. 研究显示Ki-67表达与胆囊癌的侵袭力相关[29], 与大肠癌和乳腺癌临床分期和预后相关[30,31].
我们发现, Dukes分期晚的大肠癌组织和<3年死亡组的大肠癌组织中Ki-67表达高, 提示大肠癌恶性程度越高、Ki-67表达越高、预后越差, 即Ki-67可作为判断预后的参考指标. 由于Ki-67不仅在肿瘤细胞中有表达, 同时在肿瘤组织周边处于有丝分裂期的少许正常腺腔细胞中也有表达, 显微镜下观察癌巢中这部分正常细胞很少, 故究竟对实验结果产生多大影响尚需进一步探讨.
本研究中, CD83、CD1a和Ki-67在大肠癌组织的表达高低与大肠癌的临床分期和预后密切相关, 可以作为观测大肠癌预后的检测指标.
DC是体内功能最强的专职抗原递呈细胞, 也是唯一能激活初始型T细胞的APC, 处于免疫反应的中心地位. Ki-67是能反映肿瘤细胞群体增殖活性的客观指标. 二者与肿瘤的发生、发展和预后有着密切的关系.
杜祥, 教授, 复旦大学附属肿瘤医院病理科.
研究肿瘤组织中TIDC表达情况, 用于判断肿瘤恶性程度及预后是研究热点之一. 明确不同肿瘤中DC的特异性标志物需要进一步研究探讨.
本实验按≥5年生存组和<3年死亡组各30例收集大肠癌标本, 联合应用免疫组织化学和流式细胞术检测病灶中TIDC的浸润密度和功能状况.
本实验证实, CD83、CD1a和Ki-67的表达与大肠癌Dukes分期和预后相关, 可以作为检测大肠癌预后的参考指标. 为大肠癌术后经病理切片分析预后提供一个检测方法.
本研究探讨了CD83、CD1a和Ki-67在大肠癌组织中的表达及其预后意义, 结论有一定参考价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Jemal A, Siegel R, Ward E, Hao Y, Xu J, Thun MJ. Cancer statistics, 2009. CA Cancer J Clin. 2009;59:225-249. [PubMed] [DOI] |
| 2. | Ferlay J, Autier P, Boniol M, Heanue M, Colombet M, Boyle P. Estimates of the cancer incidence and mortality in Europe in 2006. Ann Oncol. 2007;18:581-592. [PubMed] [DOI] |
| 4. | Atreya I, Neurath MF. Immune cells in colorectal cancer: prognostic relevance and therapeutic strategies. Expert Rev. Anticancer Ther. 2008;8:561-572. [PubMed] [DOI] |
| 5. | Iwamoto M, Shinohara H, Miyamoto A, Okuzawa M, Mabuchi H, Nohara T, Gon G, Toyoda M, Tanigawa N. Prognostic value of tumor-infiltrating dendritic cells expressing CD83 in human breast carcinomas. Int J Cancer. 2003;104:92-97. [PubMed] [DOI] |
| 7. | Movassagh M, Spatz A, Davoust J, Lebecque S, Romero P, Pittet M, Rimoldi D, Liénard D, Gugerli O, Ferradini L. Selective accumulation of mature DC-Lamp+ dendritic cells in tumor sites is associated with efficient T-cell-mediated antitumor response and control of metastatic dissemination in melanoma. Cancer Res. 2004;64:2192-2198. [PubMed] [DOI] |
| 9. | Engleman EG. Dendritic cell-based cancer immunotherapy. Semin Oncol. 2003;30:23-29. [PubMed] [DOI] |
| 11. | 陈 文宽, 陈 福进, 曾 宗渊, 伍 国号, 郭 朱明, 魏 茂文, 杨 安奎, 张 诠, 何 洁华, 候 景辉. CD1a标记树突细胞在声门型喉鳞癌中的表达及其临床意义. 癌症. 2005;24:1124-1126. |
| 12. | 罗 小玲, 梁 安民, 葛 连英, 谢 裕安, 匡 志鹏, 吴 继宁, 王 娟. 树突状细胞浸润对原发性肝癌生物学行为和预后的影响. 湖南师范大学学报(医学版). 2006;3:20-23. |
| 16. | Coventry BJ, Morton J. CD1a-positive infiltrating-dendritic cell density and 5-year survival from human breast cancer. Br J Cancer. 2003;89:533-538. [PubMed] [DOI] |
| 17. | Prechtel AT, Steinkasserer A. CD83: an update on functions and prospects of the maturation marker of dendritic cells. Arch Dermatol Res. 2007;299:59-69. [PubMed] [DOI] |
| 18. | Yilmaz T, Gedikoglu G, Celik A, Onerci M, Turan E. Prognostic significance of Langerhans cell infiltration in cancer of the larynx. Otolaryngol Head Neck Surg. 2005;132:309-316. [PubMed] [DOI] |
| 19. | Rouard H, Léon A, Klonjkowski B, Marquet J, Tennezé L, Plonquet A, Agrawal SG, Abastado JP, Eloit M, Farcet JP. Adenoviral transduction of human 'clinical grade' immature dendritic cells enhances costimulatory molecule expression and T-cell stimulatory capacity. J Immunol Methods. 2000;241:69-81. [PubMed] [DOI] |
| 20. | Inoue Y, Nakayama Y, Minagawa N, Katsuki T, Nagashima N, Matsumoto K, Shibao K, Tsurudome Y, Hirata K, Nagata N. Relationship between interleukin-12-expressing cells and antigen-presenting cells in patients with colorectal cancer. Anticancer Res. 2005;25:3541-3546. [PubMed] |
| 21. | Saito H, Osaki T, Murakami D, Sakamoto T, Kanaji S, Ohro S, Tatebe S, Tsujitani S, Ikeguchi M. Prediction of sites of recurrence in gastric carcinoma using immunohistochemical parameters. J Surg Oncol. 2007;95:123-128. [PubMed] [DOI] |
| 22. | Goldman SA, Baker E, Weyant RJ, Clarke MR, Myers JN, Lotze MT. Peritumoral CD1a-positive dendritic cells are associated with improved survival in patients with tongue carcinoma. Arch. Otolaryngol Head Neck Surg. 1998;124:641-646. [PubMed] |
| 23. | Zhou LJ, Schwarting R, Smith HM, Tedder TF. A novel cell-surface molecule expressed by human interdigitating reticulum cells, Langerhans cells, and activated lymphocytes is a new member of the Ig superfamily. J Immunol. 1992;149:735-742. [PubMed] |
| 24. | Nagorsen D, Voigt S, Berg E, Stein H, Thiel E, Loddenkemper C. Tumor-infiltrating macrophages and dendritic cells in human colorectal cancer: relation to local regulatory T cells, systemic T-cell response against tumor-associated antigens and survival. J Transl Med. 2007;5:62. [PubMed] [DOI] |
| 25. | Dallal RM, Christakos P, Lee K, Egawa S, Son YI, Lotze MT. Paucity of dendritic cells in pancreatic cancer. Surgery. 2002;131:135-138. [PubMed] [DOI] |
| 26. | Bell D, Chomarat P, Broyles D, Netto G, Harb GM, Lebecque S, Valladeau J, Davoust J, Palucka KA, Banchereau J. In breast carcinoma tissue, immature dendritic cells reside within the tumor, whereas mature dendritic cells are located in peritumoral areas. J Exp Med. 1999;190:1417-1426. [PubMed] [DOI] |
| 27. | Aso T, Ogawa Y, Naoe M, Fukagai T, Yoshida H, Kushima M. [Immunohistochemical analysis of CD83, CD8 and CD4 positive cells in renal cell carcinoma]. Nippon Hinyokika Gakkai Zasshi. 2004;95:645-650. [PubMed] |
| 28. | Tsuge T, Yamakawa M, Tsukamoto M. Infiltrating dendritic/Langerhans cells in primary breast cancer. Breast Cancer Res Treat. 2000;59:141-152. [PubMed] [DOI] |
| 30. | Ma YL, Peng JY, Zhang P, Liu WJ, Huang L, Qin HL. Immunohistochemical analysis revealed CD34 and Ki67 protein expression as significant prognostic factors in colorectal cancer. Med Oncol. 2009; Apr 2. [Epub ahead of print]. [PubMed] |
| 31. | Jones RL, Salter J, A'Hern R, Nerurkar A, Parton M, Reis-Filho JS, Smith IE, Dowsett M. The prognostic significance of Ki67 before and after neoadjuvant chemotherapy in breast cancer. Breast Cancer Res Treat. 2009;116:53-68. [PubMed] [DOI] |