修回日期: 2009-12-19
接受日期: 2009-12-21
在线出版日期: 2010-01-28
目的: 探讨永生化人胰星状细胞(IPSC)对胰腺癌细胞株Patu8988侵袭和转移的影响.
方法: 制备IPSC上清, 用IPSC上清和Patu8988共培养, 以单独培养的Patu8988为对照, 比较实验组与对照组细胞的增殖、黏附能力, 侵袭、迁移能力, 克隆形成以及抵抗H2O2诱导的Patu8988凋亡能力.
结果: 与单独培养的胰腺癌细胞株Patu8988相比, IPSC上清对胰腺癌细胞株Patu8988细胞的增殖、黏附、迁移、侵袭能力及克隆形成能力有促进作用(均P<0.05), 并能抑制H2O2诱导的Patu8988的凋亡(P<0.05).
结论: 胰星状细胞可能通过增强胰腺癌细胞株Patu8988的增殖、黏附、迁移、侵袭能力及克隆形成能力, 并抑制其的凋亡, 在胰腺癌的发展和转移中起重要作用.
引文著录: 倪建琦, 蒋小华, 严伟, 葛梓, 汤文浩. 胰星状细胞对胰腺癌细胞株Patu8988侵袭和转移的影响. 世界华人消化杂志 2010; 18(3): 240-244
Revised: December 19, 2009
Accepted: December 21, 2009
Published online: January 28, 2010
AIM: To investigate the effects of immortalized pancreatic stellate cells (IPSCs) on the invasion and migration of human pancreatic cancer Patu8988 cells.
METHODS: After Patu8988 cells were incubated with the culture supernatant of IPSCs, their growth, adherence, invasion, migration, clonogenicity and resistance to hydrogen peroxide (H2O2)-induced apoptosis were measured.
RESULTS: Compared with untreated Patu8988 cells, cell growth, adherence, invasion, migration and clonogenicity were promoted (all P < 0.05), and H2O2-induced apoptosis (P < 0.05) was inhibited in Patu8988 cells incubated with the supernatant of IPSCs.
CONCLUSION: Pancreatic stellate cells may exert an important role in the progression and metastasis of pancreatic cancer by promoting the growth, adherence, invasion, migration and clonogenicity of Patu8988 cells and inhibiting their apoptosis.
- Citation: Ni JQ, Jiang XH, Yan W, Ge Z, Tang WH. Pancreatic stellate cells promote the invasion and migration of human pancreatic cancer Patu8988 cells. Shijie Huaren Xiaohua Zazhi 2010; 18(3): 240-244
- URL: https://www.wjgnet.com/1009-3079/full/v18/i3/240.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i3.240
胰腺癌是一种严重危害人类健康的消化系疾病, 在欧美国家, 其为恶性肿瘤死因的第4位, 5年生存率不到5%[1]. 胰腺癌生长速度快, 在早期就有转移, 对放射和化学疗法不敏感, 其病理特征是癌组织周围有大量以成纤维细胞, 胶原和纤维粘连蛋白等结缔组织聚集为特点[2,3]. 而近年的研究发现, 胰腺星状细胞(pancreatic stellate cell, PSC)是胰腺组织中的重要间质细胞, 在胰腺癌中, PSC从静止状态转化为活化状态, 并且分泌大量细胞活性因子, 但其在胰腺癌的发展和转移中的作用并不十分清楚. 本实验通过建立体外永生化人胰星状细胞(immortalized pancreatic stellate cell, IPSC)上清与胰腺癌细胞株Puta8988共培养模型, 检测共培养后Puta8988增殖、凋亡、侵袭、迁移、黏附能力的变化, 初步探讨PSC对胰腺癌侵袭和转移的影响.
胰腺癌细胞株Patu8988为东南大学临床医学院中心实验室所保存. IPSC由德国肿瘤中心分子胃肠实验室提供. 细胞培养所需之培养基、胎牛血清(fetal bovine serum, FBS)、胰酶等均为Gibco公司产品. MTT, 纤维粘连蛋白(fibronectin, FN), 牛血清白蛋白(bovine serum albumin, BSA), 人工重组基底膜为Sigma产品.
1.2.1 细胞培养及IPSC上清制备: 胰腺癌细胞株Patu8988培养在含100 mL/L胎牛血清的DMEM高糖培养基, 在37 ℃, 50 mL/L CO2的条件下培养, 细胞长满单层后用2.5 g/L胰蛋白酶消化传代. IPSC以含100 mL/L FBS的DMEM培养基培养至80%满度, 换成无血清的DMEM培养基继续培养48 h, 收集培养基, 以1 000 g离心10 min, 收集上清, -80 ℃冻存待用.
1.2.2 MTT法检测Patu8988的增殖能力: 收集对数期细胞, Patu8988细胞调整浓度至1×108/L, 以含100 mL/L FBS的DMEM培养基接种于96孔板中, 每孔200 μL, 培养至约70%满度, 换成无血清的DMEM培养基培养18 h, 移除培养基, 实验组加入上述制备的200 μL IPSC上清, 分别继续培养24、48、72 h, 对照组用无血清培养基分别继续培养24, 48, 72 h. 到时间点后, 吸去上清, 加入MTT, 4 h后吸去MTT, 加入DMSO, 放置摇床上低速振荡, 使结晶充分溶解, 在酶联免疫检测仪A490处测量各孔的A值.
1.2.3 MTT法检测Patu8988的黏附能力: 先用FN包被96孔板过夜. 第2天吸出培养板中的残余FN液体, 每孔加入不含BSA的无血清培养液, 37 ℃孵育30 min. 然后收集对数期Patu8988细胞, 浓度为1×108/L, 每孔200 μL, 接种于上述制备好的96孔板中, 培养至约70%满度, 换成无血清的DMEM培养基培养18 h, 移除培养基, 于实验组加入上述制备的200 μL IPSC上清, 分别继续培养24、48、72 h, 对照孔为用无血清培养液分别继续培养24、48、72 h. 到时间点后, 用PBS洗去未黏附的细胞, 加入MTT, 4 h后吸去MTT, 加入DMSO, 放置摇床上低速振荡, 使结晶充分溶解, 在酶联免疫检测仪A490处测量各孔的A值.
1.2.4 人工重组基底膜胶侵袭试验测Patu8988的侵袭能力: 先用FN包被6孔板过夜. 将人工重组基底膜铺在Transwell膜上, 37 ℃包被聚合1 h. 吸出培养板中的残余液体, 加入含BSA的无血清培养液, 37 ℃, 30 min. 在Transwell上室加入Patu8988, 实验组下室加入2 mL IPSC上清, 对照组为下室加入2 mL的无血清培养液. 分别培养24、48、72 h, 到时间点后, 用湿棉签搽去上室的附着细胞, 950 mL/L乙醇固定, 苏木精染色, 封片后200倍显微镜下随机计数5个视野下穿过微孔膜的总细胞数.
1.2.5 软琼脂克隆形成实验检测Patu8988的克隆形成能力: 取对数生长期细胞, 用胰蛋白酶消化并轻轻吹打, 使之成为单细胞, 作细胞计数, 用含100 mL/L FBS的DMEM培养基调整细胞密度至1×108/L; 用生理盐水分别制备出1.4%低熔点琼脂液, 高压灭菌后, 按1:1比例使8 mL的1.4%的低熔点琼脂和8 mL的含100 mL/LFBS的DMEM培养液混合, 制配成16 mL的0.7%的低熔点琼脂. 取一六孔板, 每孔中加入2 mL制备好的0.7%的低熔点琼脂, 作底层琼脂, 冷却凝固, 置孵箱中备用; 按1:3比例分别取2 mL 1.4%的低熔点琼脂糖和6 mL含200 mL/L FBS的DMEM培养基在无菌试管中相混以后, 再向管中加入40 μL备好的Patu8988细胞悬液, 迅速地充分混匀, 按2 mL/孔将混合液注入凝固好的底层铺有0.7%低熔点琼脂糖的六孔板一侧的三个孔中; 迅速按照同样的方法在另一侧的三孔中加入对照细胞, 形成双琼脂层. 待上层琼脂凝固后, 置入孵箱中培养; 待出现肉眼可见白色的细胞克隆计数, 计算克隆形成率, 克隆形成率 = 克隆数/接种细胞数×100%.
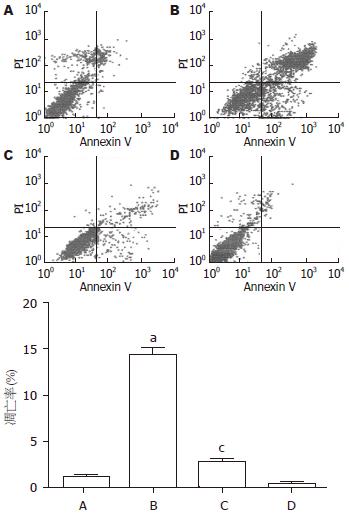
1.2.6 Annexin V/PI双染色法检测H2O2诱导的Patu8988的凋亡: 取对数生长期细胞, 用胰蛋白酶消化并轻轻吹打, 使之成为单细胞, 作活细胞计数, 传代于6个25 mL的培养瓶中. 培养至70%-80%满. 分别编号, 分A、B、C、D组, C、D组先用IPSC上清培养12 h, A、B两组用无血清的DMEM培养. 12 h后, B、C组加入1 mL、0.5 mmol/L的H2O2, 干预12 h. 12 h后消化, 离心, 加入PBS后吹开, 再离心, 倒出PBS, 加入缓冲液吹匀后, 加Annexin V/PI各5 μL, 15 min后, 应用流式细胞仪计数以计算凋亡细胞数和凋亡的变化.
统计学处理 实验数据统计分析采用GraphPad Prism 4.0软件包分析, 实验数据采用mean±SD, 组间比较用t检验, P<0.05有统计学意义.
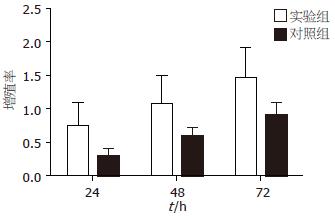
各个时间点用IPSC上清培养的胰腺癌细胞株Patu8988与对照组Patu8988细胞的增殖率有显著差异, 实验组与对照组24、48、72 h的增殖率比较分别为1.0939±0.3700 vs 0.3001±0.1772(P<0.05), 1.4296±0.3793 vs 0.6000±0.2079(P<0.05), 1.8214±0.4187 vs 0.9102±0.3286(P<0.05). 并随着干预时间的延长, Patu8988细胞的增殖能力也随之增强, 用IPSC上清培养48 h的实验组细胞与24 h的实验组细胞的增殖率有显著差异(1.4296±0.3793 vs 1.0939±0.3700, P<0.05), 用IPSC上清培养72 h的实验组细胞与48 h的实验组细胞的增殖率亦有显著差异(1.8214±0.4187 vs 1.4296±0.3793, P<0.05, 图1).
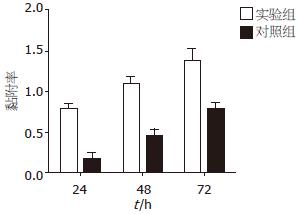
各个时间点用IPSC上清培养的胰腺癌细胞株Patu8988与对照组Patu8988细胞的黏附率有显著差异, 实验组与对照组24、48、72 h的黏附率比较分别为0.7728±0.1145 vs 0.1793±0.1063(P<0.05), 1.0969±0.1321 vs 0.4532±0.1266(P<0.05), 1.3840±0.2266 vs 0.7847±0.1090(P<0.05). 并随着干预时间的延长, Patu8988细胞的黏附能力也随之增强, 用IPSC上清培养48 h的实验组细胞与24 h的实验组细胞的黏附率有显著差异(1.0969±0.1321 vs 0.7728±0.1145, P<0.05), 用IPSC上清培养72 h的实验组细胞与48 h的实验组细胞的黏附率亦有显著差异(1.3840±0.2266 vs 1.0969±0.1321, P<0.05, 图2).
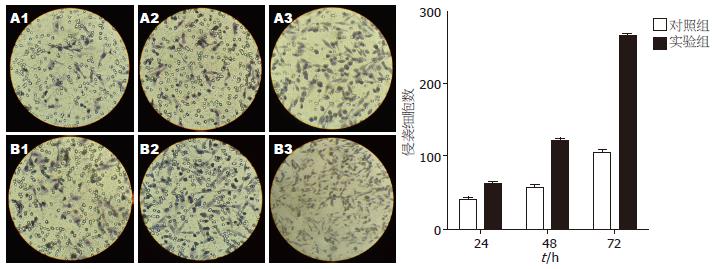
各个时间点用IPSC上清培养的胰腺癌细胞株Patu8988与对照组Patu8988细胞的侵袭能力有显著差异, 实验组与对照组24、48、72 h的侵袭细胞数比较分别为62.6667±3.5119 vs 39.6667±5.5076(P<0.05), 121.3333±5.1316 vs 57.0000±5.2915(P<0.05), 266.3333±4.16333 vs 106.6667±03.5119(P<0.05). 并随着干预时间的延长, Patu8988细胞的侵袭能力也随之增强, 用IPSC上清培养48 h的实验组细胞与24 h的实验组细胞的侵袭细胞数有显著差异(121.3333±5.1316 vs 62.6667±3.5119, P<0.05), 用IPSC上清培养72 h的实验组细胞与48 h的实验组细胞的侵袭细胞数亦有显著差异(266.3333±4.16333 vs 121.3333±5.1316, P<0.05, 图3).
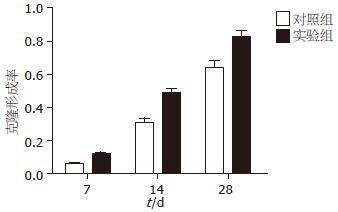
各个时间点用IPSC上清培养的胰腺癌细胞株Patu8988与对照组Patu8988细胞的克隆形成能力有显著差异, 实验组与对照组24、48、72 h的克隆形成率比较分别为0.1167±0.0071 vs 0.0530±0.0050(P<0.05), 0.4833±0.0451 vs 0.3033±0.0416(P<0.05), 0.8233±0.0603 vs 0.6400±0.0656(P<0.05). 并随着干预时间的延长, Patu8988细胞的克隆形成能力也随之增强, 用IPSC上清培养48 h的实验组细胞与24 h的实验组细胞的克隆形成率有显著差异(0.4833±0.0451 vs 0.1167±0.0071, P<0.05), 用IPSC上清培养72 h的实验组细胞与48 h的实验组细胞的克隆形成率亦有显著差异(0.8233±0.0603 vs 0.4833±0.0451, P<0.05, 图4).
H2O2能诱导胰腺癌细胞株Patu8988的凋亡(P<0.05), 而IPSC上清能抑制H2O2诱导的Patu8988的凋亡(P<0.05, 图5).
在正常的胰腺组织中, PSC呈静止状态, 胞内富含Vit A脂滴和油脂酸视黄醇, 具有摄取和酯化视黄醇的能力, 结蛋白(desmin)和神经胶质原酸性纤维蛋白(glial fibrillary acidic protein, GFAP)染色阳性. 当胰腺受损后, PSC产生细胞活化现象. PSC发生了形态学和功能学的双重变化, 表现为: 细胞体积变大, 增殖活跃; 脂质减少或丢失; α-平滑肌蛋白(α-smooth muscle actin, α-SMA)表达阳性; 对细胞因子如血小板源生长因子(platelet-derived growth factor, PDGF)、转化生长因子-β(transforming growth factor-β, TGF-β)反应性增加; 分泌ECM, 尤其是Ⅰ、Ⅲ型胶原[4,5]. Yen等[6]研究证明, 在胰腺癌中发现大量SMA阳性的胰腺星状细胞位于胰腺癌周围. Apet等[7]研究发现胰腺癌中的胰腺星状细胞desmin、SMA、GFAP染色阳性. 提示胰腺癌中存在胰腺星状细胞, 在胰腺癌的病理发展过程中可能起一定的作用.
虽然目前已有研究发现胰腺癌的发展和转移伴随着PSC的活化, 但PSC的活化能否反过来作用于胰腺癌细胞, 并对胰腺癌的侵袭和转移起促进作用目前还不清楚. Bachem等[8]通过体外实验发现, 与只注入胰腺癌细胞所形成的肿瘤比较, 同时注入癌细胞和PSC所形成的肿瘤与人类体内胰腺癌组织结构更为相似, 并且具有更快的生长速度和更大的体积. Vonlaufen等[9]发现PSC通过分泌PDGF促进胰腺癌细胞增殖. Bachem等[10]发现, 胰腺癌细胞表达的EMMPRIN可以促进PSC合成MMP, 他可降解ECM, 破坏基底膜的完整性, 有利于肿瘤的侵袭和转移. 有研究发现, SW1990可表达半乳糖凝集-3(GAL-3), 并且在与PSC培养上清液作共培养时, GAL-3表达增多. PSC并不表达GAL-3, 但可以与GAL-3共同作用来促进胰腺癌细胞的增殖和侵袭[11].
本研究将肿瘤基质细胞与恶性肿瘤的发展和转移联系起来, 研究PSC对胰腺癌侵袭和转移的作用. 由于原代培养的PSC最大的缺点是传代次数少、传代后功能状态不稳定, 会影响实试验结果的一致性和可重复性, 因此, 本研究不采用原代PSC, 而从德国肿瘤研究中心(DKFZ)Ralf Jesnowski教授的实验室获得IPSC[12], 解决了原代培养细胞影响实验结果的问题. 该IPSC已被证实具有稳定的传代功能, 并保持原代PSC的基本性状. 本研究结果发现, 与IPSC上清共培养后, 胰腺癌细胞株Patu8988的增殖、黏附能力明显增加, 迁移和侵袭能力明显增强, 并都具有时间依赖性; 本研究还检测了IPSC对胰腺癌细胞株Patu8988的凋亡的影响, 结果表明, 与IPSC上清共培养后, H2O2诱导的Patu8988的凋亡明显受到抑制. 本研究结果说明, IPSC能促进胰腺癌Patu8988的增殖、黏附和侵袭能力, 并抑制其凋亡, 初步证明了PSC可能在胰腺癌的发展和转移中起着促进作用. 本研究将做进一步的深入研究, 以发现其中关键的分子机制, 从而从肿瘤-间质细胞的相互关系这一新的角度来阐明胰腺癌发展和转移的原因.
本实验成功的初步验证了IPSC上清能促进胰腺癌Patu8988的增殖、黏附和侵袭能力, 抑制H2O2诱导的Patu8988的凋亡. PSC在胰腺癌的发展和转移中起重要作用. 在胰腺癌中, 如能致力于其基质细胞PSC的研究, 可能会对胰腺癌的治疗带来突破.
胰腺癌是一种恶性程度极高的消化系肿瘤, 预后极差. 其癌周组织纤维化明显, 而活化的胰腺星状细胞(PSC)在其中起重要作用. 研究PSC在发展和转移中的作用可能会为胰腺癌的治疗提供新的治疗思路.
陈光, 教授, 吉林大学第一医院消化器官外科.
胰腺癌细胞促使PSC的活化并形成癌周纤维化组织, 研究PSC的活化机制及其对胰腺癌细胞的作用, 已成为研究胰腺癌及癌周基质之间关系的一个热点.
本研究初步验证IPSC能促进胰腺癌细胞株Puta8988的增殖、黏附、迁移和侵袭, 并能抑制Puta8988的凋亡, 从而证实PSC可能在胰腺癌的发展和转移中起重要作用, 可能为胰腺癌的治疗带来突破.
PSC: 胰腺基质中分离出的能产生Ⅰ、Ⅲ型胶原、纤维粘连蛋白和成粘连蛋白等细胞外基质的细胞; 在正常的胰腺组织中呈静止状态, 当胰腺受损后, 发生细胞活化现象并发挥作用.
本研究立题新颖, 手段先进, 所得结果客观, 对胰腺癌的进一步深入研究有重大意义.
编辑: 李军亮 电编:吴鹏朕
| 1. | Jemal A, Siegel R, Ward E, Murray T, Xu J, Thun MJ. Cancer statistics, 2007. CA Cancer J Clin. 2007;57:43-66. [PubMed] [DOI] |
| 2. | Brand RE, Tempero MA. Pancreatic cancer. Curr Opin Oncol. 1998;10:362-366. [PubMed] [DOI] |
| 3. | Warshaw AL, Fernández-del Castillo C. Pancreatic carcinoma. N Engl J Med. 1992;326:455-465. [PubMed] |
| 4. | Bachem MG, Zhou S, Buck K, Schneiderhan W, Siech M. Pancreatic stellate cells--role in pancreas cancer. Langenbecks Arch Surg. 2008;393:891-900. [PubMed] |
| 5. | Luttenberger T, Schmid-Kotsas A, Menke A, Siech M, Beger H, Adler G, Grünert A, Bachem MG. Platelet-derived growth factors stimulate proliferation and extracellular matrix synthesis of pancreatic stellate cells: implications in pathogenesis of pancreas fibrosis. Lab Invest. 2000;80:47-55. [PubMed] [DOI] |
| 6. | Yen TW, Aardal NP, Bronner MP, Thorning DR, Savard CE, Lee SP, Bell RH Jr. Myofibroblasts are responsible for the desmoplastic reaction surrounding human pancreatic carcinomas. Surgery. 2002;131:129-134. [PubMed] [DOI] |
| 7. | Apte MV, Park S, Phillips PA, Santucci N, Goldstein D, Kumar RK, Ramm GA, Buchler M, Friess H, McCarroll JA. Desmoplastic reaction in pancreatic cancer: role of pancreatic stellate cells. Pancreas. 2004;29:179-187. [PubMed] [DOI] |
| 8. | Bachem MG, Schünemann M, Ramadani M, Siech M, Beger H, Buck A, Zhou S, Schmid-Kotsas A, Adler G. Pancreatic carcinoma cells induce fibrosis by stimulating proliferation and matrix synthesis of stellate cells. Gastroenterology. 2005;128:907-921. [PubMed] [DOI] |
| 9. | Vonlaufen A, Joshi S, Qu C, Phillips PA, Xu Z, Parker NR, Toi CS, Pirola RC, Wilson JS, Goldstein D. Pancreatic stellate cells: partners in crime with pancreatic cancer cells. Cancer Res. 2008;68:2085-2093. [PubMed] [DOI] |
| 10. | Bachem MG, Zhou S, Buck K, Schneiderhan W, Siech M. Pancreatic stellate cells--role in pancreas cancer. Langenbecks Arch Surg. 2008;393:891-900. [PubMed] [DOI] |
| 11. | Jiang HB, Xu M, Wang XP. Pancreatic stellate cells promote proliferation and invasiveness of human pancreatic cancer cells via galectin-3. World J Gastroenterol. 2008;14:2023-2028. [PubMed] [DOI] |
| 12. | Jesnowski R, Fürst D, Ringel J, Chen Y, Schrödel A, Kleeff J, Kolb A, Schareck WD, Löhr M. Immortalization of pancreatic stellate cells as an in vitro model of pancreatic fibrosis: deactivation is induced by matrigel and N-acetylcysteine. Lab Invest. 2005;85:1276-1291. [PubMed] [DOI] |