修回日期: 2009-12-09
接受日期: 2009-12-14
在线出版日期: 2010-01-28
目的: 复制大鼠乙醇及四氯化碳(CCl4)致慢性肝损伤模型, 观察氧应激反应在其发生中的作用.
方法: 50只, ♂Wistar大鼠平均分为A-E 5组, 实验持续8 wk. A组生理盐水灌胃; B组乙醇灌胃(560 mL/L); C组在B组基础上同时PGE1腹腔内注射; D组乙醇(560 mL/L)灌胃4 wk, 然后CCl4腹腔注射4 wk. E组在D组基础上同时PGE1腹腔内注射. 实验4、8 wk结束时分别检测全血GSH-Px, 血清ALT、AST、ALP、TBA、TG、CHO、MDA. 8 wk结束时处死动物, 留取肝脏标本, 行光镜及电镜检查.
结果: 5组大鼠的原始体质量在统计学上无显著性差异, 实验结束时, 与A组相比, B组和D组的最终体质量和增加体质量明显降低(249.00 g±18.83 g, 258.50 g±20.28 g vs 319.00 g±29.61 g; 65.00 g±15.28 g, 76.50 g±15.82 g vs 134.00 g±21.58 g, 均P<0.01), 肝质量占体质量百分比明显增高(3.267%±0.3165%, 4.735%±0.7567% vs 2.736%±0.1988%, 均P<0.01), 相应PGE1干预后(C组和E组), 大鼠的生长缓慢、肝脏肿大情况得到明显改善(均P<0.01); B组和D组血清中的ALT、AST、ALP、TBA、TG和CHO含量发生不同程度的升高(P<0.01或0.05), PGE1干预后增高水平明显下降; 乙醇和CCl4能引起外周血GSH-Px降低和MDA升高(均P<0.01), PGE1干预后能够得到明显改善, 而PGE1的干预则可明显减轻乙醇和CCl4引起的肝脏病理学改变.
结论: 氧应激反应可能在大鼠乙醇及CCl4致慢性肝损伤过程中发挥重要作用, 抑制氧应激反应可能是缓解肝损伤的重要措施.
引文著录: 房龙, 杜时雨, 赵洪川, 姚树坤. 氧应激在大鼠乙醇及四氯化碳致慢性肝损伤中的作用. 世界华人消化杂志 2010; 18(3): 234-239
Revised: December 9, 2009
Accepted: December 14, 2009
Published online: January 28, 2010
AIM: To investigate the role of oxidative stress reaction in the pathogenesis of chronic hepatic injury induced by alcohol and carbon tetrachloride (CCl4) in rats.
METHODS: Fifty male Wistar rats were divided equally into five groups: A, B, C, D and E. The experiment was continued for 8 weeks in each group. Groups A and B were perfused intragastrically with normal saline and alcohol, respectively. Group C was treated as group B and additionally injected intraperitoneally with prostaglandin E1 (PGE1). Group D was perfused intragastrically with alcohol for 4 weeks and injected intraperitoneally with CCl4 for another 4 weeks. Group E was treated as group D and additionally injected intraperitoneally with PGE1. At weeks 4 and 8, serum ALT, AST, ALP, TBA, TG, CHO, GSH-Px, and MDA were determined. At week 8, all rats were executed to take hepatic tissue specimens for observation of histopathological alterations.
RESULTS: No significant differences were found in the original body weight (BW) among the five groups before the treatment. Compared with group A, at week 8, the BW and increased BW significantly decreased (249.00 g ± 18.83 g and 258.50 g ± 20.28 g vs 319.00 g ± 29.61 g; 65.00 g ± 15.28 g and 76.50 g ± 15.82 g vs 134.00 g ± 21.58 g, respectively; all P < 0.01), and the liver mass (expressed as the percentage of total BW) significantly increased (3.267% ± 0.3165% and 4.735% ± 0.7567% vs 2.736% ± 0.1988%, respectively; both P < 0.01) in groups B and D. After pre-treatment with PGE1 (groups C and E), the decrease in body weight and the increase in liver mass were improved (all P < 0.01). Alcohol and CCl4 (groups B and D) elevated serum ALT, AST, ALP, TBA, TG, CHO and MDA levels (all P < 0.01 or 0.05), and reduced serum GSH-Px levels (both P < 0.01). After intervention with PGE1, these parameters were improved. In addition, PGE1 pre-treatment could mitigate hepatocyte fatty degeneration, cellular necrosis, inflammatory infiltration and liver fibrosis induced by alcohol and CCl4.
CONCLUSION: Oxidative stress may play an important role during chronic liver injury induced by alcohol and CCl4. Inhibition of oxidative stress may be an important measure for alleviating liver injury.
- Citation: Fang L, Du SY, Zhao HC, Yao SK. Role of oxidative stress in the pathogenesis of chronic hepatic injury induced by ethanol and carbon tetrachloride in rats. Shijie Huaren Xiaohua Zazhi 2010; 18(3): 234-239
- URL: https://www.wjgnet.com/1009-3079/full/v18/i3/234.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i3.234
酒精引起肝脏损害的机制非常复杂, 涉及内毒素、炎症介质、细胞因子以及免疫调节等多方面因素, 其中氧应激的作用日益受到重视. 以往动物实验已经证实氧应激反应在乙醇引起的急性肝损害中起到重要作用[1]. 本研究进一步探讨该反应在乙醇及CCl4所致慢性肝损害的作用.
50只♂Wistar大鼠, 体质量170-200 g, 购自中国医学科学院实验动物中心, 为二级清洁动物; 高脂低蛋白饮食(玉米面50%、花生油20%、矿物质及维生素5%, 鱼粉、豆粉、高粱粉各25%); 饮用自来水; 560 mL/L乙醇, CCl4, Lipo-PGE1 10 μg/2 mL(北京泰德制药有限公司提供).
1.2.1 分组: 大鼠平均分为5组: A组: 生理盐水灌胃每次10 mL/kg, 每日2次, 共8 wk; B组: 乙醇灌胃每次10 mL/kg, 每日2次, 共8 wk; C组: 在B组基础上预先PGE1腹腔内注射每次5 μg/kg, 每日1次, 共8 wk; D组: 前4 wk乙醇灌胃每次10 mL/kg, 每日2次, 后4 wk CCl4腹腔内注射每次0.125 mL/kg, 每周3次; E组: 在D组基础上预先PGE1腹腔内注射每次5 μg/kg, 每日1次, 共8 wk.
1.2.2 体质量检测: 第1天为原始体质量、处死动物前为最终体质量, 两者之差为增加体质量.
1.2.3 血液检查: 第29天(4 wk末)、57天(8 wk末)禁食14 h后, 内眦取血2 mL, 检测全血谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)、血清丙二醛(malondialdehyde, MDA)、丙氨酸氨基转移酶(alanine aminotransferase, ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase, AST)、碱性磷酸酶(alkaline phosphatase, ALP)、总胆汁酸(total bile acid, TBA)、甘油三酯(triglycerides, TG)、总胆固醇(cholesterol, CHO).
1.2.4 病理学检测: 第57天(8 wk末)处死动物, 称肝脏质量, 计算其占体质量百分比. 100 g/L甲醛固定肝组织, HE、Masson染色, 行光镜检查; 25 g/L戊二醛固定肝组织, 行电镜检查.
对各组肝细胞脂肪变性、炎症坏死、纤维化分级计分: (1)脂肪变性: 无(-); 偶见(-+); 散在(+); 弥漫性病变, <33%(++); 弥漫性病变, 33%-66%(+++); 弥漫性病变, >66%(++++); (2)肝小叶内炎症、坏死: 无(-); 偶见(-+); 散在小坏死灶(+); 时见坏死灶(++); 大坏死灶, 弥漫存在于肝小叶(+++); 桥接坏死(++++); (3)纤维化: 无(-); 少数中央静脉间有纤维隔形成(+); 多个中央静脉间有纤维隔形成, 但尚未连接成环(++); 中央静脉间纤维隔相连成环形, 汇管区位于其中央(+++); 中央静脉间纤维隔相连成环形, 汇管区位于其中央, 中央静脉和汇管区之间出现纤维隔(++++). 主要病变程度计分标准: (-)0分; (-+)1分; (+)3分; (++)6分; (+++)9分; (++++)12分, 可介于两者之间.
统计学处理 采用SPSS10.0软件. 血液检查行t检验, 结果以mean±SD表示; 病理学检测行秩和检验. 以P<0.05为差异有显著性.
乙醇、CCl4复制慢性肝损伤模型, 大鼠生长变得缓慢. C组和E组为PGE1干预组, 分别与B组和D组相比, 最终体质量和增加体质量明显增加(均P<0.01), 提示经过PGE1干预后, 大鼠的生长缓慢情况得到明显改善. 肝质量占体质量百分比反映肝脏的相对质量情况, B组和D组的比值均明显高于对照组(均P<0.01)和PGE1干预组(均P<0.01, 表1).
| 分组 | 原始体质量(g) | 最终体质量(g) | 增加体质量(g) | 肝脏质量(g) | 肝脏质量/体质量(×10-2) |
| A组 | 185.00±12.02 | 319.00±29.61 | 134.00±21.58 | 8.750±1.208 | 2.736±0.1988 |
| B组 | 184.00±9.07 | 249.00±18.83bd | 65.00±15.28bd | 8.100±0.568 | 3.267±0.3165bd |
| C组 | 178.00±10.33 | 299.50±25.87 | 121.50±20.69 | 8.100±1.150 | 2.700±0.2305 |
| D组 | 182.00±6.75 | 258.50±20.28bf | 76.50±15.82bf | 12.300±2.552bf | 4.735±0.7567bf |
| E组 | 184.00±8.76 | 284.50±23.15 | 100.50±18.33 | 8.050±0.550 | 2.838±0.1714 |
以8 wk末为例, 与A组相比, B组和D组的ALT和AST均发生明显升高(均P<0.01); 经过PGE1干预后(C组和E组), ALT和AST均发生明显改善(均P<0.01). 结果提示, 乙醇、CCl4引起肝细胞损伤, 造成ALT和AST明显升高, PGE1可明显改善其变化. 而对ALP而言, 尽管B组和D组与对照组相比也发生了明显升高(P<0.05和0.01), 但是经过PGE1干预后, B组的改善并不明显(P>0.05), D组的ALP水平发生明显改善(P<0.01). TBA的变化情况与上述两种情况稍有不同, 经过乙醇和CCl4处理后(B组和D组)水平增高(均P<0.05), PGE1干预后均能得到明显改善(P<0.05或0.01), 但统计学差异程度有所不同(表2).
| A组 | B组 | C组 | D组 | E组 | |
| ALT(IU/L) | |||||
| 4 wk末 | 54.60±25.26 | 69.20±17.32c | 54.40±8.02 | 81.30±21.67af | 55.80±9.28 |
| 8 wk末 | 43.80±6.29 | 91.50±26.36bd | 45.60±5.64 | 824.70±543.54bf | 52.60±11.87 |
| AST(IU/L) | |||||
| 4 wk末 | 127.80±37.02 | 163.90±31.07ac | 138.60±29.26 | 218.30±66.43be | 159.20±31.79 |
| 8 wk末 | 118.70±22.06 | 198.80±39.38bd | 114.90±22.73 | 706.50±454.02bf | 124.30±19.01 |
| ALP(IU/L) | |||||
| 4 wk末 | 83.90±11.10 | 180.90±51.20bd | 95.70±25.86 | 178.70±98.58be | 87.90±20.52 |
| 8 wk末 | 57.40±4.93 | 96.80±49.03a | 72.70±10.08 | 242.30±62.17bf | 81.00±18.49 |
| TBA(μmol/L) | |||||
| 4 wk末 | 38.59±25.11 | 30.78±23.23 | 49.80±39.10 | 35.740±15.18 | 29.01±15.93 |
| 8 wk末 | 25.94±11.10 | 50.07±30.91ad | 19.15±10.04 | 89.140±76.76ae | 24.67±12.06 |
B组8 wk末CHO和TG均发生明显升高(P<0.01和0.05), 经过PGE1干预后(C组), 增高的水平发生明显改善(P<0.01和0.05). D组CHO仅在8 wk末时增高(P<0.05), PGE1干预后(E组)效果不明显(P>0.05); TG反而仅在4 wk末发生增高(P<0.05), 8 wk末与对照组相比无统计学意义(P>0.05), 前者在PGE1干预后(E组)水平下降(P<0.01, 表3).
| A组 | B组 | C组 | D组 | E组 | |
| CHO(mg/dL) | |||||
| 4 wk末 | 76.60±8.55 | 86.50±18.07 | 79.50±9.69 | 71.70±12.53 | 73.10±10.44 |
| 8 wk末 | 59.00±5.75 | 86.60±14.87bd | 67.20±10.60 | 83.00±27.71a | 75.70±12.00 |
| TG(mg/dL) | |||||
| 4 wk末 | 40.00±14.04 | 78.80±31.12bd | 33.70±11.61 | 54.20±15.16af | 32.10±12.29 |
| 8 wk末 | 42.60±20.87 | 94.50±67.20ac | 46.50±25.40 | 29.00±15.46 | 37.10±21.08 |
| GSH-Px(活力单位/(min·mL) | |||||
| 4 wk末 | 66.71±5.64 | 56.98±4.39b | 62.21±6.95 | 59.86±7.19a | 64.06±5.70 |
| 8 wk末 | 68.45±5.35 | 52.02±5.21bc | 57.60±5.77 | 44.85±5.20be | 51.28±4.98 |
| MDA(μmol/L) | |||||
| 4 wk末 | 7.12±1.92 | 10.37±2.03bd | 8.12±1.10 | 10.41±2.04be | 8.44±1.43 |
| 8 wk末 | 7.04±2.29 | 12.88±2.51bd | 9.48±1.91 | 15.17±2.25be | 12.35±2.11 |
乙醇、CCl4能引起外周血GSH-Px降低和MDA升高(均P<0.01), PGE1有抗氧应激反应的作用(表3).
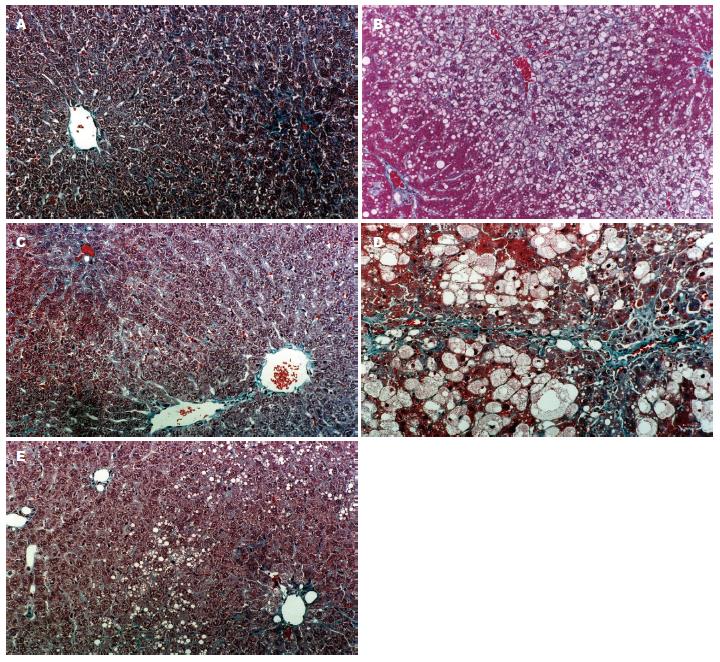
A组: 肝细胞放射状围绕中央静脉排列, 小叶间纤维组织较少, 汇管区未见异常; B组: 肝细胞脂肪变性包括大泡性脂变和小泡性脂变. 本组以小泡性脂变为主, 围绕中央静脉分布, 至汇管区渐轻; 散在大泡性脂变. 电镜下线粒体肿胀变形, 线粒体嵴排列紊乱. 肝小叶内偶见点状或小灶状坏死. 汇管区多较正常或仅有少量炎细胞浸润; C组: 较B组明显减轻; D组: 病变呈明显条带状分布. (1)肝腺泡Ⅲ区: 不同程度肝细胞坏死, 散在小泡性脂变; (2)肝腺泡Ⅱ区: 小泡性脂变肝细胞较B组明显膨胀, 细胞核浓缩于细胞中央, 胞质内可见均匀分布的红色颗粒, 称为嗜酸颗粒样变性, 电镜证实为增生的线粒体; 散在大泡性脂变; (3)肝腺泡Ⅰ区: 少量炎性细胞浸润, 散在大泡性脂变. 另外可见纤维化表现. E组: 较D组显著减轻(图1).
我们分别按照肝脏内大泡性脂变、小泡性脂变、肝小叶内炎症及坏死和肝脏纤维化4种病理变化来统计各组的变化. A组以上4种变化均未出现(阳性率均为0%); B组出现以上4种病理改变(含可疑阳性)的例数分别为10例(100%)、10例(100%)、8例(80%)和0例(0%); C组分别为2例(20%)、0例(0%)、0例(0%)和0例(0%); D组分别为10例(100%)、10例(100%)、10例(100%)和10例(100%); E组分别为10例(100%)、2例(20%)、5例(50%)和10例(100%). 阳性病例中病变程度有所不同. 除B组未出现肝脏纤维化外, 其他各种改变, B组和C组相比, D组和E组相比, 进行秩和检验, 统计学上均有显著性差异(均P<0.01, 表4).
长期饮酒可引起酒精性肝病, 其机制非常复杂. 研究发现氧应激和膜磷脂过氧化在酒精性肝病的发生、发展中起重要作用. 乙醇在肝细胞内通过细胞色素P4502E1(CYP2E1)、并在铁离子参与下发生氧化反应, 产生氧应激产物, 如OH-、O2-等自由基. 这些自由基可激活磷脂酶及脂质过氧化反应, 降解膜磷脂, 改变细胞膜通透性和流动性, 改变与细胞膜结合的酶、受体和离子通道的微环境, 影响其功能. 此外脂质过氧化还影响DNA和蛋白质的结构和功能. 肝脏CYP2E1在中央静脉周围肝细胞内呈高表达, 此处氧应激反应最活跃, 因此是酒精性肝损伤的好发部位. 从某种角度上讲, 氧应激反应是机体正常生理过程, 但过度的氧应激却可以造成肝脏组织损伤[2,3]. GSH-Px催化还原型谷胱甘肽对氢过氧化物的还原反应、阻断脂质过氧化, 是细胞内抗氧应激反应的酶性保护系统的主要成分, 可以反映出机体对氧应激拮抗能力的高低[4]. MDA是氧自由基与生物膜多不饱和脂肪酸发生氧化应激的产物, 他产生的量与氧自由基的量相平行, 亦与氧应激的程度相平行, 故检测MDA同时可反映氧自由基的水平及氧应激反应的程度[4].
本研究中B组与A组比较, 实验4 wk结束时即出现肝功能受损, 实验8 wk结束时B组大鼠呈现严重的肝细胞脂肪变性. D组在乙醇灌胃4 wk形成肝损伤基础上, 加入CCl4使动物肝脏受到进一步打击, 形成肝纤维化, 与其他研究相似[5], 因此本实验成功复制了乙醇及CCl4致慢性肝损伤大鼠模型. B组和D组大鼠与A组比较, 实验4、8 wk结束时, GSH-Px明显降低、MDA明显升高, 说明氧应激在乙醇及CCl4致慢性肝损伤中发挥了重要作用.
PGE1对大鼠乙醇及CCl4致慢性肝损伤有防治作用, 其可能的机制包括: 第一, 稳定肝细胞膜、线粒体膜、溶酶体膜: PGE1可显著改善感染、毒性物质及缺血缺氧等引起的ALT、AST、LDH升高, 说明PGE1有稳定质膜作用: (1)抗脂质过氧化: 本实验发现PGE1可缓解乙醇中毒后下降的GSH-Px和升高的MDA, 与其他研究结果相符[6,7]; (2)改善细胞膜流动性[8]; (3)激活腺苷酸环化酶, 引起肝细胞内cAMP水平升高, 后者抑制磷脂酶A2活性, 从而稳定质膜, 防止细胞坏死[9]. 第二, 改善肝脏微循环: (1)作用于血管平滑肌, 缓解小血管痉挛; (2)减弱血小板凝集和释放反应, 防止血管内凝血; (3)调节前列环素与血栓素A2
平衡[10]; (4)调节肝星状细胞收缩, 增加肝窦血流量[11]; (5)下调内皮细胞表达细胞间黏附分子1, 减少白细胞与内皮细胞黏附[12], 减轻肝脏微循环障碍[13]. 第三, 促进肝细胞再生: 研究发现[14], PGE1以自分泌的方式促进肝细胞增生. 机制包括: (1)提高肝细胞内cAMP水平, 促进DNA合成及有丝分裂[15]; (2)通过蛋白激酶系统解除细胞核内组蛋白对DNA合成的阻遏[16]. 第四, 抑制肝脏纤维化的发生, 机制为: (1)降低多种基质蛋白和成纤维细胞因子基因表达, 抑制炎症反应和纤维化; (2)增加细胞内cAMP水平, 使新合成的胶原在分泌前降解增加, 降低胶原含量[17]; (3)降低细胞间黏附分子表达, 减弱细胞间相互作用[18].
本研究中与B组、D组相对应, C组、E组均给予PGE1干预. 在实验4、8 wk结束时肝功能改善显著, GSH-Px明显升高、MDA明显降低, 肝脏病理改变也明显减轻. 说明PGE1通过抑制氧应激反应及其他机制可明显减轻乙醇及CCl4致慢性肝损伤.
总之, 本研究成功复制了大鼠乙醇及CCl4致慢性肝损伤动物模型, 同时证实了氧应激反应在肝损伤过程中可能具有重要作用, 抑制氧应激反应可能是延缓肝损伤的重要措施.
乙醇引起肝脏损害的机制非常复杂, 涉及内毒素、炎症介质、细胞因子以及免疫调节等多方面因素, 其中氧应激的作用日益受到重视.
陈积圣, 教授, 中山大学孙逸仙纪念医院肝胆外科.
有研究证实, 乙醇在肝细胞内通过细胞色素P4502E1、并在铁离子参与下发生氧化反应, 产生氧应激产物, 如OH-、O2-等自由基. 这些自由基可激活磷脂酶及脂质过氧化反应, 降解膜磷脂, 改变细胞膜通透性和流动性, 改变与细胞膜结合的酶、受体和离子通道的微环境, 影响其功能.
本研究成功复制了大鼠乙醇、CCl4致慢性肝损伤动物模型, 同时探讨了氧应激反应在肝损伤过程中的作用.
本研究证实, 氧应激反应在肝损伤过程中具有重要作用, 抑制氧应激反应可能是缓解肝损伤的重要措施.
本文选题先进, 设计合理, 有一定的科学性和可读性.
编辑: 李军亮 电编:吴鹏朕
| 1. | 杜 时雨, 房 龙, 赵 洪川, 王 泰龄. 脂质过氧化反应在大鼠急性酒精性肝损害中的作用. 胃肠病学和肝病学杂志. 2008;17:600-603. |
| 2. | Hoek JB, Pastorino JG. Ethanol, oxidative stress, and cytokine-induced liver cell injury. Alcohol. 2002;27:63-68. [PubMed] [DOI] |
| 3. | Arteel GE. Oxidants and antioxidants in alcohol-induced liver disease. Gastroenterology. 2003;124:778-790. [PubMed] [DOI] |
| 4. | Fromenty B, Berson A, Pessayre D. Microvesicular steatosis and steatohepatitis: role of mitochondrial dysfunction and lipid peroxidation. J Hepatol. 1997;26 Suppl 1:13-22. [PubMed] [DOI] |
| 5. | Hall PD, Plummer JL, Ilsley AH, Cousins MJ. Hepatic fibrosis and cirrhosis after chronic administration of alcohol and "low- dose" carbon tetrachloride vapor in the rat. Hepatology. 1991;13:815-819. [PubMed] [DOI] |
| 6. | Buko VU, Sadovnichy VV. Cytochrome P-450 and free radical generation in rat liver microsomes under the influence of prostaglandin E1. Biochem Mol Biol Int. 1996;39:1177-1184. [PubMed] |
| 7. | Baek Y, Nakano H, Kumada K, Nagasaki H, Kigawa G, Sasaki J, Kaneda M, Hatakeyama T, Kitamura N, Sanada Y. Administration of prostaglandin E1 reduces post-operative hepatocellular damage and restores hepatic integrity in patients undergoing hepatectomy. Hepatogastroenterology. 1999;46:1836-1841. [PubMed] |
| 8. | Masaki N, Ohta Y, Shirataki H, Ogata I, Hayashi S, Yamada S, Hirata K, Nagoshi S, Mochida S, Tomiya T. Hepatocyte membrane stabilization by prostaglandins E1 and E2: favorable effects on rat liver injury. Gastroenterology. 1992;102:572-576. [PubMed] |
| 9. | Robert A. Cytoprotection by prostaglandins. Gastroenterology. 1979;77:761-767. [PubMed] |
| 10. | Hanazaki K, Kuroda T, Kajikawa S, Amano J. Prostaglandin E1 reduces thromboxane A2 in hepatic ischemia-reperfusion. Hepatogastroenterology. 2000;47:807-811. [PubMed] |
| 11. | Wang XE, Watanabe S, Oide H, Hirose M, Itatsu T, Osada T, Takazakura Y, Yokoi Y, Sato N. Hepatic stellate cell contraction is inhibited by lipo-prostaglandin E1 in vitro. J Gastroenterol Hepatol. 1998;13 Suppl:S14-S18. [PubMed] |
| 12. | Natori S, Fujii Y, Kurosawa H, Nakano A, Shimada H. Prostaglandin E1 protects against ischemia-reperfusion injury of the liver by inhibition of neutrophil adherence to endothelial cells. Transplantation. 1997;64:1514-1520. [PubMed] [DOI] |
| 13. | Iwata K, Shimazu M, Wakabayashi G, Ohshima A, Yoshida M, Kitajima M. Intraportal perfusion of prostaglandin E1 attenuates hepatic postischaemic microcirculatory impairments in rats. J Gastroenterol Hepatol. 1999;14:634-641. [PubMed] [DOI] |
| 14. | Adachi T, Nakashima S, Saji S, Nakamura T, Nozawa Y. Roles of prostaglandin production and mitogen-activated protein kinase activation in hepatocyte growth factor-mediated rat hepatocyte proliferation. Hepatology. 1995;21:1668-1674. [PubMed] |
| 17. | Baum BJ, Moss J, Breul SD, Berg RA, Crystal RG. Effect of cyclic AMP on the intracellular degradation of newly synthesized collagen. J Biol Chem. 1980;255:2843-2847. [PubMed] |
| 18. | Itasaka H, Suehiro T, Wakiyama S, Yanaga K, Shimada M, Sugimachi K. The mechanism of hepatic graft protection against reperfusion injury by prostaglandin E1. Surg Today. 1999;29:526-532. [PubMed] [DOI] |