修回日期: 2009-12-28
接受日期: 2009-12-29
在线出版日期: 2010-01-28
目的: 探讨钾通道在D型钠尿肽抑制豚鼠胃窦环形肌自发性收缩活动中的作用.
方法: 采用四道生理记录仪记录豚鼠胃窦环形肌自发性收缩活动; 应用放射免疫法测定豚鼠胃窦环形肌组织和灌流液中环-磷酸鸟苷(cGMP)含量; 运用全细胞模式的膜片钳技术记录豚鼠胃窦环形肌上钙敏感钾电流和延迟整流型钾电流.
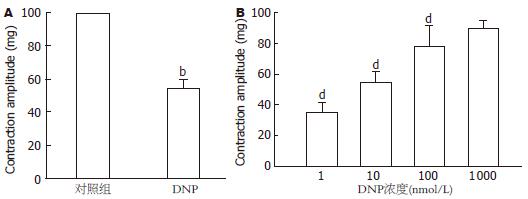
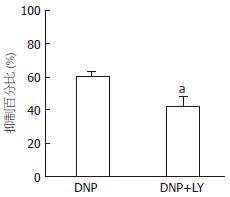
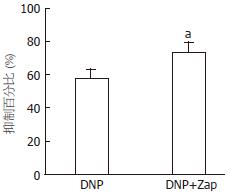
结果: DNP抑制豚鼠胃窦环形肌自发性收缩活动并呈现剂量依赖性. 1、10、100及1 000 nmol/L的DNP抑制自发性收缩幅度分别为35%±6%、54%±6%、78%±13%及94%±6%. 10 nmol/L鸟苷酸环化酶抑制剂LY83583使收缩幅度抑制减弱(42%±6% vs 60%±4%, P<0.05); 而用100 nmol/L的cGMP依赖的磷酸脂酶抑制剂Zaparinast使DNP对胃窦环行肌自发性收缩的抑制效应增强(72%±7% vs 58%±5%, P<0.05). DNP明显增加豚鼠胃窦环形肌组织和灌流液中的cGMP水平. 10 nmol/L DNP增加豚鼠胃窦环形肌上钙敏感钾电流, 在60 mV时增加的幅值为62.31%±3.22%, 抑制延迟整流型钾电流, 在60 mV时抑制幅度为18%±2.3%.
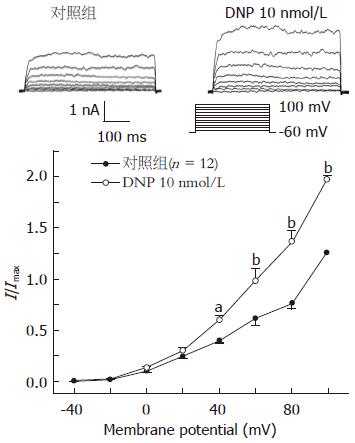
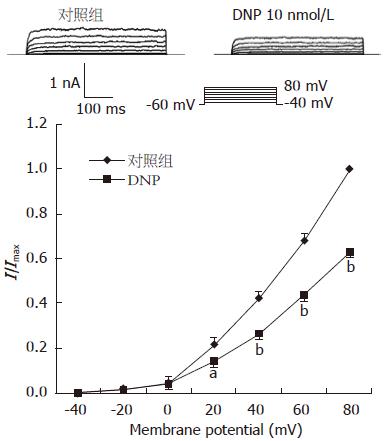
结论: DNP通过增加IK(Ca)和cGMP途径实现对豚鼠胃窦环形肌的舒张作用. IK(V)不参与此过程, 但在维持豚鼠胃窦环形肌细胞的静息膜电位中起重要作用.
引文著录: 闻庆平, 蔡春玉, 李萍, 蔡正旭, 程雷, 齐清会, 郭慧淑. 钾通道在D型钠尿肽抑制胃动力中的作用. 世界华人消化杂志 2010; 18(3): 217-221
Revised: December 28, 2009
Accepted: December 29, 2009
Published online: January 28, 2010
AIM: To investigate the role of potassium channels in Dendroaspis natriuretic peptide (DNP)-induced relaxation of gastric antral circular smooth muscle of guinea pigs.
METHODS: The spontaneous contraction of gastric antral circular muscle of guinea pigs was recorded using a four-channel physiograph. The contents of cyclic guanosine monophosphate (cGMP) in gastric antral smooth muscle tissue and in perfusion medium were measured by radioimmunoassay. The whole cell patch-clamp technique was used to record calcium-activated potassium current (IK(Ca)) and delayed rectifier potassium current (IK(V)) in gastric myocytes isolated by collagenase digestion.
RESULTS: DNP inhibited the spontaneous contraction of gastric antral circular smooth muscle in a dose-dependent manner. DNP at concentrations of 1, 10, 100 and 1 000 nmol/L reduced the amplitude of the spontaneous contraction by 35% ± 6%, 54% ± 6%, 78% ± 13% and 94% ± 6%, respectively. LY83583, an inhibitor of soluble guanylate cyclase, significantly blocked DNP-induced relaxation of gastric antral circular smooth muscle (reduced amplitude: 42% ± 6% vs 60% ± 4%, P < 0.05). In contrast, zaprinast, a cGMP-sensitive phosphodiesterase inhibitor, potentiated DNP-induced relaxation of gastric antral circular smooth muscle (reduced amplitude: 72% ± 7% vs 58% ± 5%, P < 0.05). DNP markedly enhanced cGMP levels in gastric antral smooth muscle tissue and in perfusion medium. DNP increased the amplitude of IK(Ca) at 60 mV by 62.31% ± 3.22%, but decreased the amplitude of IK(V) at 60 mV by 18% ± 2.3% in gastric antral circular myocytes of guinea pigs.
CONCLUSION: DNP relaxes the gastric antral circular smooth muscle of guinea pigs by increasing IK(Ca) in a cGMP-dependent pathway. IK(V) may play a critical role in regulating resting membrane potential in gastric antral circular myocytes of guinea pigs.
- Citation: Wen QP, Cai CY, Li P, Cai ZX, Cheng L, Qi QH, Guo HS. Role of potassium channels in Dendroaspis natriuretic peptide-induced inhibition of gastric motility. Shijie Huaren Xiaohua Zazhi 2010; 18(3): 217-221
- URL: https://www.wjgnet.com/1009-3079/full/v18/i3/217.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i3.217
胃肠动力障碍性疾病, 如功能性消化不良、习惯性便秘、糖尿病性胃轻瘫、手术后肠麻痹、多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS)的胃肠麻痹等是常见病, 多发病, 严重影响患者生活质量, 目前尚且无很好的治疗手段. 钠尿肽(natriuretic peptides, NP)是具有生物活性的多聚肽类, 以激素或神经递质形式发挥生理作用[1]. 到目前为止, NP家族包括心房钠尿肽(atrial natriuretic peptide, ANP), 脑钠尿肽(brain natriuretic peptide, BNP), C型钠尿肽(C-type natriuretic peptide, CNP), D型钠尿肽(dendroaspis natriuretic peptide, DNP), VNP(ventricular natriuretic peptide, VNP)和MNP(micrurus natriuretic peptide, MNP)[2]. 其主要生理功能是利尿、利钠、舒张血管、降低血压和调节电解质平衡等效应. Vuolteenaho等[3]首次在大鼠的胃和小肠内发现了ANP的免疫反应物质, 为研究NP与胃肠功能之间的关系拉开了序幕. 目前研究证实NP受体(natriuretic peptide receptor, NPR)有3种, 即NPR-A, NPR-B和NPR-C. 前两者有与鸟苷酸环化酶相结合的结合位点, 而后者却没有, NPR-C作为一种清除型受体而发挥作用. Cui等[5]在大鼠的胃窦黏膜和平滑肌组织中发现有NPR, Crane等研究发现在大鼠的肠道内也存在着NPR后来在家兔的胃肠道内也有NPRA存在. Chijiiwa等通过研究发现ANP能抑制胃平滑肌收缩反应, ANP对胃肠动力的调节除了受中枢神经系统的支配外, 还发现豚鼠的胃和小肠能合成通过旁分泌和自分泌作用于胃肠道抑制胃肠运动. 从我们以往的研究[4]发现CNP抑制豚鼠、大鼠和人胃窦环形肌自发性收缩活动, 其中对人胃窦环形肌自发性收缩的抑制作用最强而对豚鼠胃窦环形肌自发性收缩活动抑制作用最弱, 并发现对胃窦、胃体和胃底部自发性收缩活动表现出不同形式. 这表明钠尿肽对胃运动的作用不仅具有种属差异而且表现除部位差异. 钾通道在维持细胞的静息电位中起重要作用, 豚鼠胃窦环形肌上主要有两种钾通道即IK(Ca)和IK(V). 目前对钾通道与DNP调节胃动力之间的关系还不非常明确, 并且cGMP是否参与此过程也不明确. 本研究旨在通过四道生理记录仪观察DNP对豚鼠胃窦环形肌自发性收缩活动的影响, 用放射免疫技术测定DNP作用于豚鼠胃窦环形肌时组织和灌流液中cGMP的含量, 并用全细胞膜片钳技术记录DNP调节胃动力与钾通道之间的关系, 从而阐述DNP调节胃动力的离子机制.
40只EWG/B豚鼠, 雌雄不限, 体质量300 g±50 g, 由大连医科大学动物中心提供; 用乌拉坦(50 mg/kg)麻醉. 每个实验所用动物均为不同个体.
1.2.1 肌条制备及其收缩活动的记录: 用乌拉坦(50 mg/kg)麻醉豚鼠后, 沿中线剖腹取胃置于氧饱和台氏液中, 去掉黏膜层即可见环行肌层, 沿垂直于胃长轴的方向剪取即可得环行肌条(约2.0 mm×15.0 mm), 沿胃长轴方向剪取则为纵行肌. 取下的肌条放置于容积为2 mL的小槽内, 槽的盖上有一玻璃小钩, 肌条的一端就固定在玻璃小钩上而另一端则连于张力换能器上(TD-112S, 日本), 换能器与四道生理记录仪进而记录肌条的收缩活动. 置有肌条的小槽始终用氧饱和台氏液灌流, 通过恒温装置(WC/09-05)使槽内温度保持在37.0 ℃±0.5 ℃, 实验开始前肌条至少需孵育40 min.
1.2.2 cGMP含量测定: 利用放射免疫技术测定组织和灌流液中cGMP含量. 将组织切碎匀浆, 取上清液浓缩, 取100 μL的浓缩液作为测定标本. 用标记碘125的cGMP标准品100 μL作为对照[5]. 使测定标本与标准品与cGMP特异的抗体抗体相结合. 测定标本与标记的cGMP将与抗体竞争性结合. 用γ计数器可以测定碘标记的cGMP与抗体结合的量, 从而间接计算出测定标本与抗体结合量进而测定标本中cGMP的含量.
1.2.3 细胞制备及其电生理记录: 用乌拉坦(50 mg/kg)麻醉动物后, 迅速剪取胃窦部放入氧饱和的无钙的PSS缓冲液中漂洗, 然后分离环行肌并将其分割成几个肌条(1 mm×4 mm). 将肌条放入4 ℃的K-B液中保存约15 min, 之后将其放入装有36 ℃消化液的试管中进行孵育. 消化液是由0.1%的Ⅱ型胶原酶、0.1%的二硫苏醇糖、0.15%的胰蛋白抑制剂和0.2%的牛血清白蛋白溶入4 mL无钙的PSS缓冲液组成的. 孵育结束, 将消化好的肌条移入4 ℃ K-B液中保存, 在实验前用管口圆滑的滴管轻轻吹打肌条即可得到分离的单细胞. 取1滴细胞悬浮液(0.1 mL)平铺于倒置显微镜(Ⅸ-70 Olympus, Japan)镜台上的灌流槽底部, 待10-15 min细胞沉降至槽底后, 用等渗溶液进行灌流(2-3 mL/min). 然后用电阻为2-5 MΩ的玻璃电极进行5-10 GΩ的千兆封接. 钙敏感钾电流和延迟整流型钾电流通过Axopatch 1-D型膜片钳放大器记录.
统计学处理 所有统计数据用mean±SD来表示. 肌肉收缩幅度用SPSS统计, 电流幅值在Clamp Fit10中统计, 实验结果采用同体对照的t检验和组间比较的t检验, 具有显著性差异的标准为P<0.05. 不同实验中均是不同个体得出的不同数据, 并非一个个体上得出多个数据.
肌条在台氏液中孵育40 min左右出现稳定的肌条收缩波, 此时观察10 nmol/L DNP对豚鼠胃窦环形肌自发性收缩活动的影响. 给予DNP后自发性收缩明显受到抑制, 不同剂量的DNP明显抑制, 并呈现剂量依赖关系. 1、10、100、1 000 nmol/L的DNP抑制自发性收缩幅度, 其抑制程度分别为35%±6%, 54%±6%, 78%±13%和94%±6%. 其中高浓度即1 000 nmol/L的DNP几乎完全抑制自发性收缩活动(图1A, n = 8; 图1B, n = 6).
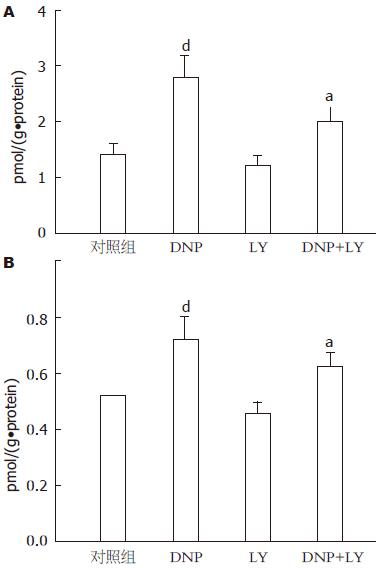
为了探讨DNP抑制豚鼠胃动力的机制, 预先用10 nmol/L的鸟苷酸环化酶抑制剂LY83583处理15 min后, DNP对豚鼠胃窦环行肌自发性收缩活动的抑制效应明显减弱, 由原来单纯给予DNP时抑制60%±4%减弱到42%±6%(图2); 而用100 nmol/L的cGMP依赖的磷酸脂酶抑制剂Zaparinast预处理15 min后, DNP对胃窦环行肌自发性收缩的抑制效应增强, 由单纯给予DNP时抑制58%±5%增强抑制到72%±7%(图3). 另外, 用放射免疫技术直接测定了DNP作用于豚鼠胃窦环形肌时肌组织和灌流液中cGMP的含量, 结果发现其cGMP含量明显增加(图4).
为了进一步探讨DNP抑制胃动力的离子通道机制, 观察了DNP对豚鼠胃窦环形肌上IK(Ca)的影响. 利用传统全细胞模式的膜片钳技术, 在电压钳制在-60 mV, 阶跃电压刺激从-40 mV开始, 以每20 mV的阶跃幅度去极化至+100 mV, 持续400 ms, 每次去极化刺激间隔为10 s的情况下观察了DNP对豚鼠胃窦环行肌细胞IK(Ca)的影响. 10 nmol/L的DNP明显增加豚鼠胃窦环行肌IK(Ca), 在60 mV时增加的幅值为62.31%±3.22%(图5).
豚鼠胃窦环形肌上除了IK(Ca)外还有另一种钾通道即IK(V). 本实验中还观察了DNP对IK(V)的影响. 在电压钳制在-60 mV, 阶跃电压刺激从-40 mV开始, 以每20 mV的阶跃幅度去极化至+100 mV, 持续400 ms, 电极内液加EGTA 10 mmol/L, 每次去极化刺激间隔为10 s的情况下观察10 nmol/L DNP对豚鼠胃窦环形肌上IK(V)的影响. 结果显示, 10 nmol/L的DNP明显抑制IK(V), 在60 mV时抑制幅度为18%±2.3%(图6).
在本研究中发现DNP对豚鼠胃窦环形肌自发性收缩活动有明显的抑制作用, 并呈现剂量依赖关系. 鸟苷酸环化酶抑制剂LY83583明显抑制DNP对胃动力的抑制作用而cGMP敏感的磷酸酯酶抑制剂Zaparinast却增强DNP对胃动力的抑制效应. DNP通过增加钙敏感钾电流使细胞超级化从而实现对胃窦环形肌的舒张作用.
DNP是从一种美洲蛇毒液中提炼出来的38个氨基酸组成的肽类物质, 关于DNP的研究主要集中在心血管系统[6]. Ha等[7,8]研究发现DNP通过增加Bcl-2实现心肌梗死引起的心肌的损伤, 同时他们证明DNP引起心肌细胞的凋亡. 近年来对DNP的研究越来越深入, 在胃肠道也发现了DNP系统. Kim等[9]首次报道了DNP与胃肠功能之间的关系, 证实DNP系统存在于大鼠的结肠, 作为局部调质并调节肠动力. 在我们以往的研究中也发现在豚鼠的胃窦环形肌的黏膜层和肌层内均有钠尿肽受体存在, 这也证明了DNP与胃肠功能有紧密联系. 在本研究中发现DNP抑制豚鼠胃窦环形肌自发性收缩活动, 这种抑制效应具有剂量依赖关系.
NP和NO系统相似是体内cGMP系统的启动系统参与调节机体的许多生理活动. 在调节平滑肌功能方面, NP表现出通过启动cGMP系统抑制平滑肌舒张的效应. Kedia等[10]发现cGMP参与了CNP调节人前列腺平滑肌的正常收缩. Best等[11]报道DNP通过增加cGMP舒张人动脉和静脉. 在本研究中发现鸟苷酸环化酶抑制剂LY83583减弱DNP对豚鼠胃窦环形肌自发性收缩的抑制效应而cGMP敏感的磷酸酯酶抑制剂Zaparinast却增强DNP对胃窦环形肌自发性收缩的抑制作用. 这表明cGMP系统也参与DNP抑制胃动力的过程.
钾通道参与维持细胞的静息电位与平滑肌的舒张有密切联系. 在豚鼠胃窦环形肌上主要有两种钾通道即钙敏感钾通道(IK(Ca))和延迟整流型钾通道(IK(V))[12]. 在控制平滑肌收缩中起重要作用, 以往的研究中也证实IK(Ca)参与NP调节肌肉收缩的过程, Mikawa等报道[13]ANP通过激活IK(Ca)参与支气管平滑肌的舒张过程. Banks等[14]报道CNP通过激活IK(Ca)实现对狗股静脉的舒张. van der Zander等[15]报道BNP通过增加IK(Ca)实现动脉血管舒张. 在本研究也观察到类似的现象, DNP通过增加IK(Ca)实现对豚鼠胃窦环形肌自发性收缩的抑制作用, IK(V)并不参与此过程, 可能是在维持细胞静息膜电位中起一定作用. 需要我们进一步深入研究其机制.
总之, DNP通过增加IK(Ca)抑制豚鼠胃窦环形肌自发性收缩活动, cGMP参与此过程.
胃肠动力障碍性疾病是常见病, 多发病, 严重影响患者生活质量, 目前尚无很好的治疗手段. 钠尿肽(NP)是具有生物活性的多聚肽类, 以激素或神经递质形式发挥生理作用. Vuolteenaho等首次在大鼠的胃和小肠内发现了ANP的免疫反应物质, 为研究NP与胃肠功能之间的关系拉开了序幕. DNP是新发现的钠尿肽家族成员, 关于其对胃肠动力方面的研究机制还不清楚.
任超世, 研究员, 中国医学科学院生物医学工程研究所.
Kedia等发现, cGMP参与了CNP调节人前列腺平滑肌的正常收缩. Best等报道DNP通过增加cGMP舒张人动脉和静脉.
本研究通过四道生理记录仪观察DNP对豚鼠胃窦环形肌自发性收缩活动的影响, 用放射免疫技术测定DNP作用于豚鼠胃窦环形肌时组织和灌流液中cGMP的含量, 并用全细胞膜片钳技术记录DNP调节胃动力与钾通道之间的关系, 从而阐述DNP调节胃动力的离子机制.
本研究证实, DNP通过增加IK(Ca)和cGMP途径实现对豚鼠胃窦环形肌的舒张作用. IK(V)不参与此过程, 但在维持豚鼠胃窦环形肌细胞的静息膜电位中起重要作用.
本研究以豚鼠为实验对象, 探讨钾通道在DNP抑制胃窦环形肌自发性收缩活动中的作用, 获得了明确的研究结果, 具有一定的学术性和参考价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Tingberg E, Roijer A, Thilen U, Ohlin H. Neurohumoral changes in patients with left ventricular dysfunction following acute myocardial infarction and the effect of nitrate therapy: a randomized, double-blind, placebo-controlled long-term study. J Cardiovasc Pharmacol. 2006;48:166-172. [PubMed] [DOI] |
| 2. | Hansson M. Natriuretic peptides in relation to the cardiac innervation and conduction system. Microsc Res Tech. 2002;58:378-386. [PubMed] [DOI] |
| 3. | Vuolteenaho O, Arjamaa O, Vakkuri O, Maksniemi T, Nikkilä L, Kangas J, Puurunen J, Ruskoaho H, Leppäluoto J. Atrial natriuretic peptide (ANP) in rat gastrointestinal tract. FEBS Lett. 1988;233:79-82. [PubMed] [DOI] |
| 4. | Guo HS, Jin Z, Jin ZY, Li ZH, Cui YF, Wang ZY, Xu WX. Comparative study in the effect of C-type natriuretic peptide on gastric motility in various animals. World J Gastroenterol. 2003;9:547-552. [PubMed] |
| 5. | Cui X, Lee SJ, Kim SZ, Kim SH, Cho KW. Effects of pituitary adenylate cyclase activating polypeptide27 on cyclic AMP efflux and atrial dynamics in perfused beating atria. Eur J Pharmacol. 2000;402:129-137. [PubMed] [DOI] |
| 6. | Singh G, Maguire JJ, Kuc RE, Skepper JN, Fidock M, Davenport AP. Characterization of the snake venom ligand [125I]-DNP binding to natriuretic peptide receptor-A in human artery and potent DNP mediated vasodilatation. Br J Pharmacol. 2006;149:838-844. [PubMed] [DOI] |
| 7. | Ha KC, Piao CS, Chae HJ, Kim HR, Chae SW. Dendroaspis natriuretic peptide protects the post-ischemic myocardial injury. Regul Pept. 2006;133:13-19. [PubMed] [DOI] |
| 8. | Ha KC, Chae HJ, Piao CS, Kim SH, Kim HR, Chae SW. Dendroaspis natriuretic peptide induces the apoptosis of cardiac muscle cells. Immunopharmacol Immunotoxicol. 2005;27:33-51. [PubMed] |
| 9. | Kim JH, Yang SH, Yu MY, Lee HK, Kim SY, Kim SH. Dendroaspis natriuretic peptide system and its paracrine function in rat colon. Regul Pept. 2004;120:93-98. [PubMed] [DOI] |
| 10. | Kedia G, Uckert S, Scheller F, Chigogidze T, Managadze L, Jonas U, Truss MC. In vitro functional responses of isolated normal human prostatic tissue to compounds interacting with the cyclic guanosine monophosphate pathway. Urology. 2006;67:1292-1297. [PubMed] [DOI] |
| 11. | Best PJ, Burnett JC, Wilson SH, Holmes DR Jr, Lerman A. Dendroaspis natriuretic peptide relaxes isolated human arteries and veins. Cardiovasc Res. 2002;55:375-384. [PubMed] [DOI] |
| 12. | Piao L, Li Y, Li L, Xu WX. Increment of calcium-activated and delayed rectifier potassium current by hyposmotic swelling in gastric antral circular myocytes of guinea pig. Acta Pharmacol Sin. 2001;22:566-572. [PubMed] |
| 13. | Mikawa K, Kume H, Takagi K. Effects of BKCa channels on the reduction of cytosolic Ca2+ in cGMP-induced relaxation of guinea-pig trachea. Clin Exp Pharmacol Physiol. 1997;24:175-181. [PubMed] [DOI] |
| 14. | Banks M, Wei CM, Kim CH, Burnett JC Jr, Miller VM. Mechanism of relaxations to C-type natriuretic peptide in veins. Am J Physiol. 1996;271:H1907-H1911. [PubMed] |
| 15. | van der Zander K, Houben AJ, Kroon AA, De Mey JG, Smits PA, de Leeuw PW. Nitric oxide and potassium channels are involved in brain natriuretic peptide induced vasodilatation in man. J Hypertens. 2002;20:493-499. [PubMed] [DOI] |