修回日期: 2010-10-15
接受日期: 2010-10-16
在线出版日期: 2010-10-18
目的: 探讨SHH途径相关蛋白在结肠良恶性肿瘤中的表达情况及与STAT3活化之间的关系.
方法: 免疫组织化学检测20例正常结肠组织、42例结肠腺瘤以及77例结肠腺癌组织中SHH、GLI1、PTCH1、HHIP和磷酸化STAT3(P-STAT3)的表达, 并评价他们之间及其与临床病理因素的关系.
结果: 相比正常结肠组织, SHH、GLI1、PTCH1和HHIP在结肠腺瘤及腺癌中均过度表达(95.2%, 75.3% vs 0.0%, P<0.05; 66.7%, 84.4% vs 0.0%, P<0.05; 23.8%, 58.4% vs 0.0%, P<0.05; 42.9%, 36.4% vs 25.0%), 且在腺癌组织中SHH和GLI1的表达与肿瘤的病理分级有关(P<0.05). SHH及GLI1之间的表达有显著相关性(r = 0.498, P<0.01), 而腺癌组织中STAT3的活化(P-STAT3的表达)与SHH及GLI1的表达关系密切(r = 0.525, P<0.01; r = 0.637, P<0.01).
结论: SHH信号途径与结肠肿瘤的发生及进展有一定的关系, 该途径的关键信号蛋白在结肠腺癌中的过度表达可能与STAT3信号途径的活化有协同作用.
引文著录: 刘聪, 喻志华, 李媛, 周晟. SHH信号途径相关蛋白在结肠肿瘤组织中过度表达与STAT3活化的关系. 世界华人消化杂志 2010; 18(29): 3089-3095
Revised: October 15, 2010
Accepted: October 16, 2010
Published online: October 18, 2010
AIM: To determine the expression pattern of sonic hedgehog (SHH) signaling pathway molecules and analyze their relationship with STAT3 activation in colonic tumors.
METHODS: Paraffin-embedded tissue sections of 20 normal colon tissue specimens, 42 colonic adenoma specimens, and 77 colonic adenoma adenocarcinoma specimens were used in the study. The expression of SHH, GLI1, PTCH1, HHIP and P-STAT3 in these specimens was detected by immunohistochemistry. The correlation of the expression of HH molecules with clinicopathological parameters and P-STAT3 expression was then evaluated.
RESULTS: All the SHH signaling pathway molecules examined were overexpressed in colonic adenomas and adenocarcinomas when compared with normal colon tissue (95.2% and 75.3% vs 0.0%, both P < 0.05; 66.7% and 84.4% vs 0.0%, both P < 0.05; 23.8% and 58.4% vs 0.0%, both P < 0.05; 42.9% and 36.4% vs 25.0%, both P < 0.05). SHH and GLI1 expression was correlated with tumor grade (both P < 0.05). There was a significant correlation between SHH and GLI1 expression in colonic adenomas and adenocarcinomas (r = 0.498, P < 0.01). Overexpression of activated STAT3 (P-STAT3) was significantly correlated with SHH and GLI1 expression in colonic adenocarcinomas (r = 0.525, P < 0.01; r = 0,637, P < 0.01).
CONCLUSION: SHH signaling pathway may play a role in the progression of colonic tumors. The finding that SHH overexpression is correlated with STAT3 activation in colonic tumors indicates that there may be a synergetic effect between the two signaling pathways.
- Citation: Liu C, Yu ZH, Li Y, Zhou S. Overexpression of sonic hedgehog pathway molecules and STAT3 activation in colonic tumors. Shijie Huaren Xiaohua Zazhi 2010; 18(29): 3089-3095
- URL: https://www.wjgnet.com/1009-3079/full/v18/i29/3089.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i29.3089
越来越多的证据支持了一个观点, 即癌症发生可被视为器官由于异常发育并积累突变而产生具有无限增生潜能的过程, Hedgehog(HH)信号途径在哺乳动物的胚胎形成与组织分化发育中起关键作用, 而且逐渐有实验显示其异常激活能导致多种肿瘤生成, 如皮肤基底细胞癌、前列腺癌、非小细胞肺癌、消化系肿瘤等[1-4]. HH基因于1980年在果蝇中被发现, 编码高度保守的糖蛋白, 在哺乳动物中至少发现3种同源基因: Sonic Hedgehog(SHH)、Indian Hedgehog(IHH)和Desert Hedgehog(DHH), 分别编码3种相应的蛋白: SHH、IHH和DHH. SHH对哺乳动物的乳腺、前列腺、肺、毛发、消化系统和神经系统等多器官的发育起重要作用, 研究发现多种肿瘤中存在着SHH信号通路的异常激活, 且在肺部和消化系肿瘤中表现尤为活跃[5-7], SHH信号通路对靶细胞的作用是通过细胞膜上Patched(PTCH)转录元件介导, PTCH是一种含12个跨膜结构域的蛋白, 可与SHH结合, 既是SHH的膜受体也是SHH的转录目标. 当SHH蛋白和PTCH结合时可通过胞质微管上附着的HH信号复合物介导, 使一种转录因子进入胞核, 从而激活其下游基因的表达, 该转录因子在脊椎动物中称为GLI(glioma-associated oncogene homoglog). GLI是整个信号通路中最关键的信号分子, 其表达上调会引起目的基因的转录, 最终导致肿瘤的发生和发展[8]. 另外, 除了膜受体 PTCH能够与SHH信号肽结合外, 膜蛋白HHIP(human hedgehog-interacting protein)也能与SHH肽链结合, 从而竞争抑制SHH蛋白分子与PTCH结合, 起到内源性抑制SHH信号通路活化的作用[9-11].
STAT3作为信号转导与转录激活因子家族中的重要一员, 在肿瘤细胞的形成、生长、凋亡抑制等过程起重要的调控作用已被广泛及深入的研究[12-14]. 近来研究发现STAT3与EGFR、β-catenin、NF-κB、Akt等多个信号通道都有交叉或协同作用[15], 共同参与肿瘤的生成及进展. 但STAT3与SHH信号途径有何关系还未见报道, 先期我们通过构建STAT3在上皮细胞中过度表达的转基因小鼠模型, 发现持续活化的STAT3可再次激活对上皮细胞增殖起重要作用的SHH基因, 上调SHH信号途径相关因子的表达, 因此我们推测SHH可能是STAT3直接或间接的下游靶基因. 本文以结肠肿瘤为对象观察STAT3在肿瘤组织中的活化与SHH及其相关蛋白表达之间的关系, 初步探索STAT3与SHH途径可能有的联系.
77例结直肠癌取自同济医院外科2008-01/2009-07手术切除组织的石蜡标本, 患者男46例, 女31例, 年龄为42-73(中位年龄57)岁, 有完整的临床病理学资料. 病理类型: 管状腺癌56例, 黏液腺癌15例, 其他6例; 肿瘤细胞分化程度: 高分化者34例, 中分化者26例, 低分化者17例; 临床分期采用Duke's分期: A期21例, B期27例, C期19例, D期10例; 有淋巴结转移者34例, 有远处转移者10例, 其中有7例为肝转移, 所有病例在肿瘤切除前均未进行化疗. 同时选取42例同时期结肠腺瘤患者的组织石蜡切片进行免疫组织化学染色, 另从手术切除标本中选取20例正常结肠黏膜组织作为对照. 免疫组织化学所用试剂: 一抗均购自Santa Cruz biotechnology, inc. 分别是SHH(sc-9024, 克隆号: H-160); GLI1(sc-20687克隆号: H-300); PACH1(sc-6149, 克隆号: G-19); HHIP(sc-25465, 克隆号: H-280); P-STAT3(sc-135649, 克隆号: Ser 727). 二抗EnVisionTM system为丹麦DAKO公司产品.
1.2.1 免疫组织化学染色: 切片68 ℃ 2 h, 脱蜡和水化后, 切片浸入3% H2O2 15 min, 用0.01 mol/L pH6.0柠檬酸盐缓冲液进行微波抗原修复, 98 ℃-100 ℃ 20 min, 室温冷却后PBS冲洗, 小牛血清封闭15 min, 滴加一抗室温孵育1 h后, PBS浸泡冲洗3次, 每次3 min, 滴加EnVisionTM, 室温孵育30 min, PBS冲洗后DAB显色, 苏木精复染. 设0.01 mol/L PBS代替一抗作为阴性对照. 省略一抗为空白对照.
1.2.2 结果判断: 切片以胞核或胞质中出现明显的棕黄色细颗粒为阳性判断标准, 在高倍镜下对阳性细胞进行评分: 随机选择5个视野, 总共计数200个细胞, 没有阳性细胞着色记0分, 有10%-20%细胞阳性着色记1分, 有20%-50%细胞阳性着色记2分, 超过50%细胞着色记3分. 阳性染色强度按以下标准区分: 0, 没有棕黄色; 1, 微弱棕黄色; 2, 核或浆中等强度棕黄色; 3, 阳性细胞核或浆呈深棕色反应. 便于统计学处理将上述两种评分之积作为评判标准, 分数为0-2分者作为阴性反应, 3分或以上作为阳性反应.
统计学处理 采用SPSS11.0统计软件进行统计分析, 计数资料与临床病理指标的关系采用χ2或Fisher精确概率法检验, Spearman等级相关分析计数资料间的相关性.
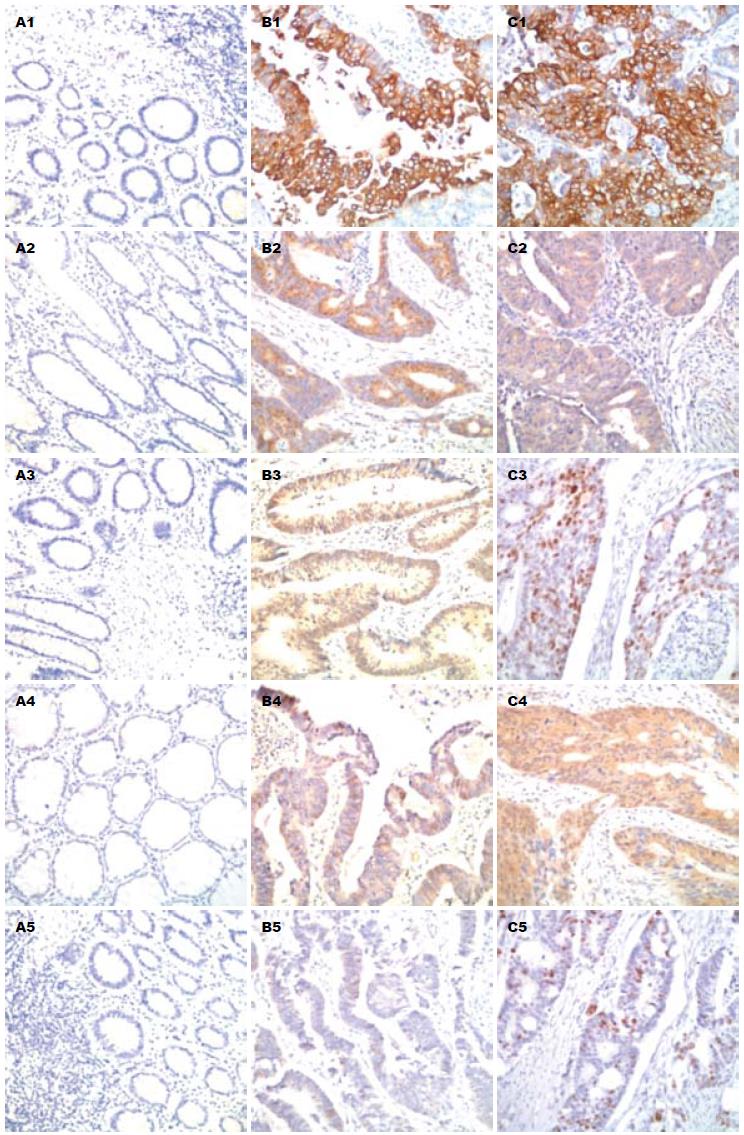
SHH阳性表达位于胞质内, 在正常结肠黏膜无SHH的表达(0/20), 但在结肠腺瘤组织中的阳性率高达95.2%(40/42), 在结肠腺癌组织中阳性率为75.3%(58/77); PTCH1在胞膜或胞质中有阳性染色, 他在正常结肠组织中无表达, 在结肠腺瘤组织中也仅10例呈阳性染色(23.8%), 而在腺癌组织中的阳性率为58.4%(45/77); GLI1阳性染色出现于胞质或者胞质和胞核共同着色, 同样在正常结肠中无表达, 在腺瘤中阳性率为66.7%(28/42), 在腺癌中阳性率为84.4%(65/77); HHIP表达多位于胞质内, 少数可见胞膜染色, 正常结肠组织出现5例表达, 阳性率25%, 腺瘤组织中有18例表达, 阳性率42.9%, 腺癌组织中有28例表达, 阳性率36.4%; P-STAT3阳性信号大多位于细胞核内, 偶见胞核胞质共同着色, 在正常结肠黏膜无阳性表达, 在腺瘤组织中阳性率也仅7.1%(3/42), 在腺癌组织中阳性率为80.5%(62/77)(图1, 表1).
| 正常结肠组织(n = 20) | 腺瘤组织 (n = 42) | 腺癌组织(n = 77) | P值 | |
| SHH阳性 | 0(0.0) | 40(95.2) | 58(75.3) | <0.05 |
| PTCH1阳性 | 0(0.0) | 10(23.8) | 45(58.4) | <0.05 |
| GLI1阳性 | 0(0.0) | 28(66.7) | 65(84.4) | <0.05 |
| HHIP阳性 | 5(25.0) | 18(42.9) | 28(36.4) | |
| P-STAT3阳性 | 0(0.0) | 3(7.1) | 62(80.5) | <0.05 |
在结肠癌组织中, SHH的表达只与肿瘤的分化程度有关(P<0.05), 随着分化程度的降低阳性率逐渐升高, 除此之外SHH与患者性别、年龄、肿瘤的大小、浸润深度、淋巴结转移以及Duke's分期等无显著相关性; GLI1的情况类似, 只与分化程度显著相关(P<0.05); 而PTCH1与HHIP与选取的这些临床病理因素之间均无显著相关性(表2).
| 临床病理因素 | n | SHH+ | P值 | PTCH1+ | P值 | GLI1+ | P值 | HHIP+ | P值 |
| 性别 | |||||||||
| 男 | 46 | 35(76.1) | 0.81 | 28(60.9) | 0.66 | 38(82.6) | 0.71 | 18(39.1) | 0.52 |
| 女 | 31 | 23(74.2) | 17(54.8) | 27(87.1) | 10(32.3) | ||||
| 年龄(岁) | |||||||||
| ≥57 | 52 | 38(69.2) | 0.12 | 31(59.6) | 0.77 | 45(86.5) | 0.62 | 20(38.5) | 0.59 |
| <57 | 25 | 20(80.0) | 14(56.0) | 20(80.0) | 8(32.0) | ||||
| 肿瘤直径(cm) | |||||||||
| ≥4 | 32 | 26(81.3) | 0.13 | 20(62.5) | 0.53 | 28(87.5) | 0.71 | 13(40.6) | 0.69 |
| <4 | 45 | 32(71.1) | 25(55.6) | 37(82.2) | 15(33.3) | ||||
| 组织学类型 | |||||||||
| 管状腺癌 | 56 | 44(78.6) | 0.28 | 32(57.1) | 0.57 | 48(85.7) | 0.09 | 20(35.7) | 0.34 |
| 黏液腺癌 | 15 | 10(66.7) | 9(60.0) | 14(93.3) | 5(33.3) | ||||
| 其他 | 6 | 4(66.7) | 4(66.7) | 3(50.0) | 3(50.0) | ||||
| 肿瘤分化程度 | |||||||||
| 高分化 | 34 | 21(61.8) | 0.02 | 18(52.9) | 0.19 | 24(70.6) | 0.03 | 11(32.4) | 0.14 |
| 中分化 | 26 | 21(80.8) | 16(61.5) | 24(92.3) | 9(34.6) | ||||
| 低分化 | 17 | 16(94.1) | 11(64.7) | 17(100.0) | 8(47.1) | ||||
| 肿瘤浸润深度 | |||||||||
| 未及浆膜 | 50 | 36(72.0) | 0.15 | 29(58.0) | 0.75 | 40(80.0) | 0.11 | 17(34.0) | 0.59 |
| 浆膜以外 | 27 | 22(81.5) | 16(59.3) | 25(92.6) | 11(40.1) | ||||
| Duke's分期 | |||||||||
| A+B | 48 | 33(68.8) | 0.07 | 26(54.2) | 0.12 | 39(81.3) | 0.17 | 16(33.3) | 0.66 |
| C+D | 29 | 25(86.2) | 19(65.2) | 26(89.7) | 12(41.4) | ||||
| 淋巴结转移 | |||||||||
| 无 | 43 | 30(69.8) | 0.09 | 24(55.8) | 0.61 | 34(79.1) | 0.11 | 15(34.9) | 0.63 |
| 有 | 34 | 28(82.4) | 21(61.8) | 31(91.2) | 13(38.2) |
在结肠癌组织中, SHH、PTCH1、GLI1和HHIP两两之间只有SHH与GLI1表达出现显著正相关(P<0.01), 而且也仅有SHH和GLI1与活化态的STAT3(P-STAT3)之间有显著相关性(均P<0.01). 没有观察到PTCH1和HHIP的表达与其他蛋白以及STAT3的活化有关(表3).
| Spearman相关 | SHH | PTCH1 | GLI1 | HHIP | P-STAT3 |
| SHH | |||||
| 相关系数 | 1.00 | 0.09 | 0.43 | 0.11 | 0.26 |
| P值(双侧) | 0.11 | <0.01 | 0.13 | <0.01 | |
| PTCH1 | |||||
| 相关系数 | 0.09 | 1.00 | 0.03 | 0.05 | -0.11 |
| P值(双侧) | 0.11 | 0.65 | 0.43 | 0.07 | |
| GLI1 | |||||
| 相关系数 | 0.43 | 0.03 | 1.00 | -0.03 | 0.31 |
| P值(双侧) | <0.01 | 0.65 | 0.62 | <0.01 | |
| HHIP | |||||
| 相关系数 | 0.11 | 0.05 | -0.03 | 1.00 | 0.07 |
| P值(双侧) | 0.13 | 0.43 | 0.62 | 0.17 | |
| P-STAT3 | |||||
| 相关系数 | 0.26 | -0.11 | 0.31 | 0.07 | 1.00 |
| P值(双侧) | <0.01 | 0.07 | <0.01 | 0.17 |
结肠癌是消化系常见的恶性肿瘤之一, 其发病率和死亡率分别居所有癌症的第3位和第4位, 他的发生是由结肠黏膜的病变(非典型增长、腺瘤等)演变而来. 研究表明结肠癌的形成可能需要10年, 而仅从内镜下可辨认的腺瘤发展成侵袭性癌只需要大约5年, 及时发现可治愈的癌前病变或早期癌具有相当重要的临床意义, 因此研究正常结肠黏膜到腺瘤、腺癌的演化过程以及控制该过程的分子信号调控机制对早期发现病变趋势有积极作用. SHH是控制胚胎发育的关键信号通路, 在成人体内该途径异常活化与肿瘤形成也有密切关系, Berman等[16]在对来源于食管、胃、胆、胰腺和结肠癌的细胞系进行培养, 检测其SHH和PTCH mRNA水平, 发现97%的细胞系同时表达两者mRNA, 且部分结肠癌细胞系也高表达GLI, 这与我们观察到的SHH及其相关蛋白在结肠腺瘤及腺癌中过度表达相一致, 提示SHH途径在结肠肿瘤形成过程中有一定作用, 而且SHH和GLI1的阳性率与肿瘤分化显著相关, 能在某种程度上反映结肠腺癌细胞的增殖水平和分化程度, 也说明SHH和GLI1作为肿瘤标志物有一定可行性. 此外, 观察到在结肠癌组织中有较高表达的GLI1可定位于胞核和胞质中, 已证实GLI1是一个核浆穿梭蛋白, 活化后从胞质向核内移位[17,18]. 本实验发现在高分化腺癌中GLI1多出现在胞质中, 而核表达在低分化腺癌中常见, 提示GLI1的活化和肿瘤恶性进展有一定关系. 最近也有研究[2]表明SHH信号通路在结肠黏膜隐窝干细胞的分化过程中起重要的调节作用, 阻断该通路可导致干细胞分化障碍, 不能形成正常隐窝结构, 而结肠癌起源于异常分化增殖的黏膜干细胞, 那么SHH号通路的活化在结肠癌分化中所起的作用及其调控机制是值得期待的研究方向.
STAT3在实体肿瘤细胞中的异常激活一直是癌症研究的热点, 其过度激活往往导致细胞的异常增殖和凋亡障碍, 促进正常细胞发生恶性转化, 已有较多STAT3在结直肠癌组织中过度表达和活化与肿瘤分化、淋巴结转移、Duke's分期、预后有关的报道[19,20], 我们在实验中也发现STAT3在正常结肠黏膜内无激活, 在腺瘤组织中也极少发生, 但在腺癌细胞活化是常态事件, 而这与SHH信号途径某些关键蛋白的表达在一定程度上出现同向关系. 曾经有研究报道了淋巴瘤中SHH、Wnt、Hox、Notch和STAT3各途径之间的关系, 发现SHH在肿瘤细胞中的激活依赖STAT3的活化[21-24], 本实验也反应了这一趋势, 因此我们猜想STAT3信号途径是否会和SHH通路之间有交叉或者协同作用? 从而导致这种现象的发生. 基于上述已有的证据和提出的假设, 我们有兴趣进一步研究这两个通路相互作用的机制, 了解他们之间的调控方式, 并为将来控制SHH信号通路的基因表达及与其他信号途径的功能状态提供理论基础.
Hedgehog基因于1980年果蝇中发现, 在哺乳动物中至少存在3种同源基因: SHH、IHH和DHH. 目前研究表明在多种肿瘤中均存在着SHH信号通路的异常激活, SHH信号通路可通过细胞膜上Patched(PTCH)转录元件介导, 从而激活其下游基因的表达, 在肿瘤的发生发展过程中起着重要的作用.
王娅兰, 教授, 重庆医科大学基础医学院病理教研室; 汤华, 研究员, 重庆医科大学感染性疾病分子生物学教育部重点实验室
STAT3在实体肿瘤细胞中的异常激活一直是癌症研究的热点, 其过度激活往往导致细胞的异常增殖和凋亡障碍, 促进正常细胞发生恶性转化.
Berman等在对来源于食管、胃、胆、胰腺和结肠癌的细胞系进行培养, 检测其SHH和PTCH mRNA水平, 发现97%的细胞系同时表达两者mRNA, 且部分结肠癌细胞系也高表达GLI.
本文通过分析SHH、STAT3等相关基因在结肠腺癌中的表达, 评价他们与临床病理因素间的关系, 探讨STAT3信号途径与SHH通路之间的相互关系, 为进一步深入研究SHH信号通路在肿瘤中的作用奠定了理论基础.
通过研究STAT3和SHH这两条信号通路之间的相互作用机制, 了解他们之间的调控方式, 可为将来控制SHH信号通路的基因表达及与其他信号途径的功能状态提供一定的理论基础.
本文选题新颖, 有一定的学术指导意义.
编辑: 李军亮 电编:何基才
| 1. | Toftgård R. Hedgehog signalling in cancer. Cell Mol Life Sci. 2000;57:1720-1731. [PubMed] [DOI] |
| 2. | Katoh Y, Katoh M. Hedgehog signaling pathway and gastrointestinal stem cell signaling network (review). Int J Mol Med. 2006;18:1019-1023. [PubMed] |
| 3. | Bian YH, Huang SH, Yang L, Ma XL, Xie JW, Zhang HW. Sonic hedgehog-Gli1 pathway in colorectal adenocarcinomas. World J Gastroenterol. 2007;13:1659-1665. [PubMed] |
| 4. | Daya-Grosjean L, Couvé-Privat S. Sonic hedgehog signaling in basal cell carcinomas. Cancer Lett. 2005;225:181-192. [PubMed] [DOI] |
| 5. | Ma XL, Sun HJ, Wang YS, Huang SH, Xie JW, Zhang HW. Study of Sonic hedgehog signaling pathway related molecules in gastric carcinoma. World J Gastroenterol. 2006;12:3965-3969. [PubMed] |
| 6. | Chari NS, McDonnell TJ. The sonic hedgehog signaling network in development and neoplasia. Adv Anat Pathol. 2007;14:344-352. [PubMed] [DOI] |
| 7. | Monzo M, Moreno I, Artells R, Ibeas R, Navarro A, Moreno J, Hernandez R, Granell M, Pie J. Sonic hedgehog mRNA expression by real-time quantitative PCR in normal and tumor tissues from colorectal cancer patients. Cancer Lett. 2006;233:117-123. [PubMed] [DOI] |
| 8. | Mori Y, Okumura T, Tsunoda S, Sakai Y, Shimada Y. Gli-1 expression is associated with lymph node metastasis and tumor progression in esophageal squamous cell carcinoma. Oncology. 2006;70:378-389. [PubMed] [DOI] |
| 9. | Bosanac I, Maun HR, Scales SJ, Wen X, Lingel A, Bazan JF, de Sauvage FJ, Hymowitz SG, Lazarus RA. The structure of SHH in complex with HHIP reveals a recognition role for the Shh pseudo active site in signaling. Nat Struct Mol Biol. 2009;16:691-697. [PubMed] [DOI] |
| 10. | Bishop B, Aricescu AR, Harlos K, O'Callaghan CA, Jones EY, Siebold C. Structural insights into hedgehog ligand sequestration by the human hedgehog-interacting protein HHIP. Nat Struct Mol Biol. 2009;16:698-703. [PubMed] [DOI] |
| 11. | Shida T, Furuya M, Nikaido T, Hasegawa M, Koda K, Oda K, Miyazaki M, Kishimoto T, Nakatani Y, Ishikura H. Sonic Hedgehog-Gli1 signaling pathway might become an effective therapeutic target in gastrointestinal neuroendocrine carcinomas. Cancer Biol Ther. 2006;5:1530-1538. [PubMed] [DOI] |
| 12. | Lau GK, Ye D. STAT3 implicated in the development of colon cancer: a step closer for targeted therapy? Gastroenterology. 2010;139:353-355. [PubMed] [DOI] |
| 13. | Pectasides E, Egloff AM, Sasaki C, Kountourakis P, Burtness B, Fountzilas G, Dafni U, Zaramboukas T, Rampias T, Rimm D. Nuclear localization of signal transducer and activator of transcription 3 in head and neck squamous cell carcinoma is associated with a better prognosis. Clin Cancer Res. 2010;16:2427-2434. [PubMed] [DOI] |
| 14. | Devarajan E, Huang S. STAT3 as a central regulator of tumor metastases. Curr Mol Med. 2009;9:626-633. [PubMed] [DOI] |
| 15. | Grivennikov SI, Karin M. Dangerous liaisons: STAT3 and NF-kappaB collaboration and crosstalk in cancer. Cytokine Growth Factor Rev. 2010;21:11-19. [PubMed] [DOI] |
| 16. | Berman DM, Karhadkar SS, Maitra A, Montes De Oca R, Gerstenblith MR, Briggs K, Parker AR, Shimada Y, Eshleman JR, Watkins DN. Widespread requirement for Hedgehog ligand stimulation in growth of digestive tract tumours. Nature. 2003;425:846-851. [PubMed] [DOI] |
| 17. | Neill GW, Ghali LR, Green JL, Ikram MS, Philpott MP, Quinn AG. Loss of protein kinase Calpha expression may enhance the tumorigenic potential of Gli1 in basal cell carcinoma. Cancer Res. 2003;63:4692-4697. [PubMed] |
| 18. | Fendrich V, Waldmann J, Esni F, Ramaswamy A, Mullendore M, Buchholz M, Maitra A, Feldmann G. Snail and Sonic Hedgehog activation in neuroendocrine tumors of the ileum. Endocr Relat Cancer. 2007;14:865-874. [PubMed] [DOI] |
| 19. | Ma XT, Wang S, Ye YJ, Du RY, Cui ZR, Somsouk M. Constitutive activation of Stat3 signaling pathway in human colorectal carcinoma. World J Gastroenterol. 2004;10:1569-1573. [PubMed] |
| 20. | Kusaba T, Nakayama T, Yamazumi K, Yakata Y, Yoshizaki A, Inoue K, Nagayasu T, Sekine I. Activation of STAT3 is a marker of poor prognosis in human colorectal cancer. Oncol Rep. 2006;15:1445-1451. [PubMed] |
| 21. | Nakashima H, Nakamura M, Yamaguchi H, Yamanaka N, Akiyoshi T, Koga K, Yamaguchi K, Tsuneyoshi M, Tanaka M, Katano M. Nuclear factor-kappaB contributes to hedgehog signaling pathway activation through sonic hedgehog induction in pancreatic cancer. Cancer Res. 2006;66:7041-7049. [PubMed] [DOI] |
| 22. | Schneider FT, Schänzer A, Czupalla CJ, Thom S, Engels K, Schmidt MH, Plate KH, Liebner S. Sonic hedgehog acts as a negative regulator of {beta}-catenin signaling in the adult tongue epithelium. Am J Pathol. 2010;177:404-414. [PubMed] [DOI] |
| 23. | Seto M, Ohta M, Asaoka Y, Ikenoue T, Tada M, Miyabayashi K, Mohri D, Tanaka Y, Ijichi H, Tateishi K. Regulation of the hedgehog signaling by the mitogen-activated protein kinase cascade in gastric cancer. Mol Carcinog. 2009;48:703-712. [PubMed] [DOI] |