修回日期: 2010-08-15
接受日期: 2010-08-24
在线出版日期: 2010-10-18
目的: 探讨火绒草水溶性提取物(LLAE)对D-半乳糖胺诱导的肝细胞损伤的影响.
方法: 建立D-半乳糖胺诱导的新生大鼠原代肝细胞损伤模型和HL-7702肝细胞损伤模型, 采用MTT方法研究LLAE的体外抗肝细胞损伤作用. 同时以AST、ALT和肝组织病理学改变为指标, 探讨LLAE对D-半乳糖胺诱导的小鼠肝损伤的影响.
结果: LLAE在10-100 mg/L浓度下, 明显改善了D-半乳糖胺诱导的新生大鼠原代肝细胞和HL-7702肝细胞的损伤(均P<0.01), 提高了细胞的生存能力. 在50 mg/kg和100 mg/kg剂量下, LLAE组较模型组能显著抑制D-半乳糖胺诱导的肝损伤小鼠血清AST和ALT的升高(115.28 IU/L±4.86 IU/L, 112.69 IU/L±3.72 IU/L vs 127.62 IU/L±6.34 IU/L, P<0.05或0.01; 78.11 IU/L±6.58 IU/L, 77.52 IU/L±5.05 IU/L vs 99.55 IU/L±10.26 IU/L, 均P<0.01), 对肝组织病理学改变有明显的改善作用.
结论: LLAE对D-半乳糖胺诱导的体内外肝细胞损伤具有明显保护作用.
引文著录: 宋雪英, 伍义行, 胡少青, 郝冰洁, 孟庆莉. 火绒草水溶性提取物对D-半乳糖胺致肝细胞损伤的抑制作用. 世界华人消化杂志 2010; 18(29): 3072-3077
Revised: August 15, 2010
Accepted: August 24, 2010
Published online: October 18, 2010
AIM: To investigate the hepatoprotective effect of Leontopodium leontopodioides against D-galactosamineN (D-GalN)-induced hepatocyte injury in vitro and in vivo.
METHODS: The in vitro protective effect of the aqueous extract of Leontopodium leontopodioides (AELL) against D-GalN-induced hepatocyte injury was studied using primary cultured neonatal rat hepatocytes and HL-7702 hepatocytes by MTT assay. The in vivo protective effect of AELL on D-GalN-induced liver injury was evaluated in mice by examining some parameters of hepatocyte injury, such as serum aspartate aminotransferase (AST), alanine aminotransferase (ALT) and histopathological alterations.
RESULTS: At concentrations of 10-100 mg/L, AELL significantly improved the viability of neonatal rat hepatocytes and HL-7702 hepatocytes (both P < 0.01). Compared with untreated model mice, oral administration of AELL at doses of 50 and 100 mg/kg significantly reduced serum AST and ALT levels and improved hepatocyte injury (115.28 IU/L ± 4.86 IU/L and 112.69 IU/L ± 3.72 IU/L vs 127.62 IU/L ± 6.34 IU/L, both P < 0.05 or 0.01; 78.11 IU/L ± 6.58 IU/L and 77.52 IU/L ± 5.05 IU/L vs 99.55 IU/L ± 10.26 IU/L, both P < 0.01).
CONCLUSION: AELL has a potent hepatoprotective effect against D-GalN-induced hepatocyte injury in vitro and in vivo.
- Citation: Song XY, Wu YH, Hu SQ, Hao BJ, Meng QL. Inhibitory effect of aqueous extract of Leontopodium leontopodioides against D-galactosamineN-induced hepatocyte injury. Shijie Huaren Xiaohua Zazhi 2010; 18(29): 3072-3077
- URL: https://www.wjgnet.com/1009-3079/full/v18/i29/3072.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i29.3072
火绒草[Leontopodium leontopodioides (Willd.) Beauv.]系菊科火绒草属植物的一种, 属多年生草本, 在我国分布广泛[1]. 火绒草作为一种民间常用的中草药, 也属于藏药和蒙药的范畴. 味微苦, 性寒, 具有清热解毒、凉血止血、益肾利水、消炎利尿之功效. 主治肾炎、支气管炎、流行性感冒、瘟病时疫等多种疾病[2,3]. 目前从火绒草700 mL/L乙醇提取物的正丁醇部分共分得5个单体: 咖啡酸、香草酸、原儿茶醛、反式桂皮酸和一种含有酚羟基的醛类化合物; 从950 mL/L乙醇提取物的甲醇部分又分离出两种单体: 阿魏酸和β-谷甾醇[4]. 李礼等[5]从火绒草正丁醇部分中分离得到了5个化合物, 分别为小檗碱、胡萝卜苷、β-谷甾醇、香草酸和咖啡酸. 尤献民等[6]从火绒草中分离出火绒草多糖, 并测定其含量为4.57%-8.39%. 陈行烈等[7]从火绒草中分离出桉醇、喇叭茶醇及法呢醇等27种化合物. 此外, 火绒草中还含有乔松素、5-hydroxyobliquin和槲皮素等[8,9].
从火绒草中分离出的咖啡酸、香草酸、原儿茶醛, 经实验证明是治疗急、慢性肾炎的主要有效成分. 火绒草水提液具有降血糖和利尿作用, 其醇提物还具有有明显的镇痛、镇静作用, 并且对治疗免疫复合物性疾病有明显抑制作用[10,11]. 此外, 火绒草水提物、醇提物及其分离组分还具有较强的抗炎免疫作用. 目前对火绒草的研究主要停留在其抗炎和降血糖作用上, 其他药理活性鲜有报道, 尤其是民间用来治疗肝炎并取得显著疗效的相关药理活性国内外尚未见报道.
水飞蓟宾(陕西森佛生物有限公司); D-氨基半乳糖(武汉祥和精细化工有限公司); 1640培养基(Invitrogen Corporation产品); 胎牛血清(杭州四季青生物工程材料有限公司); 胰酶, MTT(上海生工生物工程技术服务有限公司); 谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)试剂盒(南京建成生物工程研究所产品); 二甲基亚砜(dimethyl sulfoxide, DMSO; 无锡海硕生物有限公司). 正常组织来源的人肝细胞株HL-7702(中国科学院上海细胞所提供). 1 d龄SD大鼠, 清洁级; ICR小鼠, ♂, 清洁级, 体质量20 g±2 g, 由浙江省实验动物中心提供, 动物许可证号: SCXK(浙)2008-0033.
1.2.1 火绒草水溶性提取物的制备: 火绒草全草, 采自青藏高原甘南草原(甘南藏族自治州临潭县城关镇), 标本保存于中国计量学院植物化学综合实验室. 药材阴干后, 切成小段, 用950 mL/L的乙醇分别提取3次, 合并3次提取液, 静置除去沉淀, 减压回收溶剂, 获得乙醇浸膏. 每批提取500 g, 按同样的方法提取20批. 取乙醇浸膏用热水溶解后, 分别用石油醚、乙酸乙酯、正丁醇萃取后, 浓缩获得水溶性提取物(Leontopodium leontopodioides aqueous extract, LLAE)335 g, 供药理研究用.
1.2.2 新生大鼠原代肝细胞分离培养: 取1 d龄新生大鼠, 置于750 mL/L乙醇中浸泡消毒后, 打开腹腔取出肝脏, 放入预置PBS的青霉素瓶中; 加入适量PBS冲洗肝脏上的血污, 将肝脏剪成细颗粒; 转移到10 mL离心管中, 再加入PBS反复吹打后, 离心吸弃上清; 加入约5倍量0.25%胰酶液, 吹打混匀, 置37 ℃培养箱消化30 min, 使细胞分离; 加1640培养液(含100 mL/L胎牛血清)至10 mL, 吹打混匀, 离心吸弃上清; 再加入1640培养液吹打混匀, 用100目钢筛过滤; 收集滤液于另一10 mL离心管, 置CO2培养箱孵育15 min; 将细胞悬液用200目钢筛过滤, 收集滤液, 离心吸弃上清, 加入PBS洗涤3次; 末次洗涤后, 吸弃上清, 加入1640培养液重悬, 即可得到肝细胞悬液; 台盼蓝拒染法检测细胞存活率; 用培养液将细胞悬液稀释调整至5.0×105个/mL浓度; 将稀释的肝细胞悬液分别加入96孔板, 每孔200 µL, 置37 ℃下CO2培养箱中进行原代培养.
1.2.3 人正常肝细胞株HL-7702的培养: HL-7702细胞采用含100 mL/L胎牛血清的RPMI 1640培养液, 置37 ℃下, 含50 mL/L CO2培养箱中进行常规培养.
1.2.4 LLAE对原代肝细胞的毒性研究: 原代肝细胞分离后, 加入96孔板置37 ℃下培养. 待肝细胞贴壁后, 弃去培养液, 分别加入不同浓度的实验药液(先用少量DNSO溶解, 再用培养基稀释至所需浓度)各200 µL, 每一浓度设4个复孔, 同时设溶剂对照. 继续培养48 h后, 每孔加入20 µL MTT(5 g/L), 作用4 h, 吸弃上清, 加入150 µL DMSO, 振荡混匀. 在620 nm波长下, 用酶标仪测定A值. 根据肉眼观察和A值判断样品本身对细胞的毒性, 以决定实验样品的浓度.
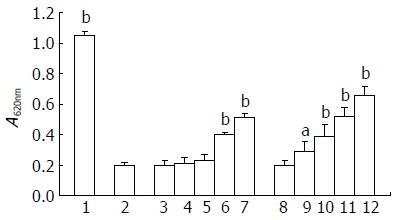
1.2.5 LLAE对D-GalN致新生大鼠原代肝细胞损伤的影响: 原代肝细胞分离后, 加入96孔板置37 ℃下培养. 待肝细胞贴壁后, 更换培养液, 加入20 mol/L的D-GalN, 作用8 h. 然后弃去培养液, 分别加入不同浓度的实验药液各200 µL(LLAE设5个浓度梯度, 分别为1、10、25、50、100 mg/L). 每浓度设6个复孔, 同时设溶剂和阳性对照水飞蓟膑(Silybin, 设5个浓度梯度, 分别为1、10、25、50、100 mg/L).
1.2.6 LLAE对HL-7702肝细胞的毒性研究: HL-7702肝细胞加入96孔板后, 置37 ℃下CO2培养箱中培养至贴壁, 弃去培养液, 分别加入不同浓度的实验药液(先用少量DMSO溶解, 再用培养基稀释至所需浓度)各200 µL, 每一浓度设4个复孔, 同时设溶剂对照. 继续培养48 h后, 每孔加入20 µL MTT(5 g/L), 作用4 h, 吸弃上清, 加入150 µL DMSO, 振荡混匀; 在620 nm波长下, 用酶标仪测定A值. 根据肉眼观察和A值判断样品本身对细胞的毒性, 以决定实验样品的浓度.
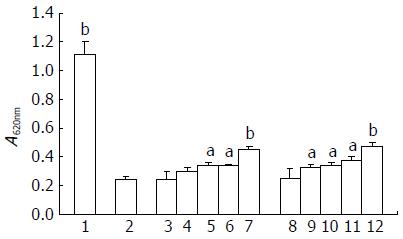
1.2.7 LLAE对D-GalN致HL-7702肝细胞损伤的影响: 待96孔板中HL-7702肝细胞贴壁后, 更换培养液, 加入40 mmol/L的D-GalN作用8 h; 然后弃去培养液, 分别加入不同浓度的试验药液各200 µL(LLAE设5个浓度梯度, 即1、10、25、50、100 mg/L), 每一浓度设4个复孔, 同时设溶剂和阳性对照Silybin, Silybin也设5个浓度梯度, 即1、10、25、50、100 mg/L. 每孔200 μL, 每浓度设6个复孔; 继续培养48 h后, 每孔加入20 μL MTT, 作用4 h, 吸弃上清, 加入150 μL DMSO, 振荡混匀; 在620 nm波长下, 用酶标仪测定A值.
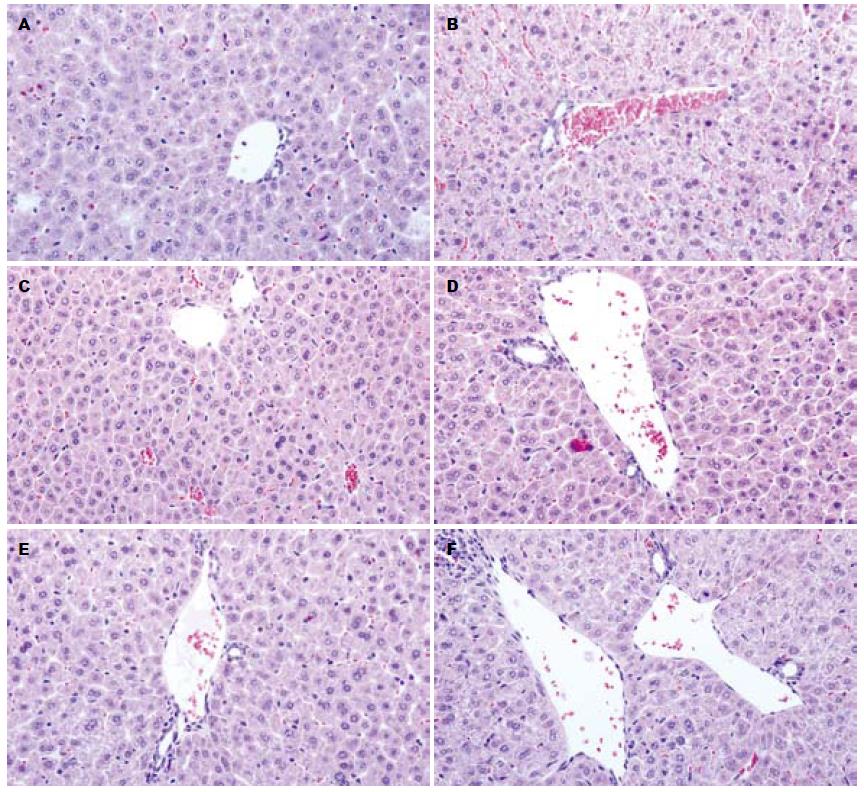
1.2.8 LLAE对D-GalN致小鼠肝损伤的影响: ♂ICR小鼠60只, 随机分成6个组: 溶剂对照组(0.5% CMC-Na 10 mL/kg)、模型组(0.5% CMC-Na 10 mL/kg)、50 mg/kg Silybin组、25 mg/kg LLAE组、50 mg/kg LLAE组和100 mg/kg LLAE组, 每组10只. 分组后灌胃给药(10 mL/kg), 每天1次, 连续4 d. 末次给药后1 h, 除正常组外, 均参加造模. 用生理盐水将D-GalN配成10%溶液, 用前振荡混匀. 一次性腹腔注射1 000 mg/kg致毒. 注射毒物后禁食过夜, 以提高肝损伤效果. 末次给药24 h后, 摘眼球取血, 分离血清, 按试剂盒说明检测AST和ALT; 同时取肝组织放入甲醛溶液中固定, 用于制作病理切片.
统计学处理 统计分析采用SPSS10.0软件处理. 实验数据以mean±SD表示, 采用单因素方差分析(ANOVA)和t检验统计, P<0.05表示差异具有显著性.
LLAE在1-100 mg/L浓度下对新生大鼠原代肝细胞和HL-7702肝细胞的正常生长没有影响.
LLAE在10-100 mg/L浓度时, 对D-GalN诱导的原代肝细胞损伤均有显著的保护作用(P<0.01或0.05), 而阳性对照Silybin显示了相似的影响(均P<0.05, 图1), 说明LLAE具有较强的抗D-GalN肝损伤作用.
模型组与LLAE组比较具有显著性差异, LLAE在10-100 mg/L浓度时, 对D-GalN致肝细胞损伤有明显的保护作用(P<0.01或0.05), 阳性对照Silybin显示了相似的保护的作用(P<0.01或0.05, 图2), 说明该样品具有较强的抗D-GalN损伤作用.
LLAE在50和100 mg/kg剂量下能显著降低D-GalN急性肝损伤小鼠血清AST水平, 在25、50和100 mg/kg剂量下能显著降低D-GalN急性肝损伤小鼠血清ALT水平, 且其抗D-GalN肝损伤作用比阳性药物Silybin稍强(表1). 病理形态学主要表现为弥漫性的多发性片状坏死, 脂肪变性不甚明显, LLAE和Silybin能明显改善D-GalN导致的小鼠肝组织损伤(图3).
肝炎是肝脏发生炎性病变的总称, 根据病因可分为病毒性、酒精性、药源性和自身免疫性肝炎等, 以病毒性肝炎为多见, 其中以乙型肝炎为主, 丙型肝炎次之. 据统计目前全世界约有3.5亿HBV携带者, 而中国是HBV高感染地区, HBV携带者占总人口比例高达10%-15%, 其中慢性乙肝患者约3 000万例, 每年约有35万人死于慢性乙肝相关疾病[12]. 在肝炎发病机制中, 肝细胞损伤是各型肝炎共同的病理基础, 治疗与纠正肝细胞损伤是各型肝病治疗的主要措施之一. 在肝炎临床治疗中, 一般采用综合疗法, 即抗病毒药、免疫增强剂及保肝药物配合治疗, 抗病毒药、免疫增强剂着重于清除体内病毒, 保肝药物着重于肝脏功能的恢复. 目前真正有效的抗病毒药寥寥无几, 临床常用的拉米呋啶等核苷类似物和干扰素, 也无法清除病毒. 因此, 在肝炎治疗中, 抗病毒药、免疫增强剂及保肝药都十分重要, 而保肝药物对减少肝细胞破坏、延缓慢性肝病的发展具有重要的意义.
D-GalN诱导的肝损伤模型是最常用的保肝药物评价模型之一. Keppler等[13]于1968年首次应用D-GalN制备大鼠肝损伤模型, 认为其肝脏病理和生化改变与人类病毒性肝炎极为相似, 也能发展为肝性脑病, 其可逆性、专一性和重复性均较好. 经反复多次给药, D-GalN也能诱发动物产生包括纤维化过程在内的慢性肝损伤以及癌变. 过去认为D-GalN是一种肝细胞磷酸尿嘧啶核苷干扰剂, 能竞争性捕捉UTP生成二磷酸尿苷半乳糖(UTP-galactose, UTP-gal), 使磷酸鸟苷耗竭, 导致物质代谢严重障碍, 引起肝细胞变性、花丝; 解毒机制障碍更加剧了D-GalN的毒性作用[14]. 进一步研究认为自由基和脂质过氧化反应在D-GalN引起的肝损伤中起着十分重要的作用.
肝细胞内的线粒体和内质网含有代谢酶系、单胺氧化酶系、黄嘌呤氧化还原酶系等, 线粒体内膜上的氧化呼吸链系统是自由基的产生部位. 机体通过物质代谢的电子传递过程和对外源性物质代谢产生自由基. 正常情况下体内存在自由基清除系统(如超氧化物歧化酶、谷胱甘肽超氧化物酶、过氧化氢酶等), 机体产生的少量自由基不会引起肝损伤. 但当自由基的产生超过机体清除能力时, 主要通过改变蛋白质立体结构, 直接损伤肝细胞生命必需基因, 消耗自由基清除剂, 启动机体脂质过氧化反应等途径, 引起肝细胞损伤. 脂质过氧化反应是体内不饱和脂肪酸在自由基和某些酶类作用下, 所发生的一系列过氧化反应, 正常状态下肝脏中由于含有大量谷光苷肽等抗氧化物质, 限制了过氧化程度. 但在病理条件下, 大量自由基的产生以及自由基的清除剂过度消耗后, 便可启动脂质过氧化反应, 导致肝细胞损伤.
保肝药物评价除了采用体内模型外, 还可采用体外模型评价. 由于肝炎发生机制非常复杂, 目前对其病理过程仍缺乏足够认识, 尚无可靠的分子评价模型. 因此, 细胞模型仍是保肝药物体外评价的可靠选择. 培养体系中的肝细胞尤其是原代肝细胞, 可以很好的模拟体内肝脏的生理环境, 在研究外源性化合物的药理活性、毒性、代谢特性等方面有良好的预测作用, 与体内模型研究结果具有很好的相关性, 可作为肝脏药物评价的可靠模型[15]. 原代肝细胞排除了血液、神经、体液等因素的影响, 具有体内肝细胞的一些功能及特性, 特别是还保留有药物代谢酶的活性, 兼备体外实验和整体实验的优点. 有文献报道, 采用成年大鼠肝脏灌流的方法分离肝细胞进行原代培养, 建立肝细胞损伤模型, 考察药物对化学毒物导致的肝细胞损伤的保护作用[16,17]. 但该方法细胞成活率不高, 模型不够稳定.
鉴于此, 本研究分离1 d龄新生大鼠肝细胞进行原代培养, 建立D-GalN诱导的新生大鼠原代肝细胞损伤模型, 该模型细胞成活率高, 重复性好. 在此基础上, 采用MTT方法研究LLAE对D-GalN诱导的新生大鼠原代肝细胞和人正常组织来源的HL-7702肝细胞损伤的保护作用. 在体外实验的基础上, 进一步以AST、ALT和肝组织病理学改变为指标, 探讨了LLAE对D-GalN诱导的小鼠肝损伤的影响. 研究表明, LLAE明显改善了D-GalN诱导的新生大鼠原代肝细胞和HL-7702肝细胞的损伤, 提高了细胞的生存能力. 并且还能显著抑制D-GalN诱导的肝损伤小鼠血清AST和ALT的升高, 对肝组织病理学改变有明显改善作用. 提示LLAE对D-GalN诱导的体内外肝细胞损伤具有较强的保护能力, 其抗肝损伤机制可能与清除自由基和抑制脂质过氧化反应有关. 该研究为火绒草药效机制的深入研究和临床应用提供了科学依据.
对火绒草的研究主要停留在其抗炎和降血糖作用上, 其他药理活性鲜有报道, 尤其是民间用来治疗肝炎并取得显著疗效的相关药理活性国内外尚未见报道.
李康, 副教授, 广东药学院药科学院药物分析教研室
肝损伤伴随肝病发展的全部过程, 是各型肝炎共同的病理基础, 治疗与纠正肝细胞损伤是肝病治疗的主要措施之一. 从传统中药中筛选安全高效的有效部位及其活性成分, 是中药现代化和抗肝炎创新药物研制的重要方向之一.
李礼等从火绒草正丁醇部分中分离得到了5种化合物, 分别为小檗碱、胡萝卜苷、β-谷甾醇、香草酸和咖啡酸. 尤献民等从火绒草中分离出火绒草多糖, 并测定其含量为4.57%-8.39%.
本研究首次采用D-GalN诱导的大鼠原代肝细胞和人源肝细胞损伤模型以及小鼠肝损伤模型, 系统地研究了火绒草水溶性提取物的保肝作用.
本研究为火绒草及其提取物的深入开发利用打下了基础, 同时也为该植物的民间应用和中医临床用药提供了一定的科学依据.
本文设计合理, 方法恰当, 对研究肝细胞损伤的抑制作用有一定的参考价值.
编辑: 李军亮 电编:何基才
| 1. | 中国科学院中国植物志编辑委员会. 中国植物志(第75卷). 北京: 科学出版社 1979; 136. |
| 3. | 江苏新医学院. 中药大辞典(上册). 上海: 上海科学技术出版公司. 2009;840. |
| 7. | 陈 行烈, 张 惠迪. 藏药火绒草挥发油化学成分的研究. 新疆大学学报(自然科学版). 1989;6:61. |
| 8. | Dobner MJ, Ellemer EP, Schwaiger S, Batsugkh O, Narantuya S, Stütz M, Stuppner H. New lignan, benzofuran, and sesquiterpene derivatives from the roots of Leontopodium alpinum and L. leontopodioides. Helv Chim Acta. 2003;86:733-738. [DOI] |
| 13. | Keppler D, Lesch R, Reutter W, Decker K. Experimental hepatitis induced by D-galactosamine. Exp Mol Pathol. 1968;9:279-290. [PubMed] [DOI] |
| 14. | Decker K, Keppler D. Galactosamine induced liver injury. Prog Liver Dis. 1972;4:183-199. [PubMed] |
| 15. | Vinken M, Papeleu P, Snykers S, De Rop E, Henkens T, Chipman JK, Rogiers V, Vanhaecke T. Involvement of cell junctions in hepatocyte culture functionality. Crit Rev Toxicol. 2006;36:299-318. [PubMed] [DOI] |
| 17. | 郑 芹珠, 王 立明, 楼 宜嘉. 卡介苗联合脂多糖诱发大鼠原代培养肝细胞免疫性损伤模型的构建. 浙江大学学报(医学版). 2002;31:419-423, 456. |