修回日期: 2010-07-29
接受日期: 2010-08-03
在线出版日期: 2010-09-28
目的: 探讨CD4+CD25+Foxp3+ Treg在葡聚糖硫酸钠(DSS)诱发的UC小鼠模型中的变化情况以及白藜芦醇对溃疡性结肠炎(UC)治疗的可能机制.
方法: 采用DSS制作UC小鼠模型, 小鼠随机分成4组: 正常对照(NC)组, 模型(MD)组, 低剂量(RLD)、高剂量(RHD)白藜芦醇治疗组. 造模7 d后停用造模药物, 给予白藜芦醇后继续治疗7 d. 14 d后, 处死小鼠, 结肠行HE染色和病理学评分(HDS); 流式细胞仪检测外周血和肠系膜淋巴细胞CD4+CD25+Foxp3+ Treg细胞占CD4+ T淋巴细胞的百分率.
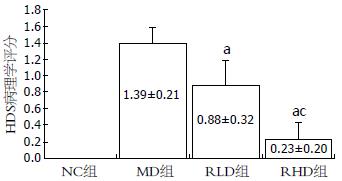
结果: MD组HDS明显高于NC组(P<0.05); RLD和RHD组的HDS明显低于MD组(0.88±0.32, 0.23±0.20 vs 1.39±0.21, 均P<0.05); RHD组的HDS明显低于RLD组(P<0.05). RLD和RHD组结肠外周血和肠系膜淋巴细胞CD4+CD25+Foxp3+ Treg细胞占CD4+ T淋巴细胞的百分率明显高于MD组(均P<0.05), 低于NC组(均P<0.05); RHD组外周血和肠系膜淋巴细胞CD4+CD25+Foxp3+ Treg细胞占CD4+ T淋巴细胞的百分率高于RLD组(均P<0.05).
结论: 白藜芦醇可以提高CD4+CD25+Foxp3+ Treg数量, 调节机体和肠道免疫功能, 对UC的治疗发挥了一定的作用.
引文著录: 姚君, 王立生, 李迎雪, 王建尧, 孙丽萍, 莫镜, 邵聪文. 白藜芦醇对溃疡性结肠炎小鼠外周血和肠系膜淋巴结CD4+CD25+Foxp3+调节T淋巴细胞表达的影响. 世界华人消化杂志 2010; 18(27): 2905-2908
Revised: July 29, 2010
Accepted: August 3, 2010
Published online: September 28, 2010
AIM: To investigate the mechanism behind the therapeutic effect of resveratrol against ulcerative colitis (UC).
METHODS: UC was induced in mice by oral administration of synthetic dextran sulfate sodium for 7 d. Mice were divided into four groups: normal control (NC) group, colitis model (MD) group, low-dose reservatrol (RLD) group, and high-dose reservatrol (RHD) group. The RLD and RHD groups were given low- and high-dose reservatrol for 7 d, respectively, while the NC and MD groups were given normal drinking water. The percentages of CD4+CD25+Foxp3+/CD4+ regulatory T cells (Treg) in peripheral blood and mesenteric lymph nodes of these mice were detected by flow cytometry.
RESULTS: The HDS was significantly higher in the MD group than in the NC group, but significantly lower in the RLD and RHD groups than in the MD group (0.88 ± 0.32 and 0.23 ± 0.20 vs 1.39 ± 0.21, both P < 0.05). The percentages of CD4+CD25+Foxp3+/CD4+ Treg in peripheral blood and mesenteric lymph nodes in the RLD and RHD groups were significantly higher than those in the MD group (all P < 0.05), but lower than those in NC group (all P < 0.05). The percentages of CD4+CD25+Foxp3+/CD4+ Treg in peripheral blood and mesenteric lymph nodes in the RHD group were higher than those in the RLD group (all P < 0.05).
CONCLUSION: Reservatrol inhibits colonic inflammation in UC possibly by increasing the percentages of CD4+CD25+Foxp3+ Treg in peripheral blood and mesenteric lymph nodes.
- Citation: Yao J, Wang LS, Li YX, Wang JY, Sun LP, Mo J, Shao CW. Resveratrol increases the percentages of CD4+CD25+Foxp3+ regulatory T cells in peripheral blood and mesenteric lymph nodes of mice with ulcerative colitis. Shijie Huaren Xiaohua Zazhi 2010; 18(27): 2905-2908
- URL: https://www.wjgnet.com/1009-3079/full/v18/i27/2905.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i27.2905
溃疡性结肠炎(ulcerative colitis, UC)又称慢性非特异性UC, 是一种病因不明的直肠和结肠慢性炎症疾病, 但主要认为本病与免疫、遗传和环境等多种因素相互作用有关[1]. 调节性T淋巴细胞(regulatory T cell, Treg)是能抑制其他免疫细胞活化、增殖的一群细胞, 在维持自身内环境的稳定、防止自身免疫性疾病的发生中发挥重要的保护作用. 白藜芦醇是广泛存在葡萄、花生和多种植物中的一种酚类化合物. 他具有多种生物学活性: 调节免疫, 抗炎, 抗氧化, 抗肿瘤、促进肿瘤细胞凋亡, 抗心血管疾病等作用, 此外还能减轻多种因素造成的组织器官损伤及保护肝细胞的作用[2-4]. 本实验拟研究白藜芦醇对UC的免疫调节作用.
BALB/c, ♂, 周龄6-8 wk, 40只, SPF级, 购于广东省实验动物中心, 合格证号SCXK粤2008-0002, 标准饲养, 自由饮水, 日常光照. 白藜芦醇购于深圳汇鑫荣生物有限公司(纯度≥99%, 编号: 090226). DSS(相对分子质量5 000 Da)购于广州齐云生物科技有限公司. 1640淋巴细胞分离液、胶原酶Ⅲ购于广州斯佳公司, 小鼠Treg流式染色试剂盒购于eBioscience.
1.2.1 模型的制备与药物干预: 40只小鼠随机分成4组, 每组10只: 正常对照(NC)组、模型(MD)组、低剂量白藜芦醇治疗组RLD组[50 mg/(kg•d)]和高剂量白藜芦醇RHD组[100 mg/(kg•d)]治疗组. 正常对照组饮用蒸馏水, 模型组与白藜芦醇治疗组饮用5%葡聚糖硫酸钠(dextran sulfate sodium, DSS)蒸馏水7 d后, 然后模型组与白藜芦醇治疗组5% DSS饮用水换为无DSS饮用蒸馏水再连续7 d. 造模第8天开始, 正常对照组与模型组, 每日0.2 mL 5 mL/L乙醇灌胃7 d; 白藜芦醇治疗组按上述低、高剂量溶于0.2 mL 5 mL/L乙醇灌胃7 d. 14 d后全部小鼠处死, 取距肛门1 cm上的结肠组织行病理切片, 并取外周血和肠系膜淋巴结.
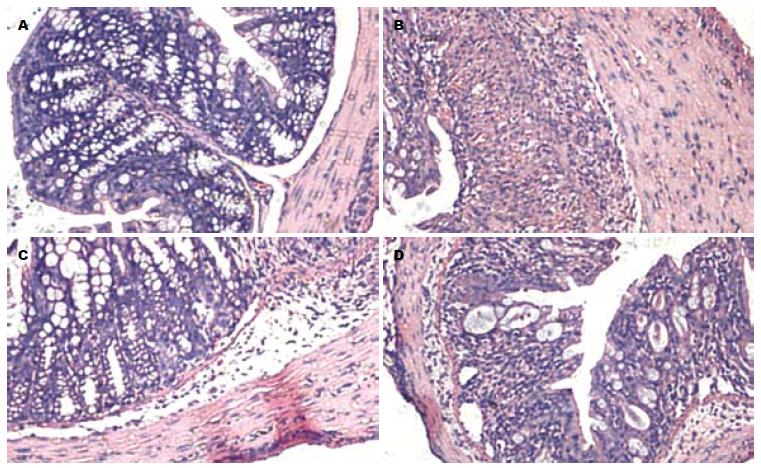
1.2.2 小鼠结肠炎组织病理学评估: 取新鲜的小鼠结肠组织, 40 g/L甲醛溶液固定24 h, 行脱水、透明、浸蜡后包埋组织, 病理切片行苏木精-伊红(HE)染色, 镜下观察. 放大100倍的切片随机选择8处评分并取均值, HDS评分系统[5]: 0分为正常肠黏膜; 1分为缺少1/3隐窝; 2分为缺少2/3隐窝; 3分为固有层被单层上皮细胞覆盖和较少的炎症细胞浸润; 4分为炎症细胞数量增多并有炎症细胞明显浸润.
1.2.3 流式细胞法检测: 摘取小鼠摘眼球取血400 μL放入EDTA抗凝管后, 与等体积无血清1640混匀后, 按淋巴细胞分离液说明书分离全血淋巴细胞. 摘取小鼠肠系膜淋巴结后, 去外膜与脂肪组织后, 切成0.5 cm×0.5 cm的小块, 在0.1%的胶原酶Ⅲ中37 ℃孵育20 min后, 取组织块200目不锈钢筛网研磨, 无血清1640制成细胞悬液与4 ℃保存. 将全血淋巴细胞和肠系膜淋巴细胞悬液溶于1×流式染色缓冲液后, 将细胞数调到1×106/管, 分别按试剂盒要求标记抗小鼠CD4+ 0.125 μg/管和CD25+ 0.06 μg/管单克隆抗体后, 清洗离心后, 固定/透化工作液4 ℃避光孵育12 h穿孔后, 行核内Foxp3+ 0.5 μg/管抗体标记, 设抗IgG2a为同型阴性对照, 4 ℃避光孵育30 min, 清洗液清洗2遍, 流式细胞仪上机检测.
统计学处理 实验数据均以mean±SD表示. 全部资料利用SPSS13.0统计软件进行统计分析,组间的比较采用单因素方差分析. P<0.05为有统计学意义.
UC是一种病因未明的侵犯结肠的自身免疫性疾病. Treg在UC中有重要的免疫调节作用, Treg分为CD4+CD25+Treg、Tr1和Tr3等多种亚型, CD4+CD25+Treg对UC有预防和治疗作用, 其功能异常或数量减少均可发生导致自身免疫性疾病发生[6].
Foxp3是新近发现的转录因子, 属于foxhead家族成员, 对CD4+CD25+Treg表达、成熟及功能发挥起到了关键的作用, 仅有Foxp3表达的CD4+CD25+Treg才具有免疫调节作用[7]. 成熟树突状细胞能够诱导自体CD4+CD25-Treg向CD4+CD25+Treg转化, 其作用依赖于Foxp3[8], Foxp3敲除小鼠诱生发的自身免疫病. 本研究显示, 在DSS诱导的结肠炎小鼠模型中其肠系膜淋巴结CD4+CD25+Foxp3+/CD4+百分率下降, 证实了CD4+CD25+Treg数量减少引起小鼠免疫调节能力下降, 抑制了肠道Treg的功能, 诱发了肠道炎症的发生; 同时, 全血的CD4+CD25+Foxp3+/CD4+百分率也有明显的下降, 证实了有局部肠道炎症和免疫紊乱, 引起了宿主机体的自发免疫反应; 另由病理切片的宏观表现和病理评分观察, 可以证实, 肠道为炎症急性期, 有黏膜糜烂、水肿、隐窝减少、中性粒细胞侵入黏膜层和固有层, 炎症表现明显. 进一步证实CD4+CD25+Foxp3+Treg于UC的密切相关性, 在结肠炎的发生发展过程的重要作用. 本研究通过给予结肠炎小鼠白藜芦醇干预治疗后, 发现肠道炎症病理改变明显缓解, 糜烂、水肿、炎细胞浸润等较模型组减轻; 同时, 全血与肠系膜淋巴结内淋巴细胞CD4+CD25+Foxp3+/CD4+百分率较模型组提高, 而且, RHD组百分率高于RLD组. 考虑有以下原因: (1)白藜芦醇的调节免疫功能, 通过增加Foxp3+的表达, 可以改善肠道免疫状态, 对肠道内CD4+CD25+Treg有一定的恢复和激活作用, 减轻了肠道的局部炎症反应, 从而使紊乱的肠道免疫状态得到了相应的恢复. (2)同时, 从全血内CD4+CD25+Foxp3+Treg百分率的提高可以得出, 肠道免疫功能的恢复和平衡及肠道炎症反应的减轻, 进一步对全身免疫系统形成了一种良性反馈作用, 使结肠炎诱发的宿主自身免疫紊乱得到了改善, 利于自身免疫性疾病的恢复. (3)白藜芦醇本身具有一定的抗炎作用, 抑制了肠道炎症负反馈环路, 减少中性粒细胞数量, 并抑制中性粒细胞和分泌、增殖和过度表达的活化状态, 缓解肠道内皮细胞肿胀及通透性的增加. (4)白藜芦醇治疗过程中, 有一定的剂量依赖性, 高剂量的效果优于低剂量. 既往研究证实, 白金叶等[9]发现白藜芦醇具有抑制LTB4、LTC4和LTD4生成作用. 高路等[10]利用白藜芦醇通过对巨噬细胞吞噬率、血清抗体形成数量和淋巴细胞转化率的研究, 发现其调节免疫功能的作用显著. 新近研究也表明[11], 白藜芦醇通过抑制UC小鼠NF-κB通路, 也发挥了一定的抗炎作用, 与本研究结论相一致.
总之, 白藜芦醇通过增加Foxp3+表达, 可以提高CD4+CD25+Foxp3+Treg数量和功能, 通过调节肠道过度的免疫反应和抗炎作用, 对UC发挥了一定的治疗效果. 此外, 由于结肠炎是一种长期慢性反复的肠道免疫炎性疾病, 结肠细胞突变率明显增高, 可导致结肠癌[12]. 而白藜芦醇则具有诱导肿瘤细胞凋亡及抗肿瘤的作用[13,14], 也提高了他在UC治疗中的药用价值. 故作为一种天然药物有多方面的药理活性, 其临床应用前景广阔, 有望发展成为UC的新一代预防与治疗的药物.
溃疡性结肠炎作为一种病因未明的侵犯直肠和结肠的自身免疫性疾病, 患者免疫系统的紊乱不容忽视. 调节性T淋巴细胞(Treg)是能抑制其他免疫细胞活化、增殖的一群细胞, 在维持自身内环境的稳定、防止自身免疫性疾病的发生中发挥重要的保护作用.
秦成勇, 教授, 山东省立医院消化内科
相关报道 白金叶等发现白藜芦醇具有抑制LTB4、LTC4和LTD4生成的作用. 高路等利用白藜芦醇通过对巨噬细胞吞噬率、血清抗体形成数量和淋巴细胞转化率的研究, 发现其调节免疫功能的作用显著.
本文通过纯天然植物提取物白藜芦醇作用于溃疡性结肠炎小鼠, 并对其免疫细胞进行深入研究, 发现其对结肠炎小鼠具有免疫调节功能, 对结肠炎具有治疗作用.
本文选题尚可, 思路清晰, 设计合理, 方法先进, 对溃疡性结肠炎的进一步基础理论研究有促进作用.
编辑: 曹丽鸥 电编:何基才
| 1. | Sartor RB. Therapeutic manipulation of the enteric microflora in inflammatory bowel diseases: antibiotics, probiotics, and prebiotics. Gastroenterology. 2004;126:1620-1633. [PubMed] [DOI] |
| 2. | Park HJ, Jeong SK, Kim SR, Bae SK, Kim WS, Jin SD, Koo TH, Jang HO, Yun I, Kim KW. Resveratrol inhibits Porphyromonas gingivalis lipopolysaccharide-induced endothelial adhesion molecule expression by suppressing NF-kappaB activation. Arch Pharm Res. 2009;32:583-591. [PubMed] [DOI] |
| 3. | Kubota S, Kurihara T, Mochimaru H, Satofuka S, Noda K, Ozawa Y, Oike Y, Ishida S, Tsubota K. Prevention of ocular inflammation in endotoxin-induced uveitis with resveratrol by inhibiting oxidative damage and nuclear factor-kappaB activation. Invest Ophthalmol Vis Sci. 2009;50:3512-3519. [PubMed] [DOI] |
| 4. | Sha HC, Ma QY, Jha RK, Ma ZH, Zhang M. [Protective effect of resveratrol on intestinal mucosal barrier in rats with severe acute pancreatitis]. Sichuan Daxue Xuebao Yixueban. 2008;39:740-743. [PubMed] |
| 5. | Hirata I, Yasumoto S, Toshina K, Inoue T, Nishikawa T, Murano N, Murano M, Wang FY, Katsu K. Evaluation of the effect of pyrrolidine dithiocarbamate in suppressing inflammation in mice with dextran sodium sulfate-induced colitis. World J Gastroenterol. 2007;13:1666-1671. [PubMed] |
| 6. | Yu QT, Saruta M, Avanesyan A, Fleshner PR, Banham AH, Papadakis KA. Expression and functional characterization of FOXP3+ CD4+ regulatory T cells in ulcerative colitis. Inflamm Bowel Dis. 2007;13:191-199. [PubMed] [DOI] |
| 7. | Kamikozuru K, Fukunaga K, Hirota S, Hida N, Ohda Y, Yoshida K, Yokoyama Y, Tozawa K, Kawa K, Iimuro M. The expression profile of functional regulatory T cells, CD4+CD25high+/forkhead box protein P3+, in patients with ulcerative colitis during active and quiescent disease. Clin Exp Immunol. 2009;156:320-327. [PubMed] [DOI] |
| 8. | Zheng SG, Wang JH, Gray JD, Soucier H, Horwitz DA. Natural and induced CD4+CD25+ cells educate CD4+CD25- cells to develop suppressive activity: the role of IL-2, TGF-beta, and IL-10. J Immunol. 2004;172:5213-5221. [PubMed] |
| 10. | 高 路, 袁 育康, 吕 卓人, 范 桂香, 王 军阳, 任 会勋. 白藜芦醇的免疫调节作用. 西安交通大学学报(医学版). 2003;24:121-123. |
| 11. | Singh UP, Singh NP, Singh B, Hofseth LJ, Price RL, Nagarkatti M, Nagarkatti PS. Resveratrol (trans-3,5,4'-trihydroxystilbene) induces silent mating type information regulation-1 and down-regulates nuclear transcription factor-kappaB activation to abrogate dextran sulfate sodium-induced colitis. J Pharmacol Exp Ther. 2010;332:829-839. [PubMed] [DOI] |
| 12. | Eaden JA, Abrams KR, Mayberry JF. The risk of colorectal cancer in ulcerative colitis: a meta-analysis. Gut. 2001;48:526-535. [PubMed] |
| 13. | Bai Y, Mao QQ, Qin J, Zheng XY, Wang YB, Yang K, Shen HF, Xie LP. Resveratrol induces apoptosis and cell cycle arrest of human T24 bladder cancer cells in vitro and inhibits tumor growth in vivo. Cancer Sci. 2010;101:488-493. [PubMed] [DOI] |
| 14. | Choi HY, Chong SA, Nam MJ. Resveratrol induces apoptosis in human SK-HEP-1 hepatic cancer cells. Cancer Genomics Proteomics. 2009;6:263-268. [PubMed] |