修回日期: 2010-07-28
接受日期: 2010-08-03
在线出版日期: 2010-09-28
目的: 研究抑酸治疗对电切创面周边组织中结缔组织生长因子(CTGF)、表皮生长因子受体(EGFR)水平的影响.
方法: 60只SD大鼠, 随机分为4组: 正常对照组6只, 未治疗组18只, 雷尼替丁组18只, 奥美拉唑组18只. 除正常对照组外, 对其他动物经腹壁切口及胃窦前壁切口进入胃腔, 对胃窦后壁黏膜行电切. 术后, 各组分别给予雷尼替丁[11 mg/(kg•d)]、奥美拉唑[1.8 mg/(kg•d)]行尾静脉注射, 未治疗组则用等量生理盐水代替. 术后1、2、4 wk, 用免疫组织化学法测定电切创面周边胃黏膜中CTGF及EGFR的变化, 并测定IA值.
结果: 正常组及未治疗组CTGF阳性染色主要在上皮细胞间和黏膜下层的结缔组织中, 而雷尼替丁组、奥美拉唑组则主要出现在胃壁细胞内, 后两组术后1、2、4 wk, CTGF在局部组织中明显增加(4 wk, IA: 10 888±2 195, 19 179±2 048 vs 2 370±844, 5 237±1 035, 均P<0.05). 其中奥美拉唑组在第4周时已明显高于雷尼替丁组(P<0.05). 在正常对照组, EGFR阳性染色主要位于胃黏膜浅层壁细胞膜上. 术后EGFR主要表达在壁细胞胞浆和黏膜下层的血管内皮细胞的胞浆中. 术后1 wk, EGFR的表达水平以奥美拉唑组>雷尼替丁组>未治疗组>正常对照组的顺序依次降低(均P<0.05). 术后2-4 wk, 各组均逐渐回落到正常水平(均P>0.05).
结论: 抑酸治疗有助于胃黏膜电切术后创面的修复, 奥美拉唑的修复作用最强, 该研究为临床微创治疗后抑酸药的应用以及选择提供了实验依据.
引文著录: 王健, 谭庆华, 曾青. 抑酸对胃黏膜损伤修复时CTGF、EGFR水平的影响. 世界华人消化杂志 2010; 18(27): 2852-2857
Revised: July 28, 2010
Accepted: August 3, 2010
Published online: September 28, 2010
AIM: To investigate the effect of acid inhibitors on the expression of connective tissue growth factor (CTGF) and epidermal growth factor receptor (EGFR) during gastric mucosa repair in rats.
METHODS: Sixty Sprague-Dawley rats were randomly divided into four groups: normal control group (n = 6), untreated group (n = 18), ranitidine group (n = 18), and omeprazole group (n = 18). All rats except those in the normal control group underwent gastric mucosal electrocision at the front wall of the antrum. The ranitidine and omeprazole groups were injected with ranitidine [11 mg/(kg•d)] and omeprazole [1.8 mg/(kg•d)] through the caudal vein, respectively, while the normal control group was given equal volume of normal saline. Rats in all the groups were executed at the end of 1, 2 and 4 wk after operation. The expression of CTGF and EGFR during gastric mucosa repair was determined by immunohistochemistry.
RESULTS: In the normal control group and untreated group, positive CTGF signals were located in the lamina propria and submucosal connective tissue. In contrast, positive CTGF signals were mainly located in the cytoplasm of gastric parietal cells in the ranitidine and omeprazole groups. The area and integrated absorbance (IA) of CTGF staining was higher in the ranitidine and omeprazole groups than in the normal control and untreated groups at weeks 1, 2 and 4 (IA at week 4: 10 888 ± 2 195 and 19 179 ± 2 048 vs 2 370 ± 844 and 5 237 ± 1 035, all P < 0.05). The expression level of CTGF in the omeprazole group increased gradually and became higher than that in the ranitidine group at week 4 (P < 0.05). Weak EGFR staining was observed in parietal cells in the superficial layer of the gastric mucosa in the normal control group. In the untreated group, ranitidine group and omeprazole group, positive EGFR signals were mainly located in the cytoplasm of parietal cells and submucosal vascular endothelial cells. The area and IA of EGFR staining at week 1 were increased markedly in the untreated group, ranitidine group and omeprazole group compared with that in the normal control group (all P < 0.05). At week 4, there were no significant differences in the area and IA of EGFR staining among the four groups (all P > 0.05).
CONCLUSION: Acid inhibitors, especially omeprazole, can promote ulcer healing in rats undergoing gastric mucosa electrocision.
- Citation: Wang J, Tan QH, Zeng Q. Effect of acid inhibitors on CTGF and EGFR expression during gastric mucosa repair. Shijie Huaren Xiaohua Zazhi 2010; 18(27): 2852-2857
- URL: https://www.wjgnet.com/1009-3079/full/v18/i27/2852.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i27.2852
随着内镜微创技术的进步, 对某些胃肠道黏膜病变及黏膜下表浅病变, 可行内镜下电切术, 完全摘除病变[1]. 术后局部随即形成溃疡, 当溃疡完全愈合后, 才真正达到临床治愈的目的. 结缔组织生长因子(connective tissue growth factor, CTGF)具有促进细胞增殖、合成胶原等诸多生理作用[2]. 而表皮生长因子与其受体(epidermal growth factor receptor, EGFR)结合形成二聚体, 启动相应的信号转导通路, 促进细胞有丝分裂, 促进损伤组织的修复[2]. 内镜电切术后胃肠道创面的修复和愈合, 也必然会有CTGF、EGFR等生长因子的变化. 本研究测定了大鼠胃黏膜部分电切除术后局部组织中CTGF和EGFR的变化, 以及抑酸治疗对这一变化的影响.
健康纯种SD大鼠60只(长沙实验动物中心)雌雄各半, 体质量215 g±30 g, 周龄6 wk, 室温喂养, 实验前适应性喂养1 wk.
1.2.1 分组: 正常对照组6只, 未治疗组、雷尼替丁组、奥美拉唑组各18只, 各组动物体质量之间无差异.
1.2.2 造模: 术前24 h禁食, 8 h禁饮. 腹腔内注射麻醉(10%水合氯醛3-6 mL/kg)后, 无菌条件下取左侧腹直肌切口入腹腔, 将胃钳拉出腹壁外, 在胃窦前壁切开胃, 切口约5 mm, 在距切口约5 mm处的胃窦黏膜下注射生理盐水至黏膜隆起, 用单极电刀(CHR-EⅢ多功能手术仪, 春光医疗美容仪器有限公司, 武汉, 中国)电切隆起的胃黏膜, 切除面约3 mm×3 mm. 关闭胃腔、腹腔, 常规消毒、包扎腹壁切口. 所有动物术后禁食、禁水24 h.
1.2.3 术后观察及给药: 术后, 雷尼替丁组经尾静脉注射雷尼替丁(国药准字H32021588, 莱恩药业有限公司), 11 mg/(kg•d); 奥美拉唑组经尾静脉注射奥美拉唑(国药准字H20010183, 吴中医药集团有限公司), 1.8 mg/(kg•d). 未治疗组仅给予等量生理盐水尾静脉注射. 雷尼替丁组、奥美拉唑组和未治疗组分别于术后第1、2、4周用离断颈椎法处死. 正常对照组不做特殊处理, 适应性喂养1 wk后处死.
1.2.4 免疫组织化学法测定CTGF及EGFR: 各组动物处死后, 解剖出胃, 留取电切术后局部胃壁组织, 用40 g/L的甲醛固定24 h. 常规石蜡包埋、切片备用. 用SABC法(SA1025-大鼠IgG, SA1022-大鼠IgG, 博士德生物工程有限公司, 武汉, 中国)进行免疫组织化学染色. 煮沸法修复抗原, 修复液为0.01 mol/L橘橼酸盐缓冲液(pH6.0). CTGF一抗为兔抗CTGF(Rabbit Anti-CTGF, 1:100), EGFR一抗为兔抗EGFR(Rabbit Anti-EGFR, 1:100). DAB显色(AR1022, 博士德生物工程有限公司)、中性树胶封片观察, 各组以PBS设立阴性对照. 采用Image Pro Plus图像分析软件进行半定量分析, 每个样本随机选5个高倍视野(×200), 测定阳性表达部位的积分吸光度值(IA)和面积百分比.
统计学处理 数据以mean±SD表示, 进行完全随机设计方差分析, 多个样本间均数两两比较用q检验法. P<0.05为差异有统计学意义.
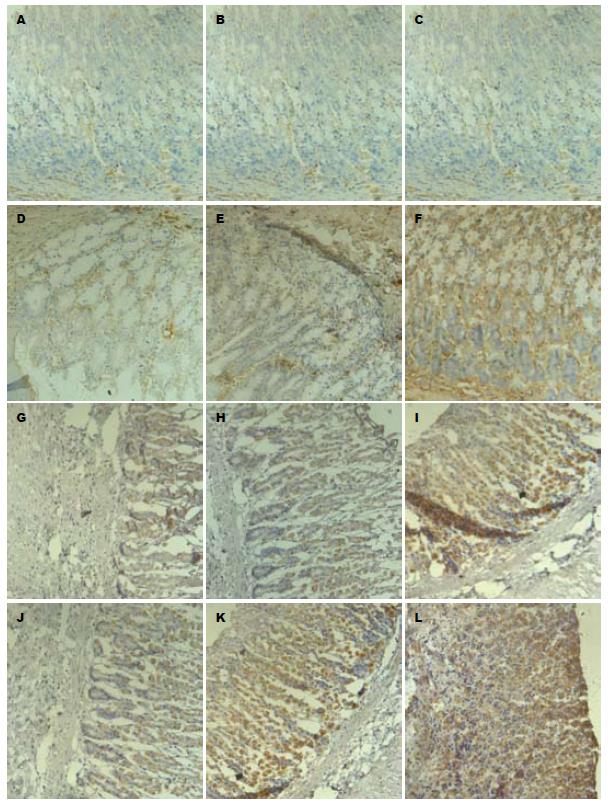
正常组及未治疗组CTGF阳性染色主要在上皮细胞间和黏膜下层的结缔组织中. 未治疗组第4周除了上述部位阳性染色外, 部分壁细胞质内也出现明显的阳性染色. 经雷尼替丁或奥美拉唑治疗后, CTGF阳性染色主要出现在胃壁细胞内, 而在结缔组织中的阳性染色明显减弱(图1). 未治疗组、雷尼替丁组、奥美拉唑组术后1、2、4 wk电切周边局部组织中CTGF阳性染色的面积百分比和IA, 较正常对照组增加(P<0.05). 而雷尼替丁组、奥美拉唑组与未治疗组术后同期相比, CTGF明显增加(P<0.05). 术后1、2 wk, CTGF的面积百分比和IA在奥美拉唑组与雷尼替丁组没有差异(P>0.05). 而4 wk时, 奥美拉唑组比雷尼替丁组明显增加(P<0.05). 奥美拉唑组随治疗时间延长, CTGF的变化呈逐渐增加趋势(P<0.05). 未治疗组、雷尼替丁组CTGF的面积百分比和IA随时间的延长没有明显变化(P>0.05, 表1).
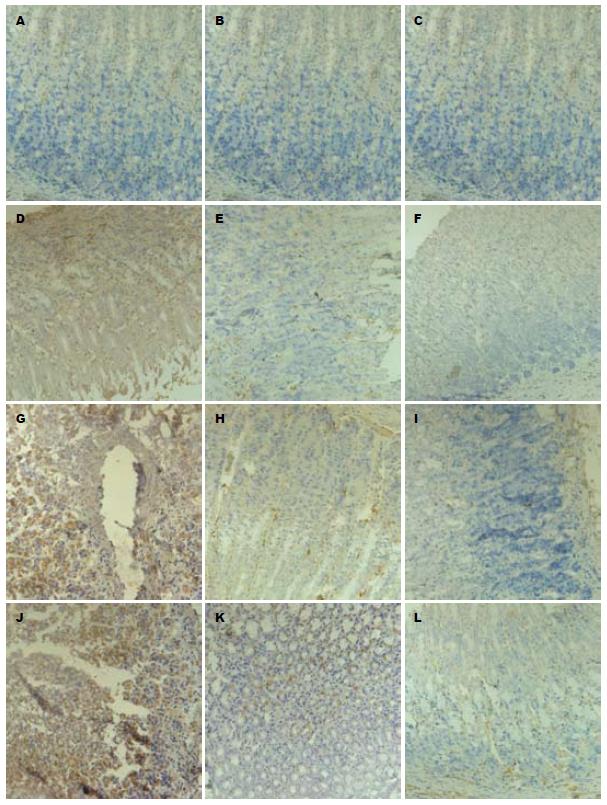
在正常大鼠, EGFR阳性染色主要位于胃黏膜浅层壁细胞膜上, 呈弱阳性染色. 术后EGFR主要表达在壁细胞胞浆和黏膜下层的血管内皮细胞的胞浆中(图2). 术后1 wk, 未治疗组、雷尼替丁组、奥美拉唑组大鼠胃黏膜电切周边创面组织中EGFR的面积百分比和IA均较正常对照组明显升高(P<0.05), 以奥美拉唑组升高最明显, 依次是雷尼替丁组和未治疗组(P<0.05). 术后2 wk, 未治疗组、雷尼替丁组、奥美拉唑组大鼠胃黏膜电切周边创面组织EGFR的面积百分比及IA都明显回落. 但奥美拉唑组仍较正常对照组高(P<0.05). 未治疗组、雷尼替丁组与正常对照组比较无差异(P>0.05). 术后4 wk, 未治疗组、雷尼替丁组、奥美拉唑组EGFR的表达与正常对照组比较无明显差异(P>0.05, 表2).
在胃溃疡的愈合过程中, 坏死物质的消除、肉芽组织的生长、新生血管的生成、纤维组织的形成和上皮细胞的增殖、迁移, 均受各种生长因子及其受体的调控[2]. 特别是TGF-β的作用最广泛, 可诱导多种生长因子的产生, 促进细胞外基质的合成分泌, 最终促进溃疡的修复[3]. 在正常结缔组织中, 由成纤维细胞产生的CTGF直接受TGF-β1的调控, 介导着TGF-β1的部分生物学效应, 包括刺激成纤维细胞增殖和细胞外基质的生成, 参与机体组织的创伤修复及器官纤维化形成的过程[4].
本研究中, 正常大鼠胃黏膜下层及上皮细胞间弱阳性表达CTGF说明, 少量的CTGF即可以确保胃壁内结缔组织的生理性更新, 使得结缔组织中的相关成分处于一种动态平衡. 而未治疗组第4周CTGF除黏膜下层、黏膜固有层出现阳性染色外, 部分壁细胞也出现阳性染色. 表明创伤后随着修复时间的延长, 主要功能为分泌胃酸的胃壁细胞, 也逐渐参与了局部纤维肉芽组织形成的调节, 这可能是胃黏膜代偿机制的一种表现. 经抑酸治疗后, CTGF阳性染色主要出现在胃壁细胞内, 而在结缔组织中的阳性染色几乎消失. 显示抑酸治疗增强了这一代偿机制活动, 可能更有助于溃疡面的愈合.
CTGF分泌增多是调节创伤修复的重要环节, 未治疗组胃壁组织中高水平表达CTGF, 应该是胃黏膜电切创伤引起机体的自身修复反应. 这种反应在创伤后第1、2周反应不明显, 而在溃疡已经愈合的第4周, 其表达明显增加, 而抑酸治疗后壁细胞中CTGF升高更加明显, 这可能是抑酸治疗促进壁细胞中CTGF的合成, 增强了溃疡的愈合过程, 这种效应以奥美拉唑最明显. 说明CTGF不仅促进溃疡修复过程中的纤维化过程, 在瘢痕组织的重建或改建过程中可能也起着更重要的调节作用, 这种调节作用由溃疡及周边结缔组织中的CTGF和壁细胞中的CTGF协同完成. 另外, CTGF不仅通过诱导成纤维细胞的增殖和细胞外基质的合成, 参与结缔组织的再生、肉芽组织的形成和机化. 还可能参与结构重建, 最终有助于胃黏膜电切处缺损组织的愈合. 但抑酸治疗增加CTGF分泌的具体机制, 目前尚不清楚. 是否与CTGF通过TGF-β/SMADs、Ras/Raf/ERK等信号通路和信号分子在胃溃疡的愈合中发挥了作用[5]有关, 还有待进一步研究.
EGFR是一个跨膜受体, 正常胃肠道很多调节因子都影响EGFR的表达, EGFR及其配体EGF结合后, 在胃黏膜细胞增殖和组织修复中发挥重要作用, 保持胃肠道上皮组织的完整性, 并有抑制胃酸分泌的作用[6]. 正常大鼠胃黏膜浅层壁细胞膜上或部分位于颈黏液细胞中有EGFR的阳性染色, 可能与大鼠胃黏膜上皮细胞的生理性更新, 维持胃黏膜的正常完整性相关. 可能还同时促进胃黏膜表面黏液的合成和分泌[7]. 由于EGFR可调节正常上皮细胞的分化、增殖、上皮细胞间黏附及接触抑制[8]. 当上皮细胞更新时, EGFR表达增加, 而当创伤被修复或上皮细胞的更新完成后, 其表达明显降低, 这可能是术后各组的EGFR在第1周明显升高, 而在第2、4周明显降低的原因. 在第2周以前, 由于EGFR的高表达, 促进了胃黏膜上皮细胞的增殖, 尽快覆盖溃疡面, 同时增加胃黏膜颈黏液细胞合成和分泌黏液, 避免溃疡面的继续加深. 当溃疡表面得以初步修复后, EGFR的表达通过一定的机制回落到正常生理状态时的水平, 这也是正常黏膜上皮细胞增殖和肿瘤性上皮细胞增殖的不同处之一[8]. 大鼠胃黏膜电切术后, 这种变化在抑酸治疗后变得更加明显, 而其中又以奥美拉唑组最明显. 这可能与抑酸剂能上调EGFR的表达有关[9], 但奥美拉唑与雷尼替丁是否是通过不同的途径促进EGFR的表达, 目前还不清楚.
总之, 正常大鼠胃黏膜组织中均存在CTGF和EGFR, 胃黏膜的电切术可刺激这两种细胞因子的合成和分泌. 生理状态下主要功能为分泌胃酸的壁细胞, 在上皮修复过程中发挥重要调节作用, 抑酸治疗可增强这种调节功能. 与雷尼替丁相比, 奥美拉唑的这种作用更强.
在胃溃疡的愈合过程中, 坏死物质的消除、肉芽组织的生长、新生血管的生成、纤维组织的形成和上皮细胞的增殖、迁移, 均受各种生长因子及其受体的调控.
沈薇, 教授, 重庆医科大学附属第二医院消化内科
抑酸治疗增加CTGF分泌的具体机制, 目前尚不清楚. 是否与CTGF通过TGF-β/SMADs、Ras/Raf/ERK等信号通路和信号分子在胃溃疡的愈合中发挥了作用有关, 还有待进一步研究.
本研究测定了大鼠胃黏膜部分电切除术后局部组织中CTGF和EGFR的变化, 以及抑酸治疗对这一变化的影响, 为临床微创治疗后抑酸药的应用以及选择提供了实验依据.
CTGF不仅通过诱导成纤维细胞的增殖和细胞外基质的合成, 参与结缔组织的再生、肉芽组织的形成和机化. 还可能参与结构重建, 最终有助于胃黏膜电切处缺损组织的愈合.
本文选题新颖, 为临床微创治疗后抑酸药的应用以及选择提供了实验依据.
编辑: 李军亮 电编:吴鹏朕
| 1. | Yoshida N, Yagi N, Naito Y, Yoshikawa T. Safe procedure in endoscopic submucosal dissection for colorectal tumors focused on preventing complications. World J Gastroenterol. 2010;16:1688-1695. [PubMed] [DOI] |
| 2. | Tarnawski A, Szabo IL, Husain SS, Soreghan B. Regeneration of gastric mucosa during ulcer healing is triggered by growth factors and signal transduction pathways. J Physiol Paris. 2001;95:337-344. [PubMed] [DOI] |
| 3. | Shih SC, Tseng KW, Lin SC, Kao CR, Chou SY, Wang HY, Chang WH, Chu CH, Wang TE, Chien CL. Expression patterns of transforming growth factor-beta and its receptors in gastric mucosa of patients with refractory gastric ulcer. World J Gastroenterol. 2005;11:136-141. [PubMed] |
| 4. | Blom IE, Goldschmeding R, Leask A. Gene regulation of connective tissue growth factor: new targets for antifibrotic therapy? Matrix Biol. 2002;21:473-482. [PubMed] [DOI] |
| 5. | Tarnawski AS. Cellular and molecular mechanisms of gastrointestinal ulcer healing. Dig Dis Sci. 2005;50 Suppl 1:S24-S33. [PubMed] [DOI] |
| 6. | Dockray GJ. Topical review. Gastrin and gastric epithelial physiology. J Physiol. 1999;518:315-324. [PubMed] [DOI] |
| 7. | Nadel JA. Role of epidermal growth factor receptor activation in regulating mucin synthesis. Respir Res. 2001;2:85-89. [PubMed] [DOI] |
| 8. | Prenzel N, Fischer OM, Streit S, Hart S, Ullrich A. The epidermal growth factor receptor family as a central element for cellular signal transduction and diversification. Endocr Relat Cancer. 2001;8:11-31. [PubMed] [DOI] |
| 9. | Milani S, Calabrò A. Role of growth factors and their receptors in gastric ulcer healing. Microsc Res Tech. 2001;53:360-371. [PubMed] [DOI] |