修回日期: 2010-07-30
接受日期: 2010-08-10
在线出版日期: 2010-09-18
目的: 探讨在细胞水平上结缔组织生长因子(connective tissue growth factor, CTGF)在人肝细胞癌(hepatocellular carcinoma, HCC)生长和转移中发挥的作用.
方法: 采用原位杂交技术检测36例HCC手术切除标本和6例正常肝组织中CTGF mRNA, 计算机图像分析系统测定癌灶及癌周基质CTGF mRNA阳性细胞的IA值, 试剂盒测定CTGF刺激肝癌细胞株HepG2细胞的迁移、侵袭力, 流式细胞仪测定HepG2细胞周期.
结果: 原位杂交结果显示CTGF mRNA主要在癌周结缔组织及动、静脉壁中表达. 在细胞水平研究结果显示: 重组CTGF可明显提高HepG2细胞的迁移和侵袭力(均P<0.01); CTGF可使HepG2细胞周期中S期细胞数明显增加(10.94 ± 0.23 vs 23.85 ± 2.35, P<0.01).
结论: CTGF在HCC生长和转移中发挥重要的作用, 其有可能成为一个新的治疗靶点.
引文著录: 张瑞娟, 邹亚斌, 高润平, 张秀军, 朱杰. CTGF在肝细胞癌中的表达及作用. 世界华人消化杂志 2010; 18(26): 2775-2779
Revised: July 30, 2010
Accepted: August 10, 2010
Published online: September 18, 2010
AIM: To detect the expression of connective tissue growth factor (CTGF/CCN2) in human hepatocellular carcinoma (HCC) and to elucidate its roles in the development of HCC in vitro.
METHODS: Liver samples from 36 HCC patients, who underwent hepatic resection, and 6 normal individuals were used to detect CTGF mRNA expression by in situ hybridization. Computer imaging analysis was performed to measure the integrated absorbance (IA) of CTGF mRNA-positive cells in carcinoma and surrounding stroma. The impact of CTGF on HepG2 cell migration and invasion was determined using commercial kits. Cell cycle analysis was performed by flow cytometry.
RESULTS: In situ hybridization analysis showed a significance increase in CTGF mRNA expression that was mainly detected in connective tissue and blood vessels around carcinoma foci. Incubation of HepG2 cells with 100 ng/mL CTGF significantly promoted cell migration and invasion (both P < 0.01). Cell cycle analysis showed that addition of 100 ng/mL CTGF to HepG2 cell culture medium resulted in more cells progressing into S phase (10.94 ± 0.23 vs 23.85 ± 2.35, P < 0.01).
CONCLUSION: CTGF may play important roles in the development of HCC and is a potential novel therapeutic target for HCC.
- Citation: Zhang RJ, Zou YB, Gao RP, Zhang XJ, Zhu J. Expression and roles of connective tissue growth factor in human primary hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2010; 18(26): 2775-2779
- URL: https://www.wjgnet.com/1009-3079/full/v18/i26/2775.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i26.2775
结缔组织生长因子(connective tissue growth factor, CTGF)是一种富含半胱氨酸的细胞基质蛋白[1]. CTGF对多种细胞发挥生物学作用, 包括促进细胞有丝分裂、增生、黏附、迁移和促进细胞外基质(extracellular matrix, ECM)合成等; CTGF在体内参与胚胎发育、分化, 创伤愈合, 疤痕形成, 肿瘤生长等病理生理过程[1,2]. 近年来, 国内的研究发现, CTGF在人肝细胞癌(hepatocellular carcinoma, HCC)组织中的表达量高于癌周正常肝组织, CTGF的高表达主要见于HCC晚期及具有静脉癌浸润的患者, 初步认为CTGF与HCC的发生及转移有关[3,4]. 本研究进一步明确CTGF在HCC癌组织及其周边结缔组织和血管的表达特点, 并在人肝癌细胞株HepG2细胞水平上探讨CTGF在肝癌细胞迁移、侵袭和增殖的作用.
36例HCC手术切除标本来自于2006- 05/2009-06吉林大学第一医院, 其中男26例, 女10例, 年龄27-71(平均56.4±14.2)岁. 依据Pittsburgh改良TNM分类标准, 36例HCC包括小肝癌20例, 孤立性大肝癌10例, 结节性肝癌6例. 6例正常肝组织分别取自于肝海绵状血管瘤肝部分切除后远离瘤体的肝组织, 其中男3例, 女3例, 年龄31-58(平均44.5±13.1)岁. 组织块经常规石蜡包埋, 切片厚度为6 μm. 肝癌细胞株HepG2购自中南大学湘雅医学院细胞室. 人CTGF mRNA原位杂交检测试剂盒购自武汉博士德公司, 重组人CTGF购自以色列Prospec-Tany公司. 96孔细胞培养板购自美国Costa Corning公司, 12孔细胞迁移试剂盒购自美国Millipore公司. 24孔细胞浸润ECM550试剂盒购自美国Chemicon公司. 高倍显微镜(Olympus DP72, 日本), 计算机图像分析系统(Image Proplus 6.0, USA), 流式细胞仪(美国BD公司).
1.2.1 HCC组织的HE染色: 石蜡切片经常规脱蜡至水, 苏木精染色2 min, 自来水洗5 min, 盐酸酒精分化数秒, 自来水洗5 min, 伊红染色5 min, 水洗2次, 梯度酒精脱水、二甲苯透明、中性树胶封固.
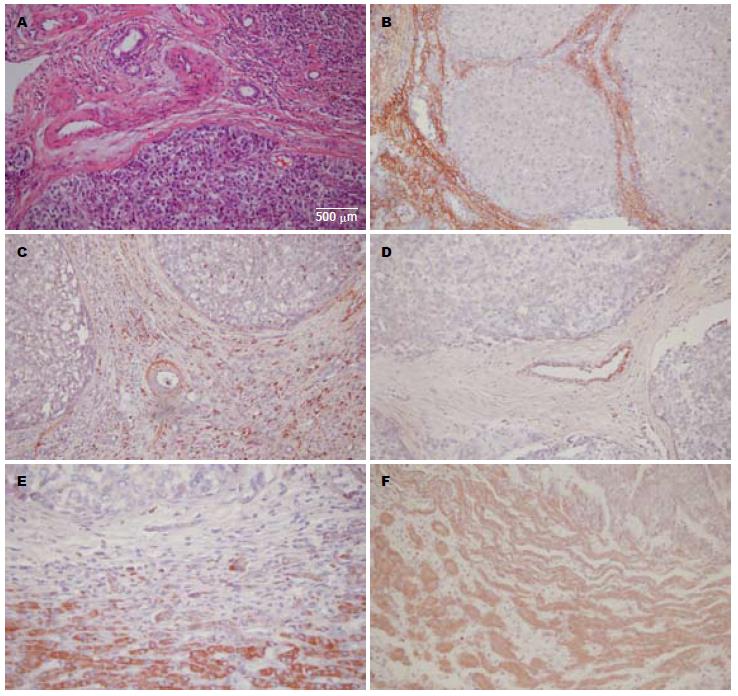
1.2.2 原位杂交检测CTGF mRNA: 采用多项寡核苷酸探针和高敏感标记技术检测人肝组织CTGF mRNA. 主要步骤: 切片脱蜡, 3%柠檬酸胃蛋白酶37 ℃消化10 min; 多聚甲醛室温固定10 min; 42 ℃预杂交2 h; 42 ℃杂交过夜; 次日依次于37 ℃下封闭30 min; 生物素化鼠抗地高辛室温60 min, 链霉亲和素-生物素复合物20 min及生物素化过氧化物酶20 min; AEC显色10 min, 以着红色者为阳性, 苏木素复染, 水性封胶封片. 采用计算机图像分析系统Image ProPlus 6.0, 随机对每张切片中10个400×视野CTGF mRNA阳性细胞进行测定, 计算其平均积分吸光度值(integrated optical density, IA). 6例正常肝组织作为对照.
1.2.3 CTGF对HepG2细胞迁移作用的检测: 用含1 mmol/L EDTA的PBS预处理75 cm2培养瓶使细胞分离, 收集HepG2细胞, 用DMEM将HepG2细胞浓度调至6×104/mL; 取细胞悬液500 μL分别置于插入式细胞培养的每个小室, 并将其放入相匹配的12孔培养板, 下室内加入相同培养基500 μL, 在下室内分别加入不同含量的CTGF, 对照组加入等体积的PBS, CO2培养箱培养6 h. 弃掉DMEM, 100%甲醇固定5 min, 迈格吉染液染色, 甘油封片. 随机选择10个400×的视野, 计数上室筛网底面和上面的细胞数. 细胞迁移率 = 筛网底面的细胞数/筛网两面细胞总数×100%.
1.2.4 CTGF对HepG2细胞侵袭作用的检测: 将24孔细胞浸润ECM 550试剂盒置于CO2培养箱预温, 加300 μL预温的DMEM至小室内部, 室温放置2 h使小室底部ECM湿化. 按上述方法分离、收集HepG2细胞, 将细胞浓度调制5×104/mL. 弃掉湿化DMEM, 加500 μL DMEM至下室, 取300 μL细胞悬液加至每个小室. 实验组取100 μg/L CTGF加至相应的下室, 对照组加入等量的PBS, 于CO2培养箱中培养24 h; 弃去培养基, 用PBS漂洗细胞; 100%甲醇固定5 min; 把上室浸入到500 μL染色液中15 min; 在烧杯中漂洗上室, 取下筛网, 放置玻片上, 甘油封片, 显微镜下计数. 细胞侵袭率 = 筛网底面的细胞数/筛网两面细胞总数×100%.
1.2.5 CTGF对HepG2细胞周期进程作用的检测: 常规消化、收集细胞, 用含100 mL/L胎牛血清(fetal bovine serum, FBS)的DMEM将细胞浓度调至1.0×105/mL; 各取2 mL细胞悬液分别加入6孔板中的每个孔中, 每组为3孔, CO2培养箱中培养12 h, 换用含5 mL/L FBS的DMEM, 培养12 h; 重新换用5 mL/L FBS的DMEM, 实验组加入CTGF(100 μg/L), 对照组加入等体积的PBS, 继续培养24 h. 常规消化, 收集并洗涤细胞; 70%的乙醇固定细胞, 4 ℃保存, 待测. 细胞周期检测前, 将细胞离心, 弃固定液; 3 mL PBS重悬, 震荡均匀, 加入终浓度为50 mg/L的RNase, 37 ℃温浴45 min, 冰浴1 min; 加入终浓度为50 mg/L的PI, 于4 ℃避光染色30 min; 流式细胞仪检测, 汞激发波长为488 nm; 获取数据, 分析.
统计学处理 实验数据统计采用SPSS13.0软件分析, 实验数据采用mean±SD表示, 组间比较用t检验, P<0.05有统计学意义.
HE染色于光学显微镜下HCC呈多灶性分布, 癌灶周边被基质(结缔组织和血管)分隔或包绕(图1A). 原位杂交显示CTGF mRNA阳性细胞主要分布在癌周结缔组织(图1B, C)及其中的动、静脉壁内(图1C, D). 在12例(33.3%)HCC癌灶周边检测到CTGF mRNA在上皮间质转化(epithelial-mesenchymal transition, EMT)的过渡细胞表达(图1E, F), 提示在部分HCC患者CTGF可能通过参与EMT过程, 进而促进癌周基质的形成. 通过计算机图像分析系统对CTGF mRNA阳性信号IA值分析结果显示: CTGF mRNA在癌灶及癌周基质表达水平均明显高于正常对照(12.36±3.08, 60.27±28.71 vs 6.42±2.35, P<0.01), 而癌周基质CTGF mRNA的表达水平又明显高于癌灶的水平.
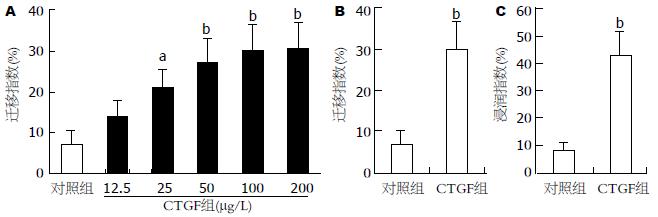
为明确CTGF在HCC癌周高表达的生物学作用, 在细胞水平上检测了重组CTGF对HepG2细胞迁移的作用. CTGF在诱导HepG2细胞通过上室底部微孔的迁移能力呈剂量依赖性, 100 μg/L CTGF是诱导HepG2迁移的最佳浓度(图2A). 与对照组比CTGF可明显提高HepG2细胞的迁移力(P<0.01, 图2B).
恶性肿瘤细胞侵袭突破ECM构成的屏障是其转移的重要步骤. 为明确CTGF是否具有诱导HepG2细胞的侵袭作用, 本研究在细胞迁移实验基础上, 使用覆盖一薄层ECM于上室底部微孔的细胞浸润ECM 550试剂盒进行了细胞侵袭实验. 结果显示: HepG2细胞具有基础低水平的侵袭力, CTGF可明显提高HepG2细胞的侵袭力(P<0.01, 图2C).
HCC由肿瘤实质和基质构成, 肿瘤实质为肝癌细胞, 基质由结缔组织、血管和神经组成. 由于HCC的发生通常经历一个由正常肝脏至慢性肝炎/肝硬化和增生性结节再到肝癌的过程, 肝癌实质细胞的生长依赖于肿瘤与基质之间的复杂联系, 肝癌实质细胞周围组织微环境成分, 包括ECM蛋白和各种生长因子, 他们在HCC细胞生长过程中起着重要的调节作用[5,6]. 此外, HCC是一种富含血管的实体肿瘤, 血管生成通过提供营养物质和氧气对肝癌细胞的生长发挥重要的作用[7]. CTGF参与体内多种病理生理过程, 其中包括纤维疤痕形成, 血管再生, 肿瘤生长等[2,3,8]. 近年来, 国内外的研究表明: CTGF的表达与多种肿瘤(包括胰腺癌和HCC等)的不良预后有关[3,4,9]. 颜延启等[4]研究报道HCC癌组织中CTGF的表达量明显高于癌周正常肝组织, 推测CTGF与HCC的发生、发展有关. 本研究结果显示CTGF mRNA在HCC组织中的表达明显高于正常肝组织, 癌周结缔组织, 动、静脉壁内的表达明显高于癌灶内的表达, 由此可见CTGF参与HCC癌周结缔组织及血管的形成, 在HCC的生长过程中发挥调节作用.
近年来的研究表明EMT是胚胎发育的一个重要过程, 人体的许多病理过程, 如伤口愈合, 组织纤维化及肿瘤进展亦存在EMT现象. 细胞的EMT过程受到许多生长因子EGF, PDGF, TGF-β和ECM等的调节, EMT对良性肿瘤的恶性变过程起着重要的作用[10]. 在恶性肿瘤进展过程中, EMT不只针对癌细胞, 在肿瘤微环境内部的部分癌相关成纤维细胞(cancer associated fibroblast, CAT)亦可从正常上皮细胞转化而来[10]. Van Zijl等[11]报道在实验性动物和人类HCC存在EMT现象, 部分EMT与胚胎发育程序相似, TGF-β信号通路参与EMT的过程. 本研究有1/3的HCC患者癌灶周边检测到CTGF mRNA阳性EMT现象, 由此认为CTGF通过调节HCC患者EMT过程, 促进HCC基质形成和肿瘤生长.
迁移是细胞在接收到迁移信号或感受到某些物质浓度梯度产生的移动, 与创伤愈合、免疫、感染和恶性肿瘤转移等病理生理过程有关; 侵袭是恶性肿瘤细胞突破基底膜从原始部位向周围组织进攻的过程, 肿瘤细胞与ECM蛋白结合, 产生基质金属蛋白酶(matrix metalloproteinases, MMPs), 降解基底膜和基质而实现细胞运动, 因此, 肿瘤细胞的迁移和侵袭与肿瘤转移密切相关[12,13]. 小鼠乳腺癌与胰腺癌模型证明了CTGF具有促进癌细胞增殖、侵袭、转移的作用, 相反, 通过中和性抗体拮抗CTGF却明显抑制肿瘤的转移[14,15]. 近来, 在一项异种移植的HCC动物模型的研究中显示TGF-β抑制剂Ly2109761可抑制CTGF的合成和释放, 并且减少肿瘤基质的合成, 进而减低肿瘤生长, 侵袭和转移[6]. 本研究结果显示CTGF可明显刺激肝癌细胞株HepG2细胞迁移、侵袭和细胞周期进程, 结合CTGF在HCC癌灶周围结缔组织及血管壁高表达的特征, 提示CTGF在HCC生长和转移过程中发挥重要的作用, CTGF有可能成为抗HCC的生物学治疗的新靶点.
HCC通常是在慢性肝炎/肝硬化和增生性结节基础上演变而来, 而肝癌实质细胞的生长又赖于其与基质的复杂联系. CTGF是一种富含半胱氨酸的细胞基质蛋白, 其对多种细胞发挥生物学作用, 包括促进细胞有丝分裂、增殖、黏附、迁移和促进ECM合成等, CTGF在体内参与血管再生, 疤痕形成, 器官纤维化, 肿瘤生长等多种病理生理过程. 目前, 有关CTGF在恶性肿瘤生长、转移过程中的调节作用受到人们的关注.
单云峰, 副主任医师, 温州医学院附属第一医院肝胆外科
颜延启等研究报道HCC癌组织中CTGF的表达量明显高于癌周正常肝组织, 推测CTGF与HCC的发生、发展有关.
本研究采用原位杂交技术检测CTGF mRNA在HCC癌灶、癌灶周围基质的表达, 与正常肝组织对照阐明了CTGF在HCC组织学的分布特征, 首次在HepG2细胞水平上明确CTGF对肝癌实质细胞增殖、迁移、浸润的作用.
本研究结果显示CTGF在肝癌实质细胞的增殖、转移及基质血管形成发挥重要的调节作用, 提示CTGF有可能成为抗HCC的生物学治疗的新靶点.
本文方法新颖, 论据充分, 结论可靠, 具有一定的学术价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Chen CC, Lau LF. Functions and mechanisms of action of CCN matricellular proteins. Int J Biochem Cell Biol. 2009;41:771-783. [PubMed] [DOI] |
| 2. | Brigstock DR. Strategies for blocking the fibrogenic actions of connective tissue growth factor (CCN2): From pharmacological inhibition in vitro to targeted siRNA therapy in vivo. J Cell Commun Signal. 2009;3:5-18. [PubMed] [DOI] |
| 3. | Zeng ZJ, Yang LY, Ding X, Wang W. Expressions of cysteine-rich61, connective tissue growth factor and Nov genes in hepatocellular carcinoma and their clinical significance. World J Gastroenterol. 2004;10:3414-3418. [PubMed] |
| 5. | Wong CM, Ng IO. Molecular pathogenesis of hepatocellular carcinoma. Liver Int. 2008;28:160-174. [PubMed] [DOI] |
| 6. | Mazzocca A, Fransvea E, Dituri F, Lupo L, Antonaci S, Giannelli G. Down-regulation of connective tissue growth factor by inhibition of transforming growth factor beta blocks the tumor-stroma cross-talk and tumor progression in hepatocellular carcinoma. Hepatology. 2010;51:523-534. [PubMed] |
| 7. | Yang ZF, Poon RT. Vascular changes in hepatocellular carcinoma. Anat Rec (Hoboken). 2008;291:721-734. [PubMed] [DOI] |
| 8. | Chu CY, Chang CC, Prakash E, Kuo ML. Connective tissue growth factor (CTGF) and cancer progression. J Biomed Sci. 2008;15:675-685. [PubMed] [DOI] |
| 9. | Bennewith KL, Huang X, Ham CM, Graves EE, Erler JT, Kambham N, Feazell J, Yang GP, Koong A, Giaccia AJ. The role of tumor cell-derived connective tissue growth factor (CTGF/CCN2) in pancreatic tumor growth. Cancer Res. 2009;69:775-784. [PubMed] [DOI] |
| 10. | Gos M, Miłoszewska J, Przybyszewska M. [Epithelial-mesenchymal transition in cancer progression]. Postepy Biochem. 2009;55:121-128. [PubMed] |
| 11. | van Zijl F, Zulehner G, Petz M, Schneller D, Kornauth C, Hau M, Machat G, Grubinger M, Huber H, Mikulits W. Epithelial-mesenchymal transition in hepatocellular carcinoma. Future Oncol. 2009;5:1169-1179. [PubMed] [DOI] |
| 12. | Tian T, Nan KJ, Guo H, Wang WJ, Ruan ZP, Wang SH, Liang X, Lu CX. PTEN inhibits the migration and invasion of HepG2 cells by coordinately decreasing MMP expression via the PI3K/Akt pathway. Oncol Rep. 2010;23:1593-1600. [PubMed] |
| 13. | Chen PS, Wang MY, Wu SN, Su JL, Hong CC, Chuang SE, Chen MW, Hua KT, Wu YL, Cha ST. CTGF enhances the motility of breast cancer cells via an integrin-alphavbeta3-ERK1/2-dependent S100A4-upregulated pathway. J Cell Sci. 2007;120:2053-2065. [PubMed] [DOI] |
| 14. | Shimo T, Kubota S, Yoshioka N, Ibaragi S, Isowa S, Eguchi T, Sasaki A, Takigawa M. Pathogenic role of connective tissue growth factor (CTGF/CCN2) in osteolytic metastasis of breast cancer. J Bone Miner Res. 2006;21:1045-1059. [PubMed] [DOI] |
| 15. | Aikawa T, Gunn J, Spong SM, Klaus SJ, Korc M. Connective tissue growth factor-specific antibody attenuates tumor growth, metastasis, and angiogenesis in an orthotopic mouse model of pancreatic cancer. Mol Cancer Ther. 2006;5:1108-1116. [PubMed] [DOI] |