修回日期: 2010-07-01
接受日期: 2010-07-12
在线出版日期: 2010-09-08
目的: 探讨COX-2、PPARγ和NF-κB p65在溃疡性结肠炎(UC)发病机制中的作用及相互关系.
方法: 选择华西医院消化科确诊的32例UC患者和26例健康体检者或结肠单发息肉切除术后复查肠镜检查正常者, 按Baron评分标准进行内镜分级; 按Riley-Mani-goodman 分类方法进行病理学分级. 采用免疫组织化学SP法检测活动期溃疡性结肠炎内镜活检标本和正常对照石蜡包埋组织中COX-2、PPARγ和NF-κB p65的表达情况.
结果: 32例UC患者按Riley-Mani-goodman方法进行病理学分级Ⅰ级19例, Ⅱ级9例, Ⅲ级4例. UC组结肠黏膜炎症组织COX-2、NF-κB p65蛋白均为阳性表达, 主要分布于上皮细胞, 固有层炎性细胞, 对照组为阴性或弱阳性表达. 二者在UC炎症组织表达高于正常对照组(P<0.05); PPARγ主要表达于结肠上皮细胞的细胞质中, 在UC炎症组织表达低于正常对照组(P<0.05). 三者在UC组的表达与对照组相比, 差异均有非常显著性(P<0.01). COX-2蛋白表达与病理分级无相关; PPARγ蛋白表达与病理分级之间有负相关(H = 411, P<0.05). NF-κB p65蛋白表达与病理分级之间存在正相关(H = 16.77, P<0.01). COX-2与NF-κB p65蛋白表达正相关(r = 0.92, P<0.01), NF-κB p65与PPARγ蛋白表达负相关(r = 0.905, P<0.01).
结论: NF-κB的诱导参与UC的发生发展, COX-2, PPARγ也参与UC的炎症及损伤过程, COX-2可能通过作用于PPARγ-NF-κB p65 信号传导通路, 而影响UC炎症的发生发展. COX-2、PPARγ、NF-κB可能作为治疗UC的靶位, 在UC治疗中具有重要意义.
引文著录: 苗新普, 欧阳钦, 韦红. COX-2、PPARγ和NF-κB p65在溃疡性结肠炎组织中的表达及意义. 世界华人消化杂志 2010; 18(25): 2660-2665
Revised: July 1, 2010
Accepted: July 12, 2010
Published online: September 8, 2010
AIM: To investigate the significance of cyclooxygenase-2 COX-2), peroxisome proliferator-activated receptor γ (PPARγ), and nuclear transcription factor-kappa B (NF-κB) p65 expression in ulcerative colitis (UC) and to analyze their correlation.
METHODS: The colonic biopsies were collected from 32 UC patients and 26 healthy controls at West China Hospital. The endoscopic grades of UC were assessed according to the Baron Scale. The pathological grades of UC were classified according to the Riley-Mani-Goodman classification. The expression of COX-2, PPARγ and NF-κB P65 proteins in colonic mucosa was determined by immunohistochemistry.
RESULTS: According to Riley-Mani-Goodman classification, 19 UC patients had grade I disease, 9 had grade II disease, and 4 had grade III disease. COX-2 and NF-κB p65 proteins were mainly distributed in epithelial cells and lamina propria inflammatory cells in UC, but were negatively or weakly expressed in normal colonic mucosa. The expression levels of COX-2 and NF-κB p65 proteins in UC patients were significantly higher than those in healthy controls (both P < 0.05). PPARγ was mainly expressed in the cytoplasm of colonic epithelial cells. The expression of PPARγ protein in UC patients was significantly lower than that in healthy controls (P < 0.05). Although the expression of COX-2 protein was not correlated with the histological grade of UC, a good correlation between the expression of PPARγ and NF-κB p65 and histological grade was noted (H = 411, P < 0.05; H = 16.77, P < 0.01). There is a positive correlation between COX-2 and NF-κB p65 protein expression in UC (r = 0.92, P < 0.01), while a negative correlation was found between NF-κB P65 and PPARγ protein expression (r = 0.905, P < 0.01).
CONCLUSION: NF-κB expression is involved in the development and progression of UC. COX-2 and PPARγ are also involved in the process of inflammation/injury in UC. COX-2 affects the process of inflammation in UC possibly by acting upon the PPARγ-NF-κB p65 signaling pathway. COX-2, PPARγ and NF-κB p65 may be used as targets for UC therapy.
- Citation: Miao XP, Ouyang Q, Wei H. Significance of COX-2, PPARγ and NF-κB p65 expression in ulcerative colitis. Shijie Huaren Xiaohua Zazhi 2010; 18(25): 2660-2665
- URL: https://www.wjgnet.com/1009-3079/full/v18/i25/2660.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i25.2660
溃疡性结肠炎(ulcerative colitis, UC)是一种慢性反复发作的非特异肠道炎症, 病因尚不明确. 目前认为他是由于易感基因、环境因素及免疫因素之间相互作用, 引起黏膜免疫活性细胞激活, 产生炎性细胞因子和炎症介质, 而导致肠黏膜组织炎症. 过去我们一直认为本病少见, 但近年报道病例增加, 中国炎症性肠病协作组估计我国UC患病率约为11.62/100万, 已成为肠道主要疾病, 危害着我国人民身体健康[1]. 环氧合酶-2(cyclooxygenase-2, COX-2)在UC的发病中起重要作用, COX-2是催化AA生成前列腺素E2(prostaglandin E2, PGE2)的关键酶[2], PGE2具有扩血管、增加肠黏膜通透性和刺激肠上皮细胞分泌的作用, 可能与UC腹痛、腹泻的发生有关[3]. 过氧化物酶增殖物激活受体(peroxisome proliferater-activated receptor, PPAR)是一类配体激活的核转录因子超家族成员, 包括PPARα、PPARβ/δ和PPARγ三种表型. 其中PPARγ是UC炎症反应重要的调控因子[4]. PPARγ在结肠组织中表达较高, 与结肠炎症密切相关, PPARγ的配体可明显减轻UC患者和结肠炎动物模型的炎症[5,6]. 核因子-κB(nuclear factor-κB, NF-κB)是UC炎症过程中最重要的调控因子, 可以促进多种炎性细胞因子的转录, 是治疗UC的关键靶位[7]. 有研究表明COX-2、PPARγ和NF-κB p65之间紧密相关, COX-2的代谢产物前列腺素D2是PPARγ重要的天然配体, PPARγ与NF-κB p65密切相关. 三者存在一反馈抑制通路[8], 但在UC组织中三者关系如何, 相关研究未见报道. 因此, 我们检测COX-2、PPARγ和NF-κB p65在UC患者结肠黏膜的表达和分布, 探讨他们在UC发病机制中的作用及相互关系.
选择2007-08/2008-12在华西医院消化内科住院, 经内镜和病理证实的32例UC患者的资料, 到病理科提取患者结肠组织蜡块. 其中男18例, 女14例, 年龄18-72(中位年龄41.5)岁, 病程1 wk-12年. 对照组26例, 为性别、年龄与患者相匹配的健康体检者和结肠单发息肉切除术后复查肠镜检查正常者, 入选者均无其他疾病. 26例对照标本均经病理检查确认为正常组织. 兔抗人COX-2多克隆抗体、小鼠抗人PPARγ单克隆抗体、鼠抗人NF-κB p65单克隆抗体购自美国Santa Cruz公司.
1.2.1 诊断标准: 所有UC患者临床表现、消化系钡餐、肠镜和病理检查均符合2006年中华医学会消化分会炎症性肠病协作组制定的UC诊断标准[1].
1.2.2 UC患者的评分: 纳入的UC患者由2位受过专门培训的消化医师按分别按Southerland疾病活动指数(UCAI, 也称Mayo指数)进行疾病分期[9]; 2位病理科医生阅片按Riley-Mani-goodman标准进行组织学分级[10]: Ⅰ级: 无明显炎症; Ⅱ级: 轻到中度炎症; Ⅲ级: 重度炎症.
1.2.3 免疫组织化学SP法测定UC患者结肠黏膜COX-2、PPARγ和NF-κB p65蛋白的表达: 切片脱蜡, 3%过氧化氢处理, 高压锅加压修复抗原, 3%正常小牛血清封闭、依次滴加兔抗人COX-2多克隆抗体(1:200), 小鼠抗人PPARγ单克隆抗体(1:200)、鼠抗人NF-κB p65单克隆抗体(1:200), 滴加辣根过氧化物酶标记的链霉卵白素, SP复合物、DAB显色、苏木素复染. 用缓冲盐液替代一抗作阴性对照, 用已知阳性切片作阳性对照. 采用定量积分法, 每张切片至少观察5个高倍视野100个细胞, 对每张切片的阳性细胞比例及阳性细胞着色强度分别进行计分, 阳性细胞比例≤5%为0分, 6%-30%为1分, 31%-60%为2分, 61%-100%为3分. 阳性细胞着色强度: 细胞核着蓝色者, 无着色者为0分(阴性), 浅黄色为1分(弱阳性), 棕黄色为2分(阳性), 棕褐色为3分(强阳性). 然后根据二者乘积的积分进行统计分析.
统计学处理 所得实验数据用SPSS11.5软件进行分析. 等级资料多组之间比较采用H检验(Kruskal-Wallis法), 组与组之间比较采用秩和检验. COX-2、PPARγ、NF-κB p65相关性采用Spearman等级相关分析. P<0.05认为有统计学意义.
纳入的32例UC患者临床类型多为慢性复发型, 病变部位集中于直肠、乙状结肠. 按Southerland疾病活动指数(也称Mayo指数)进行疾病分期, 入选患者均为活动期; 按Riley-Mani-goodman标准进行组织学分级, 其中组织学分级1级19例, 2级9例, 3级4例.
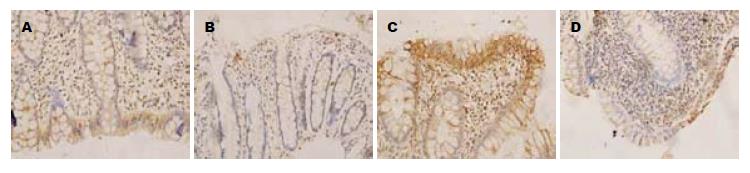
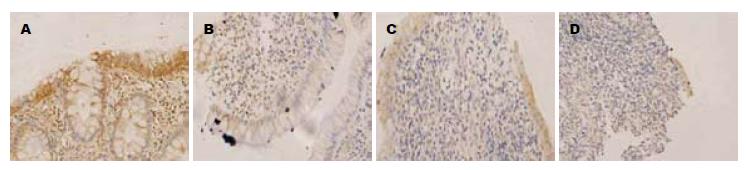
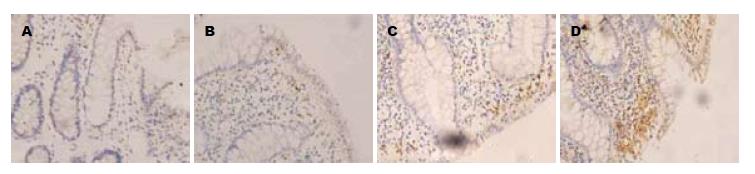
32例UC组织中COX-2、PPARγ和NF-κB p65蛋白表达率分别为81.25%、37.5%, 50.0%; 26例正常结肠黏膜COX-2、PPARγ和NF-κB p65蛋白表达率分别为11.54%, 53.85%, 23.08%, 三者在UC结肠炎症组织表达率与正常对照组比较差异有显著性(P<0.01). UC组COX-2、NF-κB p65蛋白炎症黏膜组织的表达高于正常对照组的表达; 其阳性表达率随病理分级增加而增加; UC炎症组织中PPARγ蛋白表达低于正常对照组(P>0.05). COX-2的表达在病理Ⅰ级与Ⅱ级比较差异无显著性(P>0.05), 病理Ⅰ级与Ⅲ级间比较差异无显著性(P>0.05), 病理Ⅱ级与Ⅲ级比较差异无显著性(P>0.05). COX-2的表达与病理分级之间无相关(H = 4.703, P>0.05, 表1). PPARγ的表达在病理Ⅰ级与Ⅱ级比较差异无显著性(P>0.05)、病理Ⅰ级与Ⅲ级间比较差异有显著性(P<0.01), 病理Ⅱ级与Ⅲ级比较差异有显著性(P<0.05). PPARγ的表达与病理分级之间存在相关(H = 411, P<0.05), 即PPARγ的阳性表达率与随病理分级增加而降低(表2). NF-κB p65的表达在病理Ⅰ级与Ⅱ级比较差异有显著性(P<0.01)、病理Ⅰ级与Ⅲ级间比较差异有显著性(P<0.01), 病理Ⅱ级与Ⅲ级比较差异有显著性(P<0.05). NF-κB p65的表达与病理分级之间存在相关(H = 16.77, P<0.01), 即NF-κB p65的阳性表达率与随病理分级增加而增加(图1-3, 表3).
| 分组 | n | COX-2阳性积分 | 阳性率(%) | P值 | ||||||
| 0 | 1 | 2 | 3 | 4 | 6 | 9 | ||||
| 对照组 | 26 | 23 | 2 | 1 | 0 | 0 | 0 | 0 | 11.54 | >0.05 |
| Ⅰ级 | 19 | 4 | 1 | 2 | 3 | 3 | 2 | 2 | 78.95 | |
| Ⅱ级 | 9 | 0 | 1 | 2 | 2 | 3 | 1 | 0 | 100.00 | |
| Ⅲ级 | 4 | 0 | 0 | 0 | 0 | 0 | 2 | 2 | 100.00 | |
| 分组 | n | PPARγ阳性积分 | 阳性率(%) | P值 | ||||||
| 0 | 1 | 2 | 3 | 4 | 6 | 9 | ||||
| 对照组 | 26 | 12 | 7 | 5 | 2 | 0 | 0 | 0 | 53.85 | <0.05 |
| Ⅰ级 | 19 | 11 | 5 | 3 | 0 | 0 | 0 | 0 | 42.11 | |
| Ⅱ级 | 9 | 6 | 0 | 0 | 0 | 1 | 1 | 1 | 33.33 | |
| Ⅲ级 | 4 | 3 | 0 | 0 | 0 | 0 | 0 | 1 | 25.00 | |
| 分组 | n | NF-κB p65阳性积分 | 阳性率(%) | P值 | ||||||
| 0 | 1 | 2 | 3 | 4 | 6 | 9 | ||||
| 对照组 | 26 | 20 | 4 | 2 | 0 | 0 | 0 | 0 | 23.08 | <0.01 |
| Ⅰ级 | 19 | 12 | 3 | 2 | 1 | 0 | 0 | 0 | 42.11 | |
| Ⅱ级 | 9 | 3 | 1 | 1 | 2 | 2 | 0 | 0 | 66.67 | |
| Ⅲ级 | 4 | 1 | 0 | 0 | 0 | 1 | 1 | 1 | 75.00 | |
根据病理分级, UC结肠黏膜组织中COX-2蛋白与PPARγ蛋白表达负相关(r = 0.715, P<0.01); COX-2蛋白与NF-κB p65蛋白的表达正相关(r = 0.92, P<0.01); PPARγ蛋白与NF-κB p65蛋白的表达负相关(r = 0.905, P<0.01).
UC的病因及发病机制至今仍不清楚, 目前大多数研究认为与免疫反应异常有关, 尤与肠黏膜局部免疫反应的异常关系密切. 各种细胞因子、炎性介质的相互作用形成复杂的甚至有自身放大作用的细胞因子网络, 促进炎症反应, 导致黏膜损伤, 在UC的发生发展中起着十分重要的作用[6].
目前认为COX-2属诱导型酶, 在炎症状态下, 可以被多种炎症递质和细胞因子所诱导. COX-2是炎症时PGE(主要是PGE2)生成增加的主要原因. 过量的PGE2致血管扩张, 通透性增加, 黏膜充血水肿, 可能参与UC腹痛腹泻症状的发生. 但另一方面, COX-2激活可以抑制TNF-α、IL-1β等细胞因子的分泌, 可以促进损伤时上皮细胞的增生和再生, 还具有抗炎作用[11,12], 因此COX-2的功能具有双向性. 我们研究显示: 在正常结肠黏膜中COX-2表达较低; 而在UC结肠黏膜炎症组织中COX-2蛋白表达增高, 提示COX-2表达与UC炎症发展密切相关. 但COX-2的表达与组织学分级无关, 说明COX-2在UC炎症中作用较复杂.
PPAR是一类配体激活的核转录因子超家族成员, 包括PPARα、PPARβ/δ和PPARγ三种表型. PPARγ抑制细胞因子IL-6、IL-8、TNF-α和INF-γ诱导的化学趋化因子的分泌, 抑制中性粒细胞、单核细胞聚集和脂质过氧化[13,14], 具有抑制炎症的作用. PPARγ表达受损与UC发病有关, 在UC发病过程中具有重要作用[15]. 我们的研究发现: PPARγ mRNA和蛋白在UC结肠黏膜炎症组织的表达低于正常组织, PPARγ蛋白表达与UC病理分级相关, 炎症程度越重, 其表达越低, 提示PPARγ在UC炎症的发生发展密切相关, 与以往研究结果一致[16].
NF-κB是最重要的炎症调控因子, 在UC炎症中发挥着关键的枢纽作用, 是多种抗炎症药物的靶标[17-19]. 在UC组织中, NF-κB p65在胞质中的表达是炎症状态的反映, p65在正常组织无或低表达, 而在活动期UC有不同程度高表达[20]. 我们的研究发现: NF-κB p65在水肿区、隐窝脓肿的隐窝上皮和上皮增生处表达增强, 染色以胞核为主. UC患者结肠黏膜炎症组织NF-κB p65 mRNA和蛋白表达较正常对照组增强, 随炎症程度的增加而增高, 且与UC病理分级正相关, 表明NF-κB p65的在UC炎症发生发展中起关键作用.
以往研究发现: COX-2和PPARγ信号通路关系密切. 人体内15d-PGJ2是AA经COX-2途径合成的代谢产物, 是PPARγ非常重要的天然配体, 能够与PPARγ结合抑制炎症反应, 其合成受COX-2的调控[21,22]. COX-2高表达可以促进15d-PGJ2的合成, 15d-PGJ2通过激活PPARγ, 拮抗激活蛋白(activator protein-1, AP-1)、NF-κB而产生抗炎作用. 而另一方面, 15d-PGJ2能抑制COX-2的表达[23,24], 可与核内的PPARγ受体结合, 通过PPARγ-NF-κB负反馈通路下调COX-2的活性[25]. 我们研究发现: 在UC患者结肠黏膜组织中, COX-2和PPARγ表达存在负相关, 提示 COX-2和PPARγ之间相互作用, 相互影响, 共同参与UC的炎症过程.
NF-κB与AA的代谢密切相关. 研究发现, COX-2基因的5'端flanking区域存在2个NF-κB位点序列. 活化的NF-κB可进入细胞核内, 与COX-2的启动子区域NF-κB位点相结合. 该位点序列发生定向突变后, 几乎完全封闭TNF-α对COX-2启动子连接的报告基因活性的诱导作用, 说明NF-κB位点为COX-2转录激活所必需, COX-2的表达受NF-κB的调节[26-28], 而另一方面COX-2过表达可反馈抑制NF-κB的活性[29]. 我们的研究发现在UC患者结肠黏膜组织中, COX-2与NF-κB p65的表达之间具有正相关, 说明二者关系密切.
研究发现: PPARγ对各种炎症因子的抑制作用主要是通过抑制NF-κB的活化来完成的, PPARγ配体可使NF-κB活性下降而达到缓解小鼠结肠炎症[30]. 可能机制是PPARγ配体激活了PPARγ而抑制NF-κB的活性, 从而减少细胞因子的基因表达. 我们的研究发现在UC患者结肠黏膜组织中, NF-κB p65和PPARγ蛋白的表达之间具有负相关, 提示二者在UC炎症发生中共同发挥重要作用.
总之, 我们的研究发现: 在UC结肠黏膜组织中COX-2蛋白的表达明显高于正常对照, 其蛋白表达与病理分级无相关; PPARγ蛋白低于正常对照, 其蛋白表达与病理分级之间负相关; NF-κB p65蛋白表达明显高于正常对照, 其蛋白表达与病理分级之间正相关. 在UC结肠黏膜组织中, COX-2、NF-κB p65与PPARγ表达密切相关. 提示UC肠黏膜组织中COX-2、NF-κB表达增高和PPARγ表达降低与UC的发病有关, 彼此之间密切相关. 我们推测COX-2可能通过作用于PPARγ-NF-κB p65信号传导通路, 而影响UC炎症的发生发展. PPARγ、COX-2和NF-κB p65可能作为治疗UC的靶位, 在UC治疗中具有重要意义.
UC的病因及发病机制至今仍不清楚, 目前大多数研究认为与免疫反应异常有关, 尤与肠黏膜局部免疫反应的异常关系密切. 各种细胞因子、炎性介质的相互作用形成复杂的甚至有自身放大作用的细胞因子网络, 促进炎症反应, 导致黏膜损伤, 在UC的发生发展中起着十分重要的作用.
高泽立, 主任医师, 上海交通大学医学院附属第九人民医院周浦分院消化科
有研究表明COX-2、PPARγ和NF-κB p65之间紧密相关, COX-2的代谢产物前列腺素D2是PPARγ重要的天然配体, PPARγ与NF-κB p65密切相关. 三者存在一反馈抑制通路, 但在UC组织中三者关系如何, 相关研究未见报道.
研究发现: PPARγ对各种炎症因子的抑制作用主要是通过抑制NF-κB的活化来完成的, PPARγ配体可使NF-κB活性下降而达到缓解小鼠结肠炎症.
PPARγ、COX-2和NF-κB p65可能作为治疗UC的靶位, 在UC治疗中具有重要意义.
本研究选题恰当, 统计学方法合理, 参考文献较新, 值得临床医师阅读.
编辑: 李军亮 电编:何基才
| 2. | Kozak KR, Rowlinson SW, Marnett LJ. Oxygenation of the endocannabinoid, 2-arachidonylglycerol, to glyceryl prostaglandins by cyclooxygenase-2. J Biol Chem. 2000;275:33744-33749. [PubMed] [DOI] |
| 3. | Rådmark O, Shimizu T, Jörnvall H, Samuelsson B. Leukotriene A4 hydrolase in human leukocytes. Purification and properties. J Biol Chem. 1984;259:12339-12345. [PubMed] |
| 4. | Pullman WE, Elsbury S, Kobayashi M, Hapel AJ, Doe WF. Enhanced mucosal cytokine production in inflammatory bowel disease. Gastroenterology. 1992;102:529-537. [PubMed] |
| 5. | Katz JA, Itoh J, Fiocchi C. Pathogenesis of inflammatory bowel disease. Curr Opin Gastroenterol. 1999;15:291-297. [PubMed] [DOI] |
| 6. | Neurath MF, Meyer zum Büschenfelde KH. Protective and pathogenic roles of cytokines in inflammatory bowel diseases. J Investig Med. 1996;44:516-521. [PubMed] |
| 7. | Atreya I, Atreya R, Neurath MF. NF-kappaB in inflammatory bowel disease. J Intern Med. 2008;263:591-596. [PubMed] [DOI] |
| 8. | Yeo M, Hahm KB. [Role of COX-2 and PPAR in gastric carcinogenesis]. Korean J Gastroenterol. 2004;44:53-56. [PubMed] |
| 9. | Schroeder KW, Tremaine WJ, Ilstrup DM. Coated oral 5-aminosalicylic acid therapy for mildly to moderately active ulcerative colitis. A randomized study. N Engl J Med. 1987;317:1625-1629. [PubMed] [DOI] |
| 10. | Riley SA, Mani V, Goodman MJ, Dutt S, Herd ME. Microscopic activity in ulcerative colitis: what does it mean? Gut. 1991;32:174-178. [PubMed] |
| 11. | Morteau O, Morham SG, Sellon R, Dieleman LA, Langenbach R, Smithies O, Sartor RB. Impaired mucosal defense to acute colonic injury in mice lacking cyclooxygenase-1 or cyclooxygenase-2. J Clin Invest. 2000;105:469-478. [PubMed] [DOI] |
| 12. | Halter F, Tarnawski AS, Schmassmann A, Peskar BM. Cyclooxygenase 2-implications on maintenance of gastric mucosal integrity and ulcer healing: controversial issues and perspectives. Gut. 2001;49:443-453. [PubMed] |
| 13. | Marx N, Mach F, Sauty A, Leung JH, Sarafi MN, Ransohoff RM, Libby P, Plutzky J, Luster AD. Peroxisome proliferator- activated receptor-gamma activators inhibit IFN-gamma-induced expression of the T cell-active CXC chemokines IP-10, Mig, and I-TAC in human endothelial cells. J Immunol. 2000;164:6503-6508. [PubMed] |
| 14. | Cuzzocrea S, Pisano B, Dugo L, Ianaro A, Britti D, Patel NS, Di Paola R, Genovese T, Di Rosa M, Caputi AP. Rosiglitazone, a ligand of the peroxisome proliferator-activated receptor-gamma, reduces acute pancreatitis induced by cerulein. Intensive Care Med. 2004;30:951-956. [PubMed] [DOI] |
| 15. | Su CG, Wen X, Bailey ST, Jiang W, Rangwala SM, Keilbaugh SA, Flanigan A, Murthy S, Lazar MA, Wu GD. A novel therapy for colitis utilizing PPAR-gamma ligands to inhibit the epithelial inflammatory response. J Clin Invest. 1999;104:383-389. [PubMed] [DOI] |
| 17. | Andresen L, Jørgensen VL, Perner A, Hansen A, Eugen-Olsen J, Rask-Madsen J. Activation of nuclear factor kappaB in colonic mucosa from patients with collagenous and ulcerative colitis. Gut. 2005;54:503-509. [PubMed] |
| 18. | Kaltschmidt C, Kaltschmidt B, Neumann H, Wekerle H, Baeuerle PA. Constitutive NF-kappa B activity in neurons. Mol Cell Biol. 1994;14:3981-3992. [PubMed] |
| 19. | Schreiber S, Nikolaus S, Hampe J. Activation of nuclear factor kappa B inflammatory bowel disease. Gut. 1998;42:477-484. [PubMed] |
| 20. | Goulet JL, Snouwaert JN, Latour AM, Coffman TM, Koller BH. Altered inflammatory responses in leukotriene-deficient mice. Proc Natl Acad Sci U S A. 1994;91:12852-12856. [PubMed] [DOI] |
| 21. | Maggi LB Jr, Sadeghi H, Weigand C, Scarim AL, Heitmeier MR, Corbett JA. Anti-inflammatory actions of 15-deoxy-delta 12,14-prostaglandin J2 and troglitazone: evidence for heat shock-dependent and -independent inhibition of cytokine- induced inducible nitric oxide synthase expression. Diabetes. 2000;49:346-355. [PubMed] [DOI] |
| 22. | Kliewer SA, Lenhard JM, Willson TM, Patel I, Morris DC, Lehmann JM. A prostaglandin J2 metabolite binds peroxisome proliferator-activated receptor gamma and promotes adipocyte differentiation. Cell. 1995;83:813-819. [PubMed] |
| 23. | Inoue H, Tanabe T, Umesono K. Feedback control of cyclooxygenase-2 expression through PPARgamma. J Biol Chem. 2000;275:28028-28032. [PubMed] |
| 24. | Subbaramaiah K, Lin DT, Hart JC, Dannenberg AJ. Peroxisome proliferator-activated receptor gamma ligands suppress the transcriptional activation of cyclooxygenase-2. Evidence for involvement of activator protein-1 and CREB-binding protein/p300. J Biol Chem. 2001;276:12440-12448. [PubMed] [DOI] |
| 25. | Janabi N. Selective inhibition of cyclooxygenase-2 expression by 15-deoxy-Delta(12,14)(12,14)-prostaglandin J(2) in activated human astrocytes, but not in human brain macrophages. J Immunol. 2002;168:4747-4755. [PubMed] |
| 26. | Benitah SA, Valerón PF, Lacal JC. ROCK and nuclear factor-kappaB-dependent activation of cyclooxygenase-2 by Rho GTPases: effects on tumor growth and therapeutic consequences. Mol Biol Cell. 2003;14:3041-3054. [PubMed] [DOI] |
| 27. | Yamamoto K, Arakawa T, Ueda N, Yamamoto S. Transcriptional roles of nuclear factor kappa B and nuclear factor- interleukin-6 in the tumor necrosis factor alpha-dependent induction of cyclooxygenase-2 in MC3T3-E1 cells. J Biol Chem. 1995;270:31315-31320. [PubMed] [DOI] |
| 28. | Schmedtje JF Jr, Ji YS, Liu WL, DuBois RN, Runge MS. Hypoxia induces cyclooxygenase-2 via the NF-kappaB p65 transcription factor in human vascular endothelial cells. J Biol Chem. 1997;272:601-608. [PubMed] [DOI] |
| 29. | Granja AG, Nogal ML, Hurtado C, Vila V, Carrascosa AL, Salas ML, Fresno M, Revilla Y. The viral protein A238L inhibits cyclooxygenase-2 expression through a nuclear factor of activated T cell-dependent transactivation pathway. J Biol Chem. 2004;279:53736-53746. [PubMed] [DOI] |
| 30. | Bassaganya-Riera J, Reynolds K, Martino-Catt S, Cui Y, Hennighausen L, Gonzalez F, Rohrer J, Benninghoff AU, Hontecillas R. Activation of PPAR gamma and delta by conjugated linoleic acid mediates protection from experimental inflammatory bowel disease. Gastroenterology. 2004;127:777-7919. [PubMed] [DOI] |