修回日期: 2010-08-07
接受日期: 2010-08-10
在线出版日期: 2010-09-08
目的: 评价EGFR过表达与中国胃癌患者临床病理学参数间的相关性及其临床意义.
方法: 采用EliVisionTM plus免疫组织化学染色方法检测775例胃腺癌标本中EGFR蛋白的表达.
结果: EGFR在胃癌组织中阳性表达率为17.03%(132/775); EGFR蛋白表达与患者性别、年龄、肿瘤部位、TNM分期及远处转移无相关性(P>0.05); 而与肿瘤浸润深度、组织学类型、分化程度、淋巴结转移相关(P<0.05); 经多因素分析, 肿瘤浸润深度、组织学类型、分化程度、淋巴结转移均会影响EGFR的表达(P<0.05).
结论: EGFR检测可以作为评估胃癌恶性生物学行为及预后的指标, 并为靶向治疗提供理论依据.
引文著录: 刘伟, 余英豪, 陈娟, 熊喜生, 欧阳学农, 王烈, 武一曼. EGFR在中国胃癌患者中的表达及其临床意义. 世界华人消化杂志 2010; 18(25): 2648-2653
Revised: August 7, 2010
Accepted: August 10, 2010
Published online: September 8, 2010
AIM: To investigate the correlation between epidermal growth factor receptor (EGFR) protein expression and clinicopathological parameters in patients with gastric cancer.
METHODS: The expression of EGFR protein in 775 gastric adenocarcinoma specimens was examined by immunohistochemistry using the EliVisionTM plus kit.
RESULTS: The positive rate of EGFR protein overexpression in gastric adenocarcinoma was 17.03% (132/775). EGFR protein overexpression is associated with tumor invasion depth, histotype, differentiation, and lymph node metastasis (all P < 0.05), but not with sex, age, tumor site, TNM stage, and distant metastasis (all P > 0.05). Multivariate analysis demonstrated that tumor invasion depth, histotype, differentiation, and lymph node metastasis were significant predictors of EGFR protein overexpression in gastric cancer (all P < 0.05).
CONCLUSION: Detection of EGFR protein expression can be used to assess the malignant biological behavior and prognosis of gastric cancer and therefore provides a theoretical target for therapy of gastric cancer.
- Citation: Liu W, Yu YH, Chen J, Xiong XS, Ouyang XN, Wang L, Wu YM. Clinical significance of EGFR expression in Chinese gastric cancer patients. Shijie Huaren Xiaohua Zazhi 2010; 18(25): 2648-2653
- URL: https://www.wjgnet.com/1009-3079/full/v18/i25/2648.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i25.2648
胃癌是人类最常见的恶性肿瘤之一, 位居消化系肿瘤之首[1]. 目前, 胃癌的治疗仍以手术为主, 放化疗为辅, 但大部分患者在诊断时已属晚期, 化疗效果不明显, 有待于寻求新的靶向药物提高疗效. 表皮生长因子受体(epidermal growth factor receptor, EGFR)在胃癌组织中过表达, 为胃癌治疗提供了一个靶向治疗的靶点. EGFR通过下游的信号传导途径参与肿瘤细胞增殖、血管生成、侵袭、转移及凋亡抑制等基因调控, 与胃癌的发生、发展及生物学行为密切相关[2]. 本课题组前期对大宗胃癌病例进行了Her-2蛋白检测, 发现胃癌组织中存在Her-2蛋白的过表达[3]. 由于EGFR与Her-2同属HER/erbB的成员, 鉴于目前国内尚未见关于胃癌与EGFR相关性的大宗病例报道, 本研究采用免疫组织化学方法(immunohistochemistry, IHC)检测同组胃癌病例组织中EGFR的表达, 探讨EGFR与胃癌发生发展、浸润转移等临床病理特征及预后的关系, 以期为针对EGFR过表达胃癌的靶向治疗提供理论参考依据.
收集2006-01/2009-08在中国人民解放军南京军区福州总医院手术切除的胃癌组织标本1 107例, 选择资料完整的胃腺癌病例775例进行研究. 手术标本经10%中性甲醛固定, 石蜡包埋, 3 μm厚连续切片, 分别进行HE和免疫组织化学染色; 所有病例术前均未行放化疗. 患者中男576例, 女199例, 年龄27-85(平均58.2)岁. 胃癌TNM分期采用AJCC标准(2002). 组织分型采用Lauren分型标准, 分为肠型、弥漫型、混合型. 另外, 在775例胃腺癌病例中随机抽取100例癌旁(距癌灶距离>5 cm)非肿瘤性胃黏膜作为对照. 试剂均购自福州迈新生物技术开发公司, 一抗为鼠抗人单克隆抗体EGFR. 试剂盒选用EliVisionTM plus试剂盒. 石蜡切片机(LEICA RM2245); 显微镜(OLYMPUS BX51); 电热恒温干燥箱(上海-恒科技有限公司). 所有标记均设阳性对照并用PBS缓冲液代替一抗做阴性对照.
1.2.1 采用EliVisionTM plus免疫组织化学染色方法: 石蜡切片脱蜡、水化, PBS冲洗3×3 min; 高温高压抗原修复; 加3%过氧化氢溶液, 室温下孵育10 min, 以阻断内源性过氧化物酶; PBS冲洗3×3 min; 加第一抗体, 室温下孵育60 min; PBS冲洗3×5 min; 加聚合物增强剂(试剂A), 室温下孵育20 min; PBS冲洗3×3 min; 加酶标抗鼠聚合物(试剂B), 室温下孵育30 min; PBS冲洗3×3 min; 加新配制的DAB显色液, 显微镜下观察3-10 min, 阳性显色为棕黄色; 自来水冲洗, 苏木素复染, 0.1%盐酸分化, 自来水冲洗, PBS冲洗返蓝; 梯度酒精脱水干燥, 中性树脂封片.
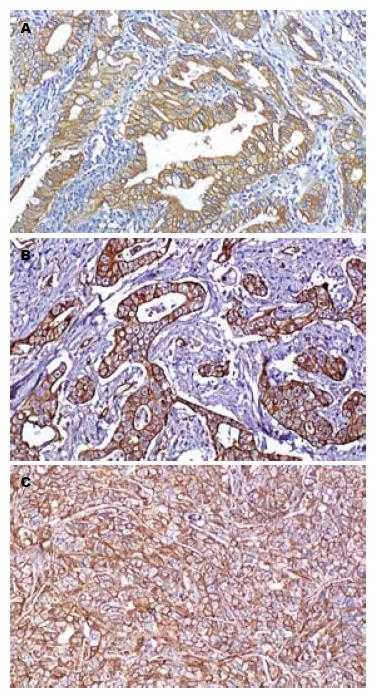
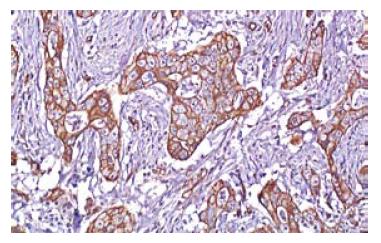
1.2.2 EGFR过表达的分析方法: 阳性染色呈棕黄色颗粒, 定位于细胞膜. 肿瘤细胞不着色/<10%的肿瘤细胞着色为阴性(-), ≥10%的肿瘤细胞着色为阳性[4,5], 并根据肿瘤阳性细胞数所占比例分为: 10%-25%(+), 26%-50%(++), 50%-75%(+++), >75%(++++).
统计学处理 采用SPSS16.0软件进行χ2检验分析. 通过多因素分析, 对各个因素之间的关系进行分析.
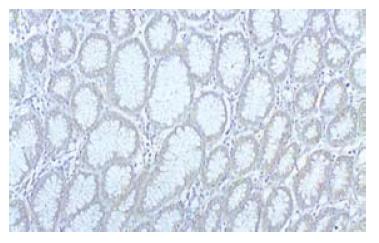
胃癌组织中EGFR阳性反应定位于细胞膜, 其表达呈明显的异质性(图1, 2). 癌旁(距癌灶距离>5 cm)非肿瘤性胃黏膜未见EGFR的过表达(图3).
775例胃癌组织中EGFR阳性表达132例, 表达率为17.03%. EGFR蛋白表达与患者性别、年龄、肿瘤部位、TNM分期及远处转移无相关性(P>0.05), 而与浸润深度、组织类型、分化程度、淋巴结转移相关(P<0.05). 经多因素分析, 浸润深度、组织类型、分化程度、淋巴结转移均会影响EGFR的表达(P<0.05, 表1).
| 临床病理参数 | n | - | + | ++ | +++ | ++++ | EGFR阳性n(%) | P值 |
| 性别 | ||||||||
| 男 | 576 | 478 | 36 | 28 | 15 | 19 | 98(17.0) | >0.500 |
| 女 | 199 | 165 | 15 | 5 | 6 | 8 | 34(17.1) | |
| 年龄(岁) | ||||||||
| <60 | 363 | 309 | 22 | 9 | 12 | 11 | 54(14.9) | >0.100 |
| ≥60 | 412 | 334 | 37 | 21 | 10 | 10 | 78(18.9) | |
| 肿瘤部位 | ||||||||
| 胃食管连接部胃癌 | 324 | 268 | 22 | 16 | 8 | 10 | 56(17.3) | >0.500 |
| 胃部胃癌 | 451 | 375 | 24 | 21 | 14 | 17 | 76(16.9) | |
| 浸润深度 | ||||||||
| Tis | 2 | 2 | 0 | 0 | 0 | 0 | 0(0.0) | <0.001 |
| T1 | 51 | 50 | 0 | 1 | 0 | 0 | 1(2.0) | |
| T2 | 314 | 259 | 20 | 10 | 10 | 15 | 55(17.5) | |
| T3 | 385 | 317 | 24 | 21 | 12 | 11 | 68(17.7) | |
| T4 | 23 | 15 | 3 | 3 | 0 | 2 | 8(34.8) | |
| Lauren分型 | ||||||||
| 肠型 | 285 | 225 | 22 | 20 | 6 | 12 | 60(21.1) | <0.050 |
| 弥漫型 | 313 | 275 | 11 | 14 | 6 | 7 | 38(12.1) | |
| 混合型 | 177 | 143 | 12 | 9 | 5 | 8 | 34(19.2) | |
| 分化程度 | ||||||||
| 高、中分化 | 461 | 362 | 37 | 31 | 10 | 21 | 99(21.5) | <0.001 |
| 低、未分化 | 314 | 281 | 9 | 12 | 5 | 7 | 33(10.5) | |
| TNM分期 | ||||||||
| 0+Ⅰ+Ⅱ | 351 | 294 | 18 | 15 | 10 | 14 | 57(16.2) | >0.500 |
| Ⅲ、Ⅳ | 424 | 349 | 28 | 20 | 12 | 15 | 75(17.7) | |
| 淋巴结转移 | ||||||||
| N0 | 251 | 218 | 5 | 13 | 7 | 8 | 33(13.1) | <0.001 |
| N1 | 322 | 272 | 23 | 12 | 6 | 9 | 50(15.5) | |
| N2 | 168 | 128 | 18 | 10 | 5 | 7 | 40(23.8) | |
| N3 | 70 | 61 | 4 | 1 | 1 | 3 | 9(12.9) | |
| 远处转移 | ||||||||
| 有 | 89 | 76 | 5 | 5 | 1 | 2 | 13(14.6) | >0.500 |
| 无 | 686 | 567 | 42 | 33 | 19 | 25 | 119(17.3) |
EGFR是原癌基因C-erbB-1的表达产物, 是表皮生长因子受体家族的成员之一, 即ErbB1, 该家族属于酪氨酸激酶Ⅰ型受体. EGFR广泛表达于食管癌、胃癌、胰腺癌、肠癌、肺癌以及乳腺癌、前列腺癌等肿瘤, 其能与表皮生长因子(epidermal growth factor, EGF)等配体结合抑制肿瘤细胞凋亡, 促进肿瘤细胞增殖、血管生成、黏附、侵袭和转移[6,7].
关于EGFR在胃癌中表达的报道不一致, 文献报道EGFR在胃癌组织中表达的阳性率为19%-60%[8], 本研究中EGFR的阳性率为17.03%, 稍低于文献报道, 表达的差异性可能是由于样本量大小、检测方法及评分标准不同所致. 本研究中EGFR的阳性表达率与胃癌患者的性别、年龄、肿瘤部位无相关性, 这与国内外报道相一致[9,10]. 而EGFR与其他胃癌临床病理参数的关系的报道不尽相同. Galizia等[9]研究认为EGFR的表达与浸润深度、TNM分期、组织类型、血管侵犯、淋巴结转移及远处转移等密切相关, 而与性别、年龄、肿瘤部位无关, 而且EGFR阳性患者的预后(5年生存率为40%)较EGFR阴性患者预后(5年生存率为60%)差. Song等[4]研究认为EGFR的表达与肿瘤分化程度、神经侵犯有关, 而与性别、年龄、肿瘤部位、浸润深度、TNM分期、组织类型、淋巴结转移及远处转移等无明显相关性. 陈斌等[10]检测103例胃癌标本中EGFR蛋白的表达, 结果显示EGFR表达与患者的性别、年龄、肿瘤大小、部位、分化程度均无相关性, 而与肿瘤的浸润深度、病理分期、淋巴结转移、远处转移具有相关性, 而且EGFR表达阳性的胃癌患者预后较差(阳性患者中位生存时间为11.0 mo, 阴性患者为65.2 mo). 本研究中EGFR的表达与浸润深度、组织类型、分化程度、淋巴结转移有相关性, 而且EGFR阳性表达率随浸润深度增加、组织分化程度增高而增高, 而与肿瘤部位、TNM分期及远处转移无相关性, 与以上研究结果基本一致. 以上研究证实胃癌组织细胞EGFR表达与肿瘤分化程度、浸润深度、淋巴结转移、远处转移等预后指标密切相关, 而且在正常胃黏膜中未见EGFR表达, 初步表明在肿瘤细胞中EGFR被激活、并促进了癌细胞浸润、淋巴转移, 使EGFR阳性患者较阴性患者的预后差. 本课题组前期同组大宗病例研究发现[3], 表皮生长因子受体2(Her-2)阳性表达率为11.35%, 与性别、年龄、肿瘤部位、浸润深度及淋巴结转移无相关性而与组织类型、分化程度、TNM分期及远处转移相关, 可见EGFR与Her-2均可以作为评价患者预后的一个参考指标.
Her-2与EGFR同属HER/erbB的成员, 两者在胃癌中均有过表达, 且与临床病理参数之间密切相关, 那么两者的表达是否具有相关性? 将本次EGFR的阳性表达与前期同组大宗病例研究Her-2的阳性表达[3]进行关联性检验分析发现, 虽然Her-2与EGFR在胃癌中都有过表达, 但两者的过表达并无相关性(P>0.05), 这与Lieto等[11]研究一致. 这可能与两者促进胃癌侵袭转移的机制不同有关.
EGFR基因或蛋白在胃癌组织中的过表达为胃癌的治疗提供了新的思路, 近年来, 针对EGFR为靶点的靶向治疗药物主要包括EGFR单克隆抗体和EGFR酪氨酸激酶拮抗剂. 针对EGFR为靶点的靶向治疗已在非小细胞肺癌、头颈部鳞癌、乳腺癌、结直肠癌等肿瘤的治疗中取得了一定疗效[12], 但这些靶向药物在胃癌中的使用尚无大规模的临床试验报道.
西妥昔单抗(Cetuximab)为EGFR单克隆抗体, 能特异性地与肿瘤细胞膜表面EGFR结合, 竞争性抑制EGF等配体与EGFR的结合, 阻断EGFR磷酸化和与受体相关激酶的激活, 从而抑制细胞生长、诱导凋亡、减少基质金属蛋白酶(MMP)和血管内皮生长因子(vascular endothelial growth factor, VEGF)的产生. Pinto等[13]应用Cetuximab+Folfiri方案一线治疗晚期胃癌的Ⅱ期临床试验的总体有效率为44.1%, 中位疾病进展时间为8 mo, 中位生存时间为16 mo, 该方案较单用Folfiri有更好的疗效. Lordick等[14]报道应用Cetuximab联合化疗治疗晚期转移性胃癌患者52例, 在46例可评疗效的患者中, 总缓解率为65%(30/46), 其中4例达完全缓解. 吉非替尼(Gefitinib)、埃罗替尼(Erlotinib)等为EGFR酪氨酸激酶拮抗剂, 能抑制EGFR激酶区磷酸化, 而阻断下游相关信号传导, 从而发挥抗肿瘤作用, 在晚期胃癌患者的治疗中亦取得了一定的临床疗效[15,16]. 应用EGFR靶向药物治疗胃癌已取得一定的临床疗效, 但其确切疗效尚需大规模临床试验进一步证实.
胃癌EGFR过表达是由基因扩增还是由突变引起的还存在争议, 得出的结论不一致. Kimura等[17]研究显示, 在胃癌中EGFR有高表达, 但无基因扩增. Mitsui等[18]研究认为EGFR有高表达, 基因扩增率为4%. Moutinho等[19]报道EGFR基因突变率为8%(6/77), 基因扩增率为5%(4/77). Mammano等[20]报道胃癌组织中EGFR基因扩增率为6%(3/49), 但未检测到基因突变.
EGFR靶向药物在胃癌的治疗中已取得了一定的临床疗效, 而靶向药物的应用有赖于对靶向药物的准确的筛选方法. 目前, 用于EGFR检测的方法主要有: IHC检测EGFR蛋白表达、荧光原位杂交法(fluorescence in situ hybridization, FISH)检测EGFR基因扩增和荧光定量PCR检测EGFR基因突变位点. IHC方法检测EGFR蛋白表达往往受到抗体浓度, 抗原修复方式、显色方式, 结果判读主观差异等方面的影响; FISH是分子遗传学常用的检测技术, 是目前公认的检测基因表达的金标准, 与IHC相比, 具有高稳定性、高准确性和高灵敏性的特点. 本课题组后续的研究中, 将经IHC证实EGFR蛋白表达阳性的病例, 应用FISH和荧光定量PCR方法分别检测EGFR基因扩增和基因突变情况, 分析与IHC检测的相关性, 进一步探索胃癌EGFR过表达的机制, 并为临床选取针对EGFR抗体的靶向药物提供更为可靠的理论依据.
胃癌在全世界肿瘤中占第2位, 居消化系肿瘤之首. 大部分患者在诊断时已属晚期, 化疗效果不明显, 迫切需要寻求新的靶向药物以提高疗效.
刘云鹏, 教授, 中国医科大学附属第一医院肿瘤内科
关于EGFR基因与肿瘤的关系, 多数研究集中在非小细胞肺癌和结肠癌上, 目前国内未见有关EGFR与胃癌关系的大宗病例研究.
关于EGFR在胃癌中表达的报道不一致, 文献报道EGFR在胃癌组织中表达的阳性率为19%-60%, 本研究中EGFR的阳性率为17.03%, 稍低于文献报道, 表达的差异性可能是由于样本量大小、检测方法及评分标准不同所致.
本文采用大宗病例研究, 综合分析EGFR与胃癌的临床病理参数的关系, EGFR可以作为评估胃癌生物学行为及预后的指标, 并为靶向治疗提供理论依据.
本研究样本量较大, 可信度高, 具有很好的学术价值.
编辑: 李军亮 电编:何基才
| 1. | Jemal A, Siegel R, Ward E, Hao Y, Xu J, Thun MJ. Cancer statistics, 2009. CA Cancer J Clin. 2009;59:225-249. [PubMed] [DOI] |
| 2. | Liakakos T, Xeropotamos N, Ziogas D, Roukos D. EGFR as a Prognostic Marker for Gastric Cancer. World J Surg. 2008;32:1225-1226; author reply 1227-1229. [PubMed] [DOI] |
| 3. | 陈 娟, 李 东石, 余 英豪, 王 烈, 欧阳 学农, 谢 飞来, 熊 喜生. Her-2蛋白在胃癌中的表达及其临床意义. 世界华人消化 杂志. 2010;18:1375-1379. [DOI] |
| 4. | Song HS, Do YR, Kim IH, Sohn SS, Kwon KY. Prognostic significance of immunohistochemical expression of EGFR and C- erbB-2 oncoprotein in curatively resected gastric cancer. Cancer Res Treat. 2004;36:240-245. [PubMed] [DOI] |
| 6. | Ciardiello F, Tortora G. EGFR antagonists in cancer treatment. N Engl J Med. 2008;358:1160-1174. [PubMed] [DOI] |
| 7. | Tamás P, Solti Z, Bauer P, Illés A, Sipeki S, Bauer A, Faragó A, Downward J, Buday L. Mechanism of epidermal growth factor regulation of Vav2, a guanine nucleotide exchange factor for Rac. J Biol Chem. 2003;278:5163-5171. [PubMed] [DOI] |
| 8. | Rocha-Lima CM, Soares HP, Raez LE, Singal R. EGFR targeting of solid tumors. Cancer Control. 2007;14:295-304. [PubMed] |
| 9. | Galizia G, Lieto E, Orditura M, Castellano P, Mura AL, Imperatore V, Pinto M, Zamboli A, De Vita F, Ferraraccio F. Epidermal growth factor receptor (EGFR) expression is associated with a worse prognosis in gastric cancer patients undergoing curative surgery. World J Surg. 2007;31:1458-1468. [PubMed] [DOI] |
| 11. | Lieto E, Ferraraccio F, Orditura M, Castellano P, Mura AL, Pinto M, Zamboli A, De Vita F, Galizia G. Expression of vascular endothelial growth factor (VEGF) and epidermal growth factor receptor (EGFR) is an independent prognostic indicator of worse outcome in gastric cancer patients. Ann Surg Oncol. 2008;15:69-79. [PubMed] [DOI] |
| 13. | Pinto C, Di Fabio F, Siena S, Cascinu S, Rojas Llimpe FL, Ceccarelli C, Mutri V, Giannetta L, Giaquinta S, Funaioli C. Phase II study of cetuximab in combination with FOLFIRI in patients with untreated advanced gastric or gastroesophageal junction adenocarcinoma (FOLCETUX study). Ann Oncol. 2007;18:510-517. [PubMed] [DOI] |
| 14. | Lordick F, Luber B, Lorenzen S, Hegewisch-Becker S, Folprecht G, Wöll E, Decker T, Endlicher E, Röthling N, Schuster T. Cetuximab plus oxaliplatin/leucovorin/5-fluorouracil in first-line metastatic gastric cancer: a phase II study of the Arbeitsgemeinschaft Internistische Onkologie (AIO). Br J Cancer. 2010;102:500-505. [PubMed] [DOI] |
| 15. | Rojo F, Tabernero J, Albanell J, Van Cutsem E, Ohtsu A, Doi T, Koizumi W, Shirao K, Takiuchi H, Ramon y Cajal S. Pharmacodynamic studies of gefitinib in tumor biopsy specimens from patients with advanced gastric carcinoma. J Clin Oncol. 2006;24:4309-4316. [PubMed] [DOI] |
| 16. | Dragovich T, McCoy S, Fenoglio-Preiser CM, Wang J, Benedetti JK, Baker AF, Hackett CB, Urba SG, Zaner KS, Blanke CD. Phase II trial of erlotinib in gastroesophageal junction and gastric adenocarcinomas: SWOG 0127. J Clin Oncol. 2006;24:4922-4927. [PubMed] [DOI] |
| 17. | Kimura M, Tsuda H, Morita D, Shinto E, Tanimoto T, Ichikura T, Mochizuki H, Matsubara O. Usefulness and limitation of multiple endoscopic biopsy sampling for epidermal growth factor receptor and c-erbB-2 testing in patients with gastric adenocarcinoma. Jpn J Clin Oncol. 2005;35:324-331. [PubMed] [DOI] |
| 18. | Mitsui F, Dobashi Y, Imoto I, Inazawa J, Kono K, Fujii H, Ooi A. Non-incidental coamplification of Myc and ERBB2, and Myc and EGFR, in gastric adenocarcinomas. Mod Pathol. 2007;20:622-631. [PubMed] [DOI] |
| 19. | Moutinho C, Mateus AR, Milanezi F, Carneiro F, Seruca R, Suriano G. Epidermal growth factor receptor structural alterations in gastric cancer. BMC Cancer. 2008;8:10. [PubMed] [DOI] |
| 20. | Mammano E, Belluco C, Sciro M, Mencarelli R, Agostini M, Michelotto M, Marchet A, Nitti D. Epidermal growth factor receptor (EGFR): mutational and protein expression analysis in gastric cancer. Anticancer Res. 2006;26:3547-3550. [PubMed] |