修回日期: 2010-07-15
接受日期: 2010-07-26
在线出版日期: 2010-09-08
目的: 探讨α-硫辛酸对实验性大鼠急性胰腺炎(acute pancreatitis, AP)并发肝损伤的抑制作用及机制.
方法: 采用3.5%牛磺胆酸钠逆行胰胆管注射制备急性胰腺炎大鼠模型, 将♂Wistar大鼠54只, 随机分为3组, 假手术组(SO组, n = 18)、急性胰腺炎组(AP 组, n = 18)、α-硫辛酸治疗组(ALA组, n = 18), 于造模后腹腔内注射α-硫辛酸(1 mg/kg), 各组以不同时间点3、6、12 h分为3个亚组, 每个亚组为6只大鼠. 采用生化法测定血清的淀粉酶及肝功能ALT、AST水平; 比色法测定肝组织中超氧化物歧化酶(SOD)活力、丙二醛(MDA)含量; 应用HE染色, 观察胰腺、肝脏组织病理学变化, 免疫组织化学法测定肝组织ICAM-1、VCAM-1蛋白的表达.
结果: 在AP组各时间点血清淀粉酶、ALT、SAT及肝组织中MDA含量均较SO组显著升高(3 h: 1 525.17±370.36 vs 134.67±37.46, 101.17±22.33 vs 35.40±5.71, 62.71±19.16 vs 38.25±4.63, P<0.01; 2.83±0.6 vs 2.12±0.41, P<0.05), 而肝组织的SOD活力则明显降低(3 h: 43.12±5.87 vs 50.49±7.08, P<0.05), 肝脏病理学可见以多处灶状坏死, 伴大量炎性细胞浸润. 在假手术组肝组织中几乎没有ICAM-1与VCAM-1的表达, 而在AP组中则有较强的表达. 与AP组相比, 在ALA组血清淀粉酶、ALT、AST及肝组织MDA含量较AP模型组明显降低(3 h: 1 141.50±617.01, 78.11±15.50, 47.16±12.25, 2.37±0.48, P<0.05), SOD活力则明显升高(3 h: 45.36±5.67, P<0.05), 肝脏病理学显示肝损伤改善, 有少量肝细胞坏死, 炎性反应明显减少; ICAM-1与VCAM-1表达明显减弱.
结论: ALA对大鼠AP合并肝损伤有较好抑制作用, 其机制可能与抗氧化作用以及抑制炎性细胞因子ICAM-1与VCAM-1的表达有关.
引文著录: 赵丽梅, 冯志杰, 孙泽明, 宋梅. α-硫辛酸对大鼠急性胰腺炎并发肝损伤的抑制作用. 世界华人消化杂志 2010; 18(25): 2631-2636
Revised: July 15, 2010
Accepted: July 26, 2010
Published online: September 8, 2010
AIM: To explore the inhibitory effect of α-lipoic acid (ALA) on hepatic injury in rats with acute pancreatitis (AP).
METHODS: A rat model of AP was established by retrograde injection of 3.5% sodium taurocholate into the biliopancreatic duct. Fifty-four Wistar rats (n = 54) were randomly divided into three groups: sham-operation group (SO group, n = 18), acute pancreatitis group (AP group, n = 18), and ALA treatment group (ALA group, n = 18). The ALA group was intraperitoneally injected with 1 mg/kg ALA. Each group were further divided into 3 subgroups (n = 6) for testing at 3, 6 and 12 h after treatment. The levels of serum amylase, alanine aminotransferase (ALT) and aspartate aminotransferase (AST) were determined using an automatic biochemical analyzer. The SOD activity and MDA level in liver tissue were measured by colorimetry. Pancreatic gland and liver histological changes were evaluated by hematoxylin and eosin (HE) staining. The expression of ICAM-1 and VCAM-1 in liver tissue was determined by immunohistochemistry.
RESULTS: The levels of serum amylase, ALT, AST and hepatic MDA at all time points were significantly increased (3 h: 1 525.17 ± 370.36 vs 134.67 ± 37.46, 101.17 ± 22.33 vs 35.40 ± 5.71, 62.71 ± 19.16 vs 38.25 ± 4.63 and 2.83 ± 0.6 vs 2.12 ± 0.41, all P < 0.01 or 0.05) and SOD activity was decreased (3 h: 43.12 ± 5.87 vs 50.49 ± 7.08, P < 0.05) in the AP group compared with the SO group. Histological examination showed multifocal necrosis and inflammatory cell infiltration in the AP group. The expression of ICAM-1 and VCAM-1 in liver tissue was enhanced in the AP group, but was undetectable in the SO group. In the ALA group, the levels of serum amylase, ALT, AST and hepatic MDA were significantly decreased (3 h: 1 141.50 ± 617.01, 78.11 ± 15.50, 47.16 ± 12.25 and 2.37 ± 0.48, all P < 0.05) and SOD activity was increased (3 h: 45.36 ± 5.67, P < 0.05) compared with the AP group. Hepatic injury was improved and the expression of ICAM-1 and VCAM-1 was significantly decreased in the ALA group compared with the AP group.
CONCLUSION: ALA exerts a protective effect against hepatic injury in rats with acute pancreatitis possibly by resisting oxidation and decreasing hepatic expression of ICAM-1 and VCAM-1.
- Citation: Zhao LM, Feng ZJ, Sun ZM, Song M. α-lipoic acid reduces liver injury in rats with acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2010; 18(25): 2631-2636
- URL: https://www.wjgnet.com/1009-3079/full/v18/i25/2631.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i25.2631
急性胰腺炎(acute pancreatitis, AP)是临床常见的急腹症, 常常引起胰外器官损伤, 肝脏是主要受损器官之一, 其损害的不断加重可导致胰腺炎病情恶化, 进而发生多器官功能衰竭综合征(multiple organ dysfunction syndrome, MODS), 死亡率较高. 目前研究显示, AP肝脏损伤的机制主要有细胞因子、氧化应激、微循环障碍、细胞凋亡和胰腺炎相关性腹水等方面. 氧自由基(oxygen-derived free radicals, OFR)作为一个重要炎症介质在AP病情发展中起重要作用, 而一些细胞因子, 如细胞间黏附分子-1(intercellular adhesion molecular-1, ICAM-1)、血管细胞间黏附分子-1(vascular cell adhesion molecular-I, VCAM-1)等能促进炎症部位白细胞的聚集和活化, 产生大量的OFR, 损伤内皮细胞完整性, 增加毛细血管通透性, 引起胰腺炎及胰外多脏器损伤、出血和坏死. α-硫辛酸(α-Lipoic acid, ALA)是近年来新发现的抗氧化剂, 他既能中和OFR, 减轻脂质过氧化损伤, 又能抑制细胞黏附分子等炎症因子的释放. 本文拟通过建立大鼠AP模型, 探讨ALA对AP并发肝损伤的抑制作用及机制.
清洁级健康♂Wistar大鼠54只, 体质量250 g±20 g, 由河北医科大学实验动物中心提供(合格证编号: 607046). 兔抗ICAM-1多克隆抗体、兔抗VCAM-1多克隆抗体、免疫组织化学SP试剂盒以及DAB显色剂均购自武汉博士德生物技术公司; SOD活力测试盒、MDA含量测试盒购自南京建成生物工程研究所. 牛磺胆酸钠与ALA均购自美国Sigma公司.
1.2.1 造模: 选取清洁健康Wistar♂大鼠, 准确称质量, 标记, 随机分组. 大鼠实验前24 h开始禁食, 自由饮水. 10%水合氯醛(3 mL/kg)腹腔内注射麻醉, 取仰卧位, 将动物四肢及头固定于操作台上, 备皮、消毒、铺无菌洞巾, 于上腹正中作2 cm切口进入腹腔, 显露胰胆管, 在近肝门处用无创血管夹夹闭胰胆管后, 用4号加工钝头头皮静脉针于十二指肠乳头附近逆行插入胰胆管, 以0.2 mL/min速度注入3.5%牛磺胆酸钠(0.1 mL/100 g), 推药后用无创血管夹夹住胰胆管入十二指肠处, 观察10 min, 去除血管夹, 关腹, 经胰腺病理学证实AP造模成功.
1.2.2 分组: (1)假手术组(sham-operation group, SO组): 开腹翻动十二指肠并触摸胰腺3次(n = 18). (2)AP组: 制造AP模型组(n = 18). (3)ALA组: 制造AP模型成功后, 于腹腔内注射ALA(1 mg/kg, n = 18), 各组又随机分为3、6、12 h时间点三个亚组, 每亚组为6只大鼠. 各组分别处死大鼠后, 迅速留取静脉血清和胰腺、肝脏组织待检.
1.2.3 指标检测: (1)血清淀粉酶、ALT、AST的检测均采用全自动血清生化分析仪测定. 肝组织超氧化物歧化酶(superoxide dismutase, SOD)活力和丙二醛(malonaldehyde, MDA)含量测定: 取肝脏组织制成组织匀浆, 用化学比色法测定. 所有组织标本均经40 g/L缓冲中性甲醛溶液固定, 常规石蜡包埋, 4 µm厚度连续切片, 行HE常规染色, 光镜下观察胰腺和肝脏组织病理变化. (2)采用免疫组织化学(SP法)检测肝组织ICAM-1和VCAM-1的表达: 石蜡切片经脱蜡, 梯度酒精水化后, 用3%双氧水常温孵育15 min, 0.01 mol/L(pH6.0)枸橼酸盐缓冲液(PBS)在电炉加热90 ℃-95 ℃中修复抗原, 加入正常山羊血清封闭液孵育30 min后, 再加入一抗ICAM-1抗体(PBS稀释成1:100), 4 ℃冰箱过夜, 再分别加二抗和辣根过氧化物酶标记的三抗链霉卵白素, 37 ℃孵育30 min, DAB显色, 苏木素封片, 阳性对照采用已知阳性片为标准, 阴性对照采用PBS代替一抗为标准. 每例标本选取10个不相重叠的具有代表性的视野, 并将图像输入彩色医学图文分析系统, 进行图像定半量分析, 测定平均灰度值(average gray value, AG), 以平均灰度值反映ICAM-1及VCAM-1的表达强度, 平均灰度与细胞内物质含量、免疫组织化学的染色强度成反比. 图像分析灰度级为0-255, 着色越浅, 灰度值越大, 说明免疫组织化学表达越低.
统计学处理 数据用mean±SD表示, 采用SPSS13.0统计软件对各组均数进行单因素方差分析(One-way ANOVA), 两组之间比较用q检验, 以P<0.05认为有统计学意义.
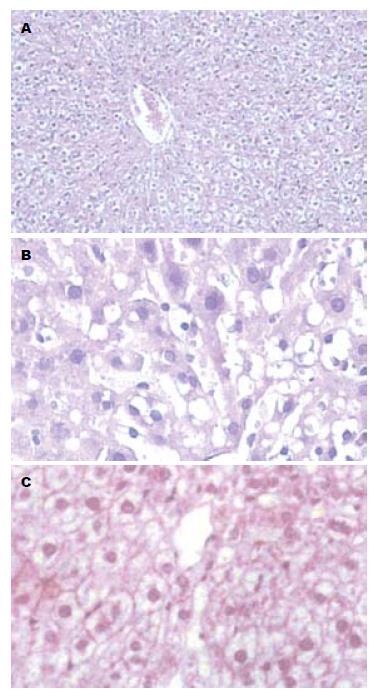
2.1.1 各组大鼠胰腺组织学改变: SO组胰腺组织结构清晰, 小叶结构完整. AP组3 h即可见胰腺小叶间隙增宽及少量炎细胞浸润, 此后, 随着时间的延长, 胰腺损伤逐渐加重. 6 h时胰腺腺泡片状出血、坏死, 正常胰腺小叶消失, 结构破坏, 可见散在空泡变性的腺泡细胞, 部分胞核溶解消失, 间质血管充盈, 坏死胰腺组织周围可见大量中性白细胞浸润. 12 h时胰腺损伤已经十分显著, 表现为胰腺组织水肿、出血及片状坏死, 大量炎细胞浸润、部分腺叶正常结构消失. 与AP组相比较, 在ALA组胰腺组织结构破坏明显减轻.
2.1.2 各组大鼠肝脏组织学改变: SO组肝组织结构均正常, 各个时间点无明显差别; AP组6 h肝组织可见炎性细胞浸润, 肝小叶紊乱, 失去正常结构, 随着时间的延长, 肝脏组织损伤逐渐加重, 出现点片状或局灶状坏死; 而ALA组仅出现轻度肝细胞水肿与少量炎细胞浸润, 肝脏无明显坏死 (图1).
2.2.1 血清淀粉酶检测: 在3、6和12 h各时间点, SO组无明显变化. 与SO组比较, 在AP组和ALA组均显著升高(P<0.01), 且随时间点的延长, 血清淀粉酶逐渐升高. 而ALA组较AP组比较血清淀粉酶则明显降低(P<0.05, 表1).
| 时间点 | 分组 | 淀粉酶(U/L) | ALT(U/L) | AST(U/L) | SOD(U/mg·prot) | MDA(U/mg·prot) |
| 3 h | SO组 | 134.67±37.46 | 35.40±5.71 | 38.25±4.63 | 50.49±7.08 | 2.12±0.41 |
| AP组 | 1 525.17±370.36b | 101.17±22.33b | 62.71±19.16b | 43.12±5.87a | 2.83±0.62a | |
| ALA组 | 1 141.50±617.01bc | 78.11±15.50bc | 47.16±12.25 | 45.36±5.67 | 2.37±0.48 | |
| 6 h | SO组 | 160.17±23.13 | 36.08±6.11 | 35.17±5.28 | 51.17±6.25 | 2.05±0.53 |
| AP组 | 2 211.00±537.36b | 118.21±25.32b | 87.35±20.09b | 42.36±5.40a | 2.90±0.58a | |
| ALA组 | 1 444.50±504.36bc | 86.72±13.10bc | 62.05±18.30bc | 49.38±8.01c | 2.28±0.55c | |
| 12 h | SO组 | 159.67±31.97 | 34.83±8.24 | 37.23±6.20 | 50.36±5.58 | 2.13±0.49 |
| AP组 | 2 994.50±354.38b | 148.65±16.40b | 99.86±15.27b | 41.08±6.34a | 2.97±0.59a | |
| ALA组 | 2 512.17±470.94bc | 96.10±18.20bc | 80.34±15.07bc | 48.61±7.39c | 2.40±0.51c |
2.2.2 血清ALT、AST检测: 在3、6和12 h各时间点, SO组无明显变化. 与SO组比较, 血清ALT检测在AP组和ALA组均随时间点的延长显著升高(P<0.01), 而血清AST则仅在6、12 h点有明显升高(P<0.05); 与AP组比较, ALA组血清ALT在各时间点均有显著降低(P<0.05), 而血清AST在3 h点则无显著性差异(P>0.05), 仅在6、12 h点有明显降低(P<0.05, 表1).
2.3.1 SOD活力测定: 在SO组大鼠各时间点无明显差异. 与SO组相比, AP组在3、6和12 h点SOD活力明显下降(P<0.05). 与AP相比, ALA组SOD活力在3 h点无显著性差异(P>0.05), 在6、12 h点明显升高(P<0.05).
2.3.2 MDA含量测定: 在SO组大鼠各时间点无明显差异. 与SO组相比, AP组MDA含量在6 h和12 h点均有显著上升(P<0.01). 而与AP相比, ALA组MDA含量在6、12 h点明显下降(P<0.05, 表1).
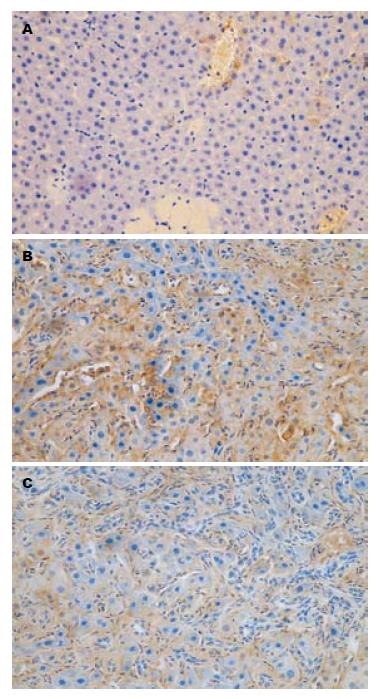
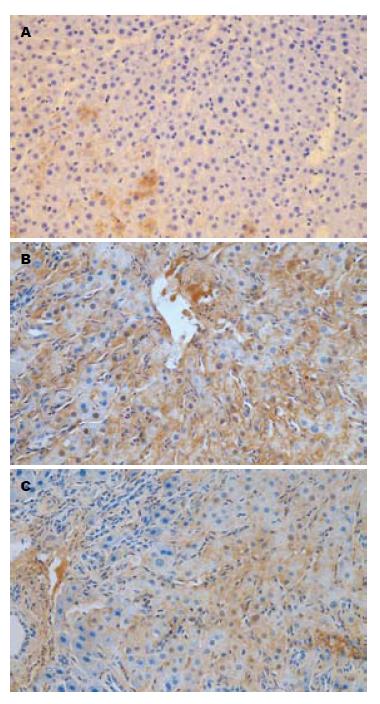
灰度值检测结果显示, 在SO组, 肝组织中几乎没有ICAM-1、VCAM-1表达. 在AP组, 两者表达均明显增加, 呈棕黄色颗粒, 阳性表达区多分布在微小血管内皮层、毛细血管内皮层, 与SO组比较, AP组3 h无明显差异, 于6、12 h时间点ICAM-1与VCAM-1表达均明显增加, 差异有高度显著性; 在ALA组, 于6和12 h时间点ICAM-1、VCAM-1在肝组织中表达明显减弱, 呈弱阳性, 与AP组比较, 有显著性差异(图2, 图3).
在AP, 特别是重症AP时常常并发肝脏损伤, 由于其特殊复杂的生理功能, 可能对胰腺外脏器有直接或间接的损害作用, 因此, 在AP时保护肝脏功能至关重要[1]. ALA是近年来发现的一种新的天然抗氧化剂, 属于维生素B类化合物, 在丙酮酸脱氢酶、α-酮戊二酸脱氢酶、氨基己酸脱羧酶等多酶复合体中作为辅酶作用, 有着较强的抗氧化活性, 能透过血脑屏障发挥"通用性抗氧化剂"的作用. ALA作为一种高效抗氧化剂被广泛用于多种与氧化应激有关疾病的辅助治疗[2]. 国外研究显示, ALA可以直接清除OFRs, 阻断脂质过氧化, 诱导谷胱甘肽(glutathione, GSH)合成, 恢复细胞氧化还原稳态, 减少细胞氧化损伤, 可使氧化还原敏感性转录因子NF-κB失活, 从而改善内皮细胞功能, 还可通过减少活性氧簇(reactive oxygen species, ROS), 抑制许多氧化还原敏感信号通路[3,4]. Park等[5]的动物实验研究表明, 对胆囊收缩素(cholecystokinin, CCK)诱导的AP大鼠模型给予ALA(1 mg/kg)腹腔注射后, 能够显著降低升高的血清脂肪酶和淀粉酶, 胰腺的组织损伤也得以明显改善, 因此认为ALA对CCK诱导的AP具有抑制作用. Balkis Budin等[6]对糖尿病大鼠, 在常规治疗的基础上加用ALA治疗, 观察血脂、氧化应激指标以及血管的变化发现, ALA不仅能降低血脂, 同时可以增加血浆SOD活性, 降低MDA水平, 对外周血管中淋巴细胞DNA氧化损伤有明显的保护作用. Selvakumar等[7]也观察到环磷酰胺会使大鼠肝脏产生过氧化, 谷胱甘肽过氧化酶(glutathione peroxidase, GPx)、儿茶酚胺(catecholamine, CA)及SOD活性下降, MDA增高, 同时血中氨基转移酶、乳酸脱氢酶和碱性磷酸酶水平升高, 使用ALA治疗后, 组织脂质过氧化和失衡的抗氧化体系均能恢复正常, 说明ALA在环磷酰胺诱导的肝氧化损伤中起抑制作用. Duenschede等[8]对ALA预处理的肝脏缺血/再灌注大鼠的实验研究发现, ALA可以通过调整细胞凋亡系统从而改善肝脏的局部缺血坏死, 研究结果显示ALA处理组的肝组织脂质过氧化反应(lipid peroxidation, LPO)减少, 肝细胞损伤降低, 大鼠的存活率高. Dulundu等[9]应用ALA治疗缺血/再灌注诱导的急性肝损伤的大鼠, 发现ALA能通过其抗氧化能力与氧化清除作用减轻肝损伤, 改善肝功能. 我们的研究结果显示, 通过血清淀粉酶与肝功能检测发现ALA治疗组各时间点数值均显著低于AP组, 提示ALA组胰腺及肝功能有明显改善; 病理学检测发现在AP组大鼠肝细胞有不同程度的肿胀和空泡状变性, 部分可见点状坏死和局灶性片状坏死, 而且随着时间的延长, 肝脏组织损伤逐渐加重, 并伴有大量的炎性细胞浸润, 而ALA组肝小叶结构基本正常, 很少有肝细胞坏死, 炎性反应明显减轻, 说明ALA对AP相关性肝损伤有抑制作用.
ICAM-1与VCAM-1均属于免疫球蛋白超家族黏附分子(immunoglobulin superfamily, IGSF)的成员, 参与调节炎症反应、细胞和组织的分化和发育、免疫应答以及肿瘤的扩散转移等[10]. ICAM-1是一种相对分子质量为80 000-90 000 Da的单链糖蛋白, 在生理条件下ICAM-1仅低量表达于内皮细胞和上皮细胞表面[11], ICAM-1能介导白细胞在血管壁滚动、稳定黏附和穿越内皮细胞、游出并在炎症区域募集[12], 当其表达升高时, 可与粒细胞表面的整合素相互作用, 是白细胞黏附于内皮细胞的关键所在, 由此促使白细胞通过血管内皮屏障迁移至炎性区域, 引起组织的过度炎症反应[13,14]. VCAM-1在正常生理条件下很少有表达, 在病理状态下VCAM-1表达在血管内皮上[15]. VCAM-1可与白细胞表面的配体VLA-4结合, 使白细胞黏附在内皮细胞表面, 引起白细胞活化, 释放多种颗粒物质, 破坏内皮细胞基底膜使膜脂质过氧化、细胞溶解, 导致血管内皮渗透性增加[16].
近年来研究发现, ICAM-1与VCAM-1在AP的发病过程中发挥重要作用. Kaufmann等[17]对29例的AP患者行血浆可溶性ICAM-1水平监测, 发现血浆可溶性ICAM-1的升高与疾病严重程度密切相关, 其研究显示, 如果ICAM-1升高超过6 d以上则胰腺坏死的发生率以及患者的死亡率将会大大增加. Bhatnagar等[18]的一项对多名AP患者外周血细胞以及胰腺组织中ICAM-1及其受体LFA-1(lymphocyte function- associated antigen-1)和HLA-DR表达失调的研究发现, 他们在AP的发生与发展过程中起到了推动性的作用, 因此建议可通过减少这些细胞因子的合成而达到治疗疾病的目的. 有人应用ICAM-1单克隆抗体治疗AP, 发现其可以改善微循环以及降低胰腺及全身器官的炎症损伤. Aitken等[19]研究发现抗氧化剂可以通过调控GPx、硫氧蛋白还原酶等的活力来抑制ICAM-1与VCAM-1在机体内的表达, 从而缓解了炎症反应, 减低了疾病的发生率与严重程度. Lee等[20]研究发现ALA对随着年龄的增长而导致的体内的转录蛋白氧化还原反应失调引起的ICAM-1表达的上调有潜在的保护作用. 本研究显示, 在AP组肝组织中SOD活力明显下降, MDA含量则显著升高; 而ALA组SOD活力增加, MDA含量降低, 另外, 在ALA组各时间点肝脏ICAM-1与VCAM-1的表达均较AP显著降低, 由此推测, ALA可能通过抗氧化作用和抑制肝组织中ICAM-1与VCAM-1的释放, 来减轻AP相关性肝损伤.
总之, ALA对大鼠AP合并肝损伤有较好抑制作用, 其机制可能与抗氧化作用以及抑制炎性因子ICAM-1与VCAM-1的表达有关.
急性胰腺炎(AP)是临床常见的急腹症, 常常引起胰外器官损伤, 肝脏是主要受损器官之一, 其损害的不断加重可导致胰腺炎病情恶化, 目前认为肝脏损伤的机制主要有细胞因子、胰酶、氧化应激、微循环障碍、细胞凋亡和胰腺炎相关性腹水等, 目前AP肝损伤的治疗研究也主要从上述各方面着手.
朴云峰, 教授, 吉林大学第一临床医院消化科
氧化应激在AP发病中的作用越来越受到人们的重视, 应用抗氧化剂治疗也成了研究的热点. α-硫辛酸(ALA)是近年来新发现的一种新的天然抗氧化剂, 有着超强的抗氧化性能, 他既能中和氧自由基, 减轻脂质过氧化损伤, 又能抑制细胞黏附分子等炎症因子的释放, 具有很高的医用价值以及抗衰老潜能.
Selvakumar等观察到环磷酰胺会使大鼠肝脏产生过氧化, 组织中的谷胱甘肽过氧化酶(GPx)、儿茶酚胺(CA)及超氧化物歧化酶(SOD)活性下降, 而丙二醛(MDA)增高, 同时血中氨基转移酶、乳酸脱氢酶和碱性磷酸酶水平也升高, 在使用ALA治疗后, 组织脂质过氧化和失衡的抗氧化体系均能恢复正常, 说明ALA具有很好的抗氧化能力, 对环磷酰胺诱导的肝氧化损伤能起到抑制作用.
本文成功制作了急性胰腺炎的动物模型并给予ALA腹腔注射治疗, 通过检测不同时间点的肝功能、氧化应激指标以及细胞因子的表达情况, 从而证实了ALA对急性胰腺炎肝损伤的抑制作用, 为抗氧化剂的临床应用提供了新的角度和思考.
急性胰腺炎(AP)病情凶险, 进展迅速, 常在早期并发SIRS和MODS而导致死亡. 但过早的手术干预, 会由于手术的创伤和应激反应而加重局部和全身的炎症反应, 目前多数学者均趋向早期避免手术而采用以药物为主的内科综合治疗. 本研究表明ALA具有抗氧化作用并能抑制炎性因子的表达, 因此对大鼠AP合并肝损伤有较好抑制作用, 这为临床上药物治疗AP这一急腹症提供了实验基础.
本研究设计合理, 数据结果可靠, 具有一定的科学性.
编辑: 李军亮 电编:何基才
| 1. | Zhang XP, Zhang J, Ren Z, Feng GH, Zhu W, Cai Y, Yang QJ, Ju TF, Xie Q, Yuan WQ. Study on protecting effects of baicalin and octreotide on hepatic injury in rats with severe acute pancreatitis. World J Gastroenterol. 2008;14:6551-6559. [PubMed] [DOI] |
| 3. | Pereda J, Sabater L, Aparisi L, Escobar J, Sandoval J, Viña J, López-Rodas G, Sastre J. Interaction between cytokines and oxidative stress in acute pancreatitis. Curr Med Chem. 2006;13:2775-2787. [PubMed] [DOI] |
| 4. | Shi DY, Liu HL, Stern JS, Yu PZ, Liu SL. Alpha-lipoic acid induces apoptosis in hepatoma cells via the PTEN/Akt pathway. FEBS Lett. 2008;582:1667-1671. [PubMed] [DOI] |
| 5. | Park SJ, Seo SW, Choi OS, Park CS. Alpha-lipoic acid protects against cholecystokinin-induced acute pancreatitis in rats. World J Gastroenterol. 2005;11:4883-4885. [PubMed] |
| 6. | Balkis Budin S, Othman F, Louis SR, Abu Bakar M, Radzi M, Osman K, Das S, Mohamed J. Effect of alpha lipoic acid on oxidative stress and vascular wall of diabetic rats. Rom J Morphol Embryol. 2009;50:23-30. [PubMed] |
| 7. | Selvakumar E, Prahalathan C, Mythili Y, Varalakshmi P. Mitigation of oxidative stress in cyclophosphamide-challenged hepatic tissue by DL-alpha-lipoic acid. Mol Cell Biochem. 2005;272:179-185. [PubMed] [DOI] |
| 8. | Duenschede F, Erbes K, Riegler N, Ewald P, Kircher A, Westermann S, Schad A, Miesmer I, Albrecht-Schöck S, Gockel I. Protective effects of ischemic preconditioning and application of lipoic acid prior to 90 min of hepatic ischemia in a rat model. World J Gastroenterol. 2007;13:3692-3698. [PubMed] |
| 9. | Dulundu E, Ozel Y, Topaloglu U, Sehirli O, Ercan F, Gedik N, Sener G. Alpha-lipoic acid protects against hepatic ischemia-reperfusion injury in rats. Pharmacology. 2007;79:163-170. [PubMed] [DOI] |
| 10. | 唐 可京, 谢 灿茂, 李 幼姬. 细胞间粘附分子-1和血管细胞间粘附分子-1的结构与功能. 细胞与分子免疫学杂志. 2002;18:193-195. |
| 11. | 万 涛, 朱 冠保. NF-κB、ICAM-1和炎症细胞因子在急性胰腺炎肝损伤中的作用. 国外医学·临床生物化学与检验学 分册. 2005;26:913-915. |
| 14. | Wittchen ES. Endothelial signaling in paracellular and transcellular leukocyte transmigration. Front Biosci. 2009;14:2522-2545. [PubMed] [DOI] |
| 15. | Lee YW, Kühn H, Hennig B, Neish AS, Toborek M. IL-4-induced oxidative stress upregulates VCAM-1 gene expression in human endothelial cells. J Mol Cell Cardiol. 2001;33:83-94. [PubMed] [DOI] |
| 16. | Lomakina EB, Waugh RE. Adhesion between human neutrophils and immobilized endothelial ligand vascular cell adhesion molecule 1: divalent ion effects. Biophys J. 2009;96:276-284. [PubMed] [DOI] |
| 17. | Kaufmann P, Smolle KH, Brunner GA, Demel U, Tilz GP, Krejs GJ. Relation of serial measurements of plasma-soluble intercellular adhesion molecule-1 to severity of acute pancreatitis. Am J Gastroenterol. 1999;94:2412-2416. [PubMed] [DOI] |
| 18. | Bhatnagar A, Wig JD, Majumdar S. Expression of activation, adhesion molecules and intracellular cytokines in acute pancreatitis. Immunol Lett. 2001;77:133-141. [PubMed] [DOI] |
| 19. | Aitken SL, Karcher EL, Rezamand P, Gandy JC, VandeHaar MJ, Capuco AV, Sordillo LM. Evaluation of antioxidant and proinflammatory gene expression in bovine mammary tissue during the periparturient period. J Dairy Sci. 2009;92:589-598. [PubMed] [DOI] |
| 20. | Lee HA, Hughes DA. Alpha-lipoic acid modulates NF-kappaB activity in human monocytic cells by direct interaction with DNA. Exp Gerontol. 2002;37:401-410. [PubMed] [DOI] |