修回日期: 2010-08-13
接受日期: 2010-08-17
在线出版日期: 2010-09-08
目的: 探讨下调桩蛋白(paxillin)对人食管癌EC9706细胞中FAK及MMP-2表达的影响, 并探讨其相关的分子机制.
方法: 将食管鳞癌EC9706细胞分为3组, 即未处理组, 对照siRNA组及paxillin siRNA组. 利用paxillin siRNA和对照siRNA分别转染EC9706细胞, 通过免疫细胞化学和Western blot方法检测paxillin、FAK及MMP-2在3组细胞中的表达.
结果: 转染paxillin siRNA后, 食管鳞癌EC9706细胞中paxillin蛋白表达显著下降, 与未处理组及对照siRNA组相比, 显著性具有差异(F = 294.843, P = 0.000). 同时, paxillin siRNA组EC9706细胞中FAK及MMP-2表达也明显下降, 3组间比较差异具有统计学意义(F = 204.925, P = 0.000; F = 131.236, P = 0.000).
结论: Paxillin表达的下调能直接降低食管鳞癌中FAK及MMP-2的表达.
引文著录: 王峰, 王鹏举, 刘红涛, 王艳鸽, 李晟磊, 陈奎生, 高冬玲. 桩蛋白表达下调对食管鳞癌EC9706细胞FAK及MMP-2表达的影响. 世界华人消化杂志 2010; 18(25): 2626-2630
Revised: August 13, 2010
Accepted: August 17, 2010
Published online: September 8, 2010
AIM: To investigate the effect of paxillin knockdown on the expression of focal adhesion kinase (FAK) and matrix metalloproteinase-2 (MMP-2) proteins in esophageal squamous cell carcinoma (ESCC) EC9706 cells and to explore the potential molecular mechanisms involved.
METHODS: EC9706 cells were divided into three groups: untreated group, control siRNA group, and paxillin siRNA group. Paxillin siRNA and control siRNA were transfected into EC9706 cells, respectively. The expression of paxillin, FAK and MMP-2 in EC9706 cells was detected by immunocytochemistry and Western blot.
RESULTS: The expression of paxillin protein in the paxillin siRNA group was obviously decreased compared to the untreated group and control siRNA group (F = 294.843, P = 0.000). The expression levels of FAK and MMP-2 proteins in the paxillin siRNA group were significantly lower than those in the untreated group and control siRNA group (F = 204.925, P = 0.000; F = 131.236, P = 0.000).
CONCLUSION: Down-regulation of paxillin expression decreases the expression of FAK and MMP-2 in EC9706 cells.
- Citation: Wang F, Wang PJ, Liu HT, Wang YG, Li SL, Chen KS, Gao DL. Paxillin knockdown down-regulates the expression of FAK and MMP-2 proteins in esophageal squamous cell carcinoma EC9706 cells. Shijie Huaren Xiaohua Zazhi 2010; 18(25): 2626-2630
- URL: https://www.wjgnet.com/1009-3079/full/v18/i25/2626.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i25.2626
paxillin是1994年从鸟cDNA文库[1]筛选克隆到的, 序列分析表明他编码559个氨基酸. paxillin N-端含有5个LD基序和一些SH2结合域, 而C-端含有4个LIM域[2], 这些不同的结构域可能预示着其重要的生物学功能. 近年来发现paxillin是一种重要的细胞黏附因子, 是致瘤性酪氨酸激酶的一种底物, 与整合素相关联, 构成细胞与细胞外基质局部黏附的关键部位, 调节细胞的移动和播散等功能, 从而提高肿瘤细胞转移和侵袭的能力[3,4]. 此外, 作为一种信号接头蛋白(signal adaptor protein), paxillin在多种细胞外刺激引起的信号传导中发挥作用[5]. 研究表明: paxillin有参与动态调节黏着斑、调节细胞的移动和播散等功能, 与肿瘤的浸润和转移与细胞的黏附力、移动力的改变直接相关, 提示paxillin在肿瘤细胞的浸润和转移中起着十分重要的作用[1,6]. 本研究利用paxillin siRNA转染食管鳞癌EC9706细胞, 通过免疫细胞化学及Western blot方法研究paxillin基因表达的下调对食管鳞癌EC9706细胞中FAK和MMP-2表达的影响, 初步阐明paxillin在食管鳞癌发生发展中的可能作用, 为食管鳞癌的转移机制提供新的理论依据和实验基础.
食管鳞癌细胞系EC9706由中国医学科学院肿瘤医院肿瘤研究所分子肿瘤学国家重点实验室惠赠. paxillin siRNA(h)、control siRNA(h)、抗体paxillin、FAK、MMP-2及β-actin均购自美国Santa Cruz公司.
1.2.1 细胞培养及转染: EC9706细胞生长于含100 mL/L胎牛血清、100 kU/L青霉素、100 kU/L链霉素的DMEM培养基中, 置于37 ℃、50 mL/L CO2的相对饱和的培养箱中传代培养, 实验细胞均处于对数生长期. 当EC9706细胞生长至80%-90%融合时, 按LipofectamineTM 2000转染试剂说明书将对照siRNA和paxillin siRNA分别转染, 然后分别用于免疫细胞化学及Western blot实验. 实验过程中将细胞分为3组: 未处理组、对照siRNA组和paxillin siRNA组.
1.2.2 免疫细胞化学染色及结果判定: 将上述3组细胞转染48 h后, 收集细胞, 分别爬片, 然后利用免疫细胞化学检测paxillin、FAK及MMP-2蛋白的表达. 以PBS代替一抗作阴性对照, 结果阴性. 按文献[7]的半定量法, 以阳性细胞百分比结合染色强度计算染色积分. 细胞胞质或胞核染成棕黄色或棕褐色为阳性, 随机观察10个高倍视野, 每个视野记数200个细胞, 计阳性细胞数.
1.2.3 Western blot检测及结果判定: 收集48 h未处理和转染的EC9706细胞在裂解缓冲液中进行裂解. 收集细胞提取物于12 000 r/min, 5 min离心, 蛋白浓度用Bradford法进行测定. 80 µg总蛋白在上样缓冲液中煮5 min, 于10% SDS-PAGE电泳, 然后通过电转移至硝酸纤维素膜上. 硝酸纤维素膜用含5%脱脂奶粉的TBST于室温封闭2 h, 然后分别加一抗(和β-actin)于含5%脱脂奶粉的TBST中, 4 ℃过夜, 第2天, 用TBST洗5 min×3次, 然后分别加合适的二抗作用1 h, 洗5 min×3次, 然后曝光. 最后用Gene Tools进行蛋白相对表达量分析.
统计学处理 应用SPSS13.0统计软件进行统计学处理, 行方差分析. 以α = 0.05为检验水准.
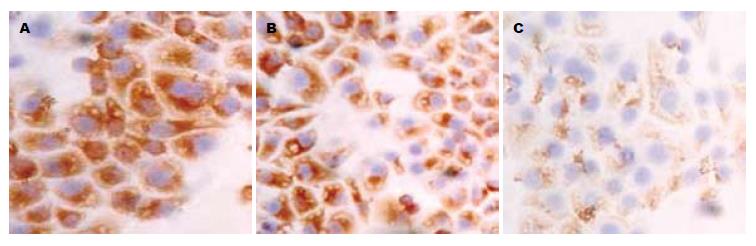
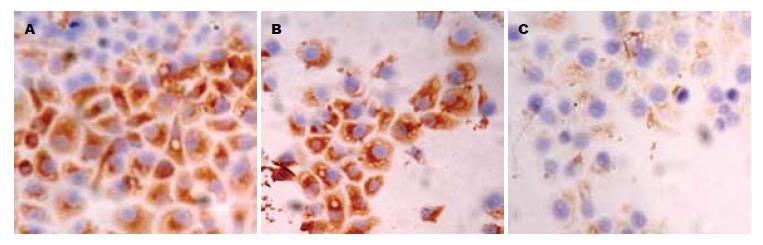
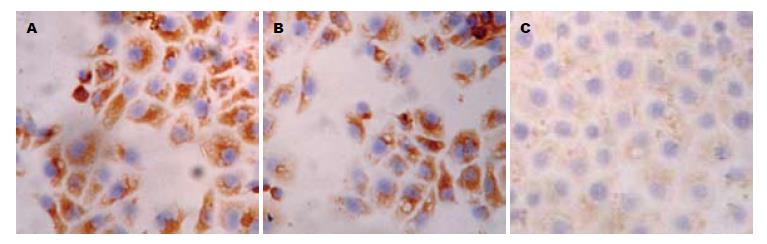
3组细胞中paxillin siRNA组中paxillin蛋白表达阳性率最低, 而未处理组和转染siRNA对照组中其表达阳性细胞数较高(图1, 表1). 其蛋白表达阳性信号主要定位于细胞质中, 呈浅黄色到棕黄色颗粒. paxillin表达在3组之间的统计分析表明组间有统计学意义(F = 294.843, P = 0.000, 图1, 表1). FAK蛋白的免疫细胞化学结果表明, 3组细胞中paxillin siRNA组中FAK蛋白表达阳性细胞数最低, 而未处理组和转染siRNA对照组中其表达阳性细胞数较高(图2, 表1). 其蛋白表达阳性信号主要定位于细胞质中, 呈浅黄色到棕黄色颗粒. FAK蛋白的表达在组间有统计学意义(F = 204.925, P = 0.000, 图2, 表1). MMP-2蛋白免疫细胞化学结果表明, 三组细胞中paxillin siRNA组中MMP-2蛋白表达阳性细胞数最低, 而未处理组和转染siRNA对照组中其表达阳性细胞数较高(图3, 表1). 其蛋白表达阳性信号主要定位于细胞质中, 呈浅黄色到棕黄色颗粒. MMP-2蛋白的表达在组间有统计学意义(F = 131.236, P = 0.000, 图3, 表1).
| 分组 | n | paxillin阳性细胞数 | FAK阳性细胞数 | MMP-2阳性细胞数 |
| 未处理组 | 200×10 | 108.30±10.07 | 83.80±5.35 | 108.20±9.22 |
| 对照siRNA组 | 200×10 | 105.10±7.71 | 82.10±5.45 | 107.40±7.35 |
| paxillin siRNA组 | 200×10 | 30.40±6.08 | 43.80±4.08 | 50.20±10.66 |
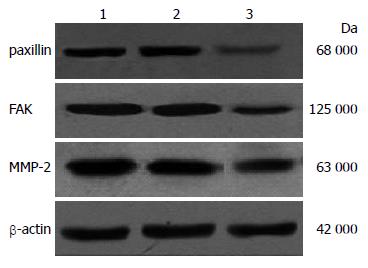
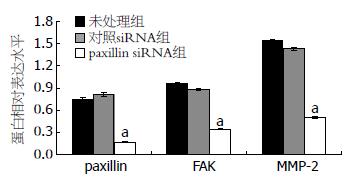
转染48 h以后, 分别收取细胞, 利用蛋白裂解液提取总蛋白, 经过SDS-PAGE、转膜、一抗反应、二抗反应, 最后曝光显影, 最后利用Gene Tools软件进行蛋白相对表达分析. 结果表明, 转染paxillin siRNA后, 与未处理组及对照siRNA组相比, paxillin siRNA组中的paxillin蛋白的表达量明显下调(图4, 5), 其表达量大约为前二者表达量的1/6. 此外, FAK蛋白相对表达分析结果显示出与paxillin蛋白相类似的结果(图4, 5). 最后MMP-2蛋白的相对表达分析结果表明, 转染paxillin siRNA组中其MMP-2蛋白表达明显下降(图4, 5).
食管鳞癌是一种侵袭性很强的恶性肿瘤, 多伴有转移, 且易复发, 其预后很差. 目前研究证明食管癌的发生发展是一个多阶段和多基因不断演变的过程, 但对其发病机制仍不十分清楚[8], 长期以来如何从分子水平来寻找食管癌可能的分子治疗靶点长期以来备受人们关注. paxillin和FAK是与细胞黏附相关的蛋白, 是整合素介导的信号调控途径中的两个关键性的信号分子. 近来研究表明, paxillin和FAK在肿瘤细胞迁移、细胞增殖和生存中起着十分重要的作用[9-13]. Yano等[14]于2004年发表的一篇文章中报道, paxillin和FAK在调控细胞迁移中起关键性的作用, 提示paxillin与FAK在肿瘤的发生发展中可能具有极其重要的内在联系. 此外, MMP-2又称明胶酶A, 是MMPs中的重要成员, 其主要分解底物为Ⅳ型胶原, 其次还有Ⅴ、Ⅶ、Ⅸ、Ⅹ型胶原及纤维连接素和弹性蛋白, 对于肿瘤细胞转移突破物理屏障及血管生成有重要意义[15]. 作为FAK信号的下游分子, 基质金属蛋白类MMPs因其几乎能降解细胞外基质的所有成分而备受关注[16-18]. 因此联合检测paxillin、FAK及MMP-2的表达可能为食管鳞癌中信号通路的认识提供理论依据.
我们前期研究结果显示, 食管鳞癌组织中paxillin的表达显著高于癌旁和正常食管组织中paxillin的表达[19], 提示食管鳞癌组织中paxillin的高表达可能使肿瘤细胞与其周围的非肿瘤细胞之间的局部黏附作用加强, 使得肿瘤细胞更容易发生迁移进而形成转移, 但其具体的分子作用机制尚不清楚, 因此在本研究中我们利用RNA干扰技术研究下调食管鳞癌EC9706细胞中paxillin的表达对FAK和MMP-2表达的影响, 免疫细胞化学和Western blot结果均显示, 转染paxillin siRNA后, 食管鳞癌EC9706细胞中paxillin蛋白表达水平显著下调, 提示paxillin siRNA能有效地下调paxillin蛋白的表达, 为后续研究食管鳞癌EC9706细胞中paxillin的功能奠定基础. 此外, 为了阐明paxillin在食管鳞癌EC9706细胞中浸润转移中可能的分子作用机制, 我们选择与浸润转移关系十分密切的FAK和MMP-2作为研究对象, 观察转染paxillin siRNA后FAK和MMP-2蛋白表达的变化, 结果表明, paxillin蛋白表达的下调能引起FAK和MMP-2蛋白表达的显著下降, 提示三者之间可能存在着十分密切的联系, 其相互作用是食管癌侵袭与转移作用的一个共同的信号通路, 然而其相互作用的机制尚需进一步探讨.
总之, 我们的结果表明, paxillin siRNA能有效下调食管鳞癌EC9706细胞中paxillin蛋白的表达, 并伴随着FAK和MMP-2蛋白表达的下调, 提示paxillin可能在食管鳞癌浸润转移中发挥重要作用, 进一步对paxillin的研究有望成为治疗食管鳞癌的新的分子靶点.
paxillin是1994年从鸟cDNA文库筛选克隆到的, 序列分析表明他编码559个氨基酸. paxillin N-端含有5个LD基序和一些SH2结合域, 而C-端含有4个LIM域, 这些不同的结构域可能预示着其重要的生物学功能.
陈秋生, 教授, 南京农业大学动物医学院基础医学系
目前, 采用干扰技术下调paxillin基因并检测人食管癌EC9706细胞中FAK及MMP-2表达相关性的研究, 迄今国内外均未见报道. 关于paxillin与恶性肿瘤关系的研究已成为热点.
近年来研究表明, 在多种肿瘤组织中都有FAK表达的显著增加, 且FAK的表达与肿瘤的发生及生物学行为有一定的相关性. FAK可激活多条信号传导通路, 参与细胞分化、增生、伸展和迁移以及肿瘤的侵袭和转移等过程.
本文首次采用siRNA技术干扰paxillin基因的表达并检测了干扰前后人食管鳞癌EC9706细胞中paxillin、FAK及MMP-2的表达.
桩蛋白(paxillin): 是近年来发现的一种重要的细胞黏附因子, 是致瘤性酪氨酸激酶的一种底物, 与整合素相关联, 构成细胞与细胞外基质局部黏附的关键部位, 调节细胞的移动和播散, 可提高肿瘤细胞转移和侵袭的能力.
本研究选题比较合理, 方法正确, 图片较为清晰, 结果客观, 分析得当, 具有一定理论价值.
编辑: 李军亮 电编:何基才
| 1. | Aponte M, Jiang W, Lakkis M, Li MJ, Edwards D, Albitar L, Vitonis A, Mok SC, Cramer DW, Ye B. Activation of platelet- activating factor receptor and pleiotropic effects on tyrosine phospho-EGFR/Src/FAK/paxillin in ovarian cancer. Cancer Res. 2008;68:5839-5848. [PubMed] [DOI] |
| 2. | Dawid IB, Breen JJ, Toyama R. LIM domains: multiple roles as adapters and functional modifiers in protein interactions. Trends Genet. 1998;14:156-162. [PubMed] [DOI] |
| 3. | Iwasaki T, Nakata A, Mukai M, Shinkai K, Yano H, Sabe H, Schaefer E, Tatsuta M, Tsujimura T, Terada N. Involvement of phosphorylation of Tyr-31 and Tyr-118 of paxillin in MM1 cancer cell migration. Int J Cancer. 2002;97:330-335. [PubMed] [DOI] |
| 4. | Chen HY, Shen CH, Tsai YT, Lin FC, Huang YP, Chen RH. Brk activates rac1 and promotes cell migration and invasion by phosphorylating paxillin. Mol Cell Biol. 2004;24:10558-10572. [PubMed] [DOI] |
| 5. | Das A, Yaqoob U, Mehta D, Shah VH. FXR promotes endothelial cell motility through coordinated regulation of FAK and MMP-9. Arterioscler Thromb Vasc Biol. 2009;29:562-570. [PubMed] [DOI] |
| 6. | van Zyp JV, Conway WC, Craig DH, van Zyp NV, Thamilselvan V, Basson MD. Extracellular pressure stimulates tumor cell adhesion in vitro by paxillin activation. Cancer Biol Ther. 2006;5:1169-1178. [PubMed] |
| 7. | 娄 欣, 张 红, 曹 学全, 孙 淼淼, 高 冬玲, 张 岚, 宋 一民, 李 冰, 陈 奎生. 组织蛋白酶B特异性siRNA对食管癌EC9706细胞 组织蛋白酶B基因表达的影响. 郑州大学学报(医学版). 2007;42:14-17. |
| 8. | Goan YG, Chang HC, Hsu HK, Chou YP. An audit of surgical outcomes of esophageal squamous cell carcinoma. Eur J Cardiothorac Surg. 2007;31:536-544. [PubMed] [DOI] |
| 9. | Tang J, Wu YM, Zhao P, Yang XM, Jiang JL, Chen ZN. Overexpression of HAb18G/CD147 promotes invasion and metastasis via alpha3beta1 integrin mediated FAK-paxillin and FAK-PI3K-Ca2+ pathways. Cell Mol Life Sci. 2008;65:2933-2942. [PubMed] [DOI] |
| 10. | Fraley SI, Feng Y, Krishnamurthy R, Kim DH, Celedon A, Longmore GD, Wirtz D. A distinctive role for focal adhesion proteins in three-dimensional cell motility. Nat Cell Biol. 2010;12:598-604. [PubMed] [DOI] |
| 11. | Zheng Y, Lu Z. Paradoxical roles of FAK in tumor cell migration and metastasis. Cell Cycle. 2009;8:3474-3479. [PubMed] |
| 12. | Chu PY, Huang LY, Hsu CH, Liang CC, Guan JL, Hung TH, Shen TL. Tyrosine phosphorylation of growth factor receptor- bound protein-7 by focal adhesion kinase in the regulation of cell migration, proliferation, and tumorigenesis. J Biol Chem. 2009;284:20215-20226. [PubMed] [DOI] |
| 13. | Kaneda T, Sonoda Y, Ando K, Suzuki T, Sasaki Y, Oshio T, Tago M, Kasahara T. Mutation of Y925F in focal adhesion kinase (FAK) suppresses melanoma cell proliferation and metastasis. Cancer Lett. 2008;270:354-361. [PubMed] [DOI] |
| 14. | Yano H, Mazaki Y, Kurokawa K, Hanks SK, Matsuda M, Sabe H. Roles played by a subset of integrin signaling molecules in cadherin-based cell-cell adhesion. J Cell Biol. 2004;166:283-295. [PubMed] [DOI] |
| 15. | Chambers AF, Matrisian LM. Changing views of the role of matrix metalloproteinases in metastasis. J Natl Cancer Inst. 1997;89:1260-1270. [PubMed] [DOI] |
| 16. | O-Charoenrat P, Rhys-Evans PH, Eccles SA. Expression of matrix metalloproteinases and their inhibitors correlates with invasion and metastasis in squamous cell carcinoma of the head and neck. Arch Otolaryngol Head Neck Surg. 2001;127:813-820. [PubMed] |
| 17. | Owens LV, Xu L, Craven RJ, Dent GA, Weiner TM, Kornberg L, Liu ET, Cance WG. Overexpression of the focal adhesion kinase (p125FAK) in invasive human tumors. Cancer Res. 1995;55:2752-2755. [PubMed] |
| 18. | Xie B, Zhao J, Kitagawa M, Durbin J, Madri JA, Guan JL, Fu XY. Focal adhesion kinase activates Stat1 in integrin-mediated cell migration and adhesion. J Biol Chem. 2001;276:19512-19523. [PubMed] [DOI] |