修回日期: 2010-05-02
接受日期: 2010-06-02
在线出版日期: 2010-08-28
目的: 构建幽门螺杆菌(Helicobacter pylori, H. pylori)hp0596基因缺失突变体, 为进行hp0596基因功能研究奠定基础.
方法: 利用PCR技术, 从H. pylori 26695基因组分别扩增得到hp0596基因的上游同源臂和下游同源臂, 与两端带有FRT位点的氯霉素抗性基因片段共同构建同源重组载体; 以重组载体为模板扩增打靶片段, 将其转化入H. pylori 26695; 在抗生素选择压力下, 打靶片段和菌体基因组发生同源重组, 通过氯霉素抗性筛选得到带有抗性标记的重组菌.
结果: 构建的突变载体经限制性内切酶酶切分析显示, 产生的条带与预计结果完全一致. PCR方法扩增突变株0596, cmr基因显示, 0596基因已经被完全敲除, 经DNA测序, RNA水平, 蛋白质水平证实筛选得到了0596基因缺失的H. pylori 26695△0596突变株. 连续培养7代后, H. pylori 26695△0596突变株具有良好的稳定性.
结论: 获得了H. pylori 26695△0596基因缺失突变体.
引文著录: 韩秀萍, 展德文, 王芃, 李丛胜, 袁盛凌, 陶好霞, 张丽, 邱炎, 李家奎, 刘纯杰. 幽门螺杆菌hp0596基因缺失突变体的构建. 世界华人消化杂志 2010; 18(24): 2579-2583
Revised: May 2, 2010
Accepted: June 2, 2010
Published online: August 28, 2010
AIM: To construct an hp0596 gene deletion mutant of Helicobacter pylori (H. pylori) to provide a basis for further study of the functions of the hp0596 gene.
METHODS: Two homologous arms upstream and downstream of the hp0596 gene were amplified from H. pylori 26695 genomic DNA and cloned into a pBluescript SK II(-) vector carrying a chloramphenicol resistance cassette flanked by two FRT sites to construct a recombinant vector. The target fragment was then amplified from the recombinant vector and transformed into H. pylori 26695. Under antibiotic selective pressure, homologous recombination occurred between the target fragment and the genome of host strain. The recombinants were selected on chloramphenicol agar plates and identified by PCR.
RESULTS: Restriction endonuclease analyses showed that the recombinant vector (pBs-0596) was successfully constructed. An hp0596 gene deletion mutant of H. pylori 26695 was successfully obtained after identification by PCR, direct sequencing, resistance analysis, and detection of hp0596 expression at RNA and protein levels. After culturing for 7 generations, it was confirmed that the hp0596 gene deletion mutant of H. pylori 26695 was stable.
CONCLUSION: An hp0596 gene deletion mutant of H. pylori 26695 has been obtained successfully.
- Citation: Han XP, Zhan DW, Wang P, Li CS, Yuan SL, Tao HX, Zhang L, Qiu Y, Li JK, Liu CJ. Construction of an hp0596 gene deletion mutant of Helicobacter pylori. Shijie Huaren Xiaohua Zazhi 2010; 18(24): 2579-2583
- URL: https://www.wjgnet.com/1009-3079/full/v18/i24/2579.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i24.2579
幽门螺杆菌(Helicobacter pylori, H. pylori)是一种革兰氏阴性微需氧菌, 定居在胃黏膜上皮细胞间沟内及胃小凹内黏液深层中. 该菌感染呈全球性分布, 人类感染率在50%以上, 尤其在发展中国家, 感染率高达80%[1], 婴幼儿和儿童感染也很普遍. 研究表明, H. pylori感染是慢性胃炎、消化性溃疡的主要病因, 并且也是诱发胃癌和胃黏膜相关淋巴组织淋巴瘤的因素之一. 机体感染H. pylori后常常导致促炎症因子的释放, 进而诱发机体发生炎症. 促炎症因子包括肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α), 白介素-1(interleukin-1, IL-1)和白介素-8(interleukin-8, IL-8)等[2]. 近期研究发现H. pylori HP0596蛋白被鉴定为一种新的毒力致病因子[3], 他能激活NF-κB, 诱导机体产生TNF-α, 增强基质细胞因子的表达, 上调bcl-2基因表达和下调p53基因表达, 而这两类因子在人类胃癌形成过程中扮演着重要的角色. 基因敲除技术是功能基因组学研究的有力工具, 即通过目的基因的缺失, 结合相应的手段分析突变体与野生株之间的差异, 以研究基因功能. 为进一步探讨H. pylori的致癌机制, 我们利用同源重组技术敲除了H. pylori 26695株的hp0596基因, 构建了幽门螺杆菌H. pylori 26695△0596缺失突变体, 为系统研究hp0596基因功能创造了条件, 也为进一步阐明H. pylori致病机制奠定基础.
H. pylori国际标准菌株H. pylori 26695、克隆载体pBluescript SKⅡ(-)、质粒pKD3、E.coli DH5α为本实验室保存. DNA聚合酶、限制性内切酶、dNTPs和DNA连接酶购自NEB公司、小量质粒提取试剂盒和DNA回收试剂盒购自Promega公司. 细菌基因组提取试剂盒、DNA Marker购自天根生化试剂公司, 低分子量蛋白Marker为GE公司产品. hp△0596多抗由本实验室制备.
1.2.1 打靶载体的构建: 根据国际标准株H. pylori 26695基因组序列, 设计两对引物p1/p2和p7/p8, 并引入相应的酶切位点, 用于扩增目的基因hp0596的上游同源臂(452 bp)、下游同源臂(380 bp); 引物p3/p4扩增质粒pKD3上氯霉素抗性片段(1 033 bp); 引物p5/p6和p5/p8用于鉴定目的基因两端是否丢失(引物序列见表1). 以H. pylori 26695基因组为模板, 用引物p1/p2和高保真Pfu DNA聚合酶扩增hp0596基因上游臂452 bp的片段, 即hp0596基因上游同源臂; 按照同样的方法扩增出氯霉素片段和下游同源臂; PCR产物纯化后, 将上游臂用KpnⅠ/XhoⅠ双酶切, 氯霉素片段用XhoⅠ/SalⅠ双酶切, 下游臂用SalⅠ/BamHⅠ双酶切, 他们分别与T载体连接, 转化感受态E.coli DH5α, 具体方法参照文献[4]. 通过蓝白斑筛选单克隆, 同时采用菌落PCR和质粒双酶切鉴定, 初步鉴定正确的菌株送英骏公司测序. 将测序正确后的产物上游同源臂双酶切, 连接到经相同酶切的pBluescript SKⅡ(-)载体上, 用化学方法转化到E.coli DH5α, 经菌落PCR和质粒双酶切进行鉴定后, 再将氯霉素抗性片段和下游同源臂分别双酶切, 切胶回收后连到pBluescript SKⅡ(-)载体上转化E.coli DH5α, 构建出打靶载体pBS0596, 并进行PCR和酶切鉴定[5].
| 引物 | 序列(5'-3') |
| P1 | GGGGTACCGCATTAGAAGATGGTCGC |
| P2 | CCGCTCGAGGATTTTTCTAACACGC |
| P3 | CCGCTCGAGGTGTAGGCTGGAGCTGCTTC |
| P4 | ACGCGTCGACATGGGAATTAGCCATGGTCC |
| P5 | GATGGTAAGAAAACTGAAGAG |
| P6 | AAAGTCCCTATAGCCATG |
| P7 | ACGCGTCGACCGTTCCTCGCTATCGTCTGTTC |
| P8 | CGGGATCCCTTTCAGTGCTGATGGATG |
1.2.2 电转感受态的制备及电击转化: 参照Yuan等[6]的方法, H. pylori 26695在空肠弯曲菌血琼脂生长培养基上生长, 37 ℃微需氧环境(50 mL/L O2、100 mL/L CO2、850 mL/L N2)下培养48 h, 用改良布氏肉汤收集菌体1 mL, 离心10 min弃上清, 用10%甘油重复洗涤离心3次(4 ℃, 6 000 r/min, 10 min), 然后将沉淀重悬于100 μL 10%甘油, 4 ℃静置10 min, 然后取5 μL打靶载体质粒pBS0596与48 mL感受态混合, 将混合物加入0.1 cm电击杯中, 迅速将500 mL预冷的布氏肉汤涂于无抗空肠弯曲菌血琼脂生长培养基上, 24 h后转涂于氯霉素(20 mg/L)空肠弯曲菌血琼脂生长培养基上, 37 ℃微需氧环境(50 mL/L O2、100 mL/L CO2、850 mL/L N2)下培养5 d后观察转化子.
1.2.3 全菌PCR鉴定含重组质粒的转化子: 随机挑取单克隆用布氏肉汤扩增, 用1 mL的布氏肉汤收菌, 提取基因组, 用引物p1/p8进行PCR扩增鉴定, PCR反应条件为: 95 ℃预变性 5 min; 然后94 ℃变性30 s, 65 ℃退火30 s, 72 ℃延伸45 s, 扩增35个循环; 最后72 ℃延伸 10 min[7].
1.2.4 H. pylori 26695△0596基因缺失突变株的RNA水平分析: 取敲除株H. pylori 26695△0596和野生株的H. pylori 26695单菌落, 接种到空肠弯曲菌血琼脂生长培养基中, 生长3 d后. 用1 mL的布氏肉汤收菌, 并且取1 mL培养物(约1×109 CFU), 加生理盐水处理, 离心收集菌体, 500 μL TE缓冲液重悬(终浓度为30 g/L), 然后用TRIzol提取菌体的总RNA, 具体操作按照说明书进行. 得到的总RNA测定浓度后取约1 μg作为模板, 利用随机引物反转录合成cNDA第一链, 然后再以此cDNA作为模板, 使用引物p5/p6, p5/p8进行RT-PCR分析.
1.2.5 H. pylori 26695△0596基因缺失突变株的全菌蛋白和免疫印迹分析: 通过PCR坚定的菌确定在基因水平发生了重组, 取其500 μL 3 d培养物, 4 ℃, 17 000 g离心5 min, 弃上清, 再用等体积PBS洗涤3次, 最后用30 μL PBS重悬菌体, 按照实验手册制备全菌蛋白样品, 进行SDS-PAGE电泳分析和免疫印迹分析. 硝酸纤维素膜用5%脱脂奶粉室温封闭2 h; 再与HP0596兔多抗血清(1:10 000)37 ℃共孵育2 h; 用PBST洗涤3次, 每次5 min, 然后与HRP标记的羊抗兔IgG抗体(1:5 000)共孵育1 h, 最后将硝酸纤维素膜用PBST洗干净后用HRP显色试剂盒进行显色.
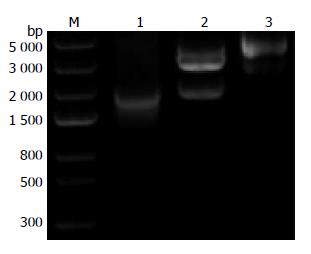
PCR扩增上下游同源臂和抗性片段, 经琼脂糖凝胶电泳分析表明, PCR扩增出的产物与目的片段预期大小一致, 其中上游同源臂为452 bp、下游同源臂为380 bp, 氯霉素抗性片段为1 033 bp片段. 打靶载体构建上述3种片段纯化后, 连接pBluescript SKⅡ(-)载体构建成打靶载体pBS0596, 双酶切实验鉴定表明, 用KpnⅠ/XhoⅠ双酶切鉴定可以得到约452 bp的上游同源臂片段, 用SalⅠ/BamHⅠ双酶切可以得到约380 bp的下游同源臂片段, 用XhoⅠ/SalⅠ双酶切可以得到约1 033 bp的氯霉素抗性片段. 同样用PCR方法鉴定表明, 将pBS0596用引物p1/p8扩增得到了约1 800 bp的片段, 打靶载体用上游同源臂起始处的KpnⅠ和下游同源臂终结处的BamHⅠ双酶切鉴定也得到约1 800 bp的片段(图1). 鉴定结果表明上下游同源臂均成功地连接到载体pBluescript SKⅡ(-)上, 测序鉴定结果也说明序列完全正确.
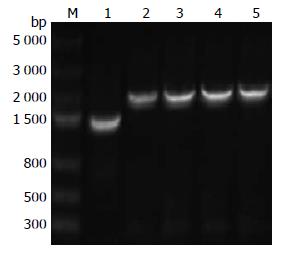
随机挑选在含氯霉素的空肠弯曲菌血琼脂生平板上生长出的4个单菌落做全菌PCR鉴定(图2), 用基因上游同源臂起始处的p1引物和下游同源臂终结处的p8引物对重组转化子进行PCR鉴定. 结果表明, 扩增得到两条片段. 一条为约为1.5 kb的片段, 与以正常对照H. pylori 26695为模板扩增的片段理论长度一致. 另一条约为1.8 kb, 与重组菌片段理论长度一致, 说明对应的菌株已经在基因位点发生了重组. 将该1.8 kb片段克隆到T载体中, 进行克隆和测序, 结果显示该序列的上下游分别含有基因上下游同源臂的片段, 中间为氯霉素抗性基因元件, 说明在基因组水平重组成功. 将新菌株命名为H. pylori 26695△0596. 研究结果显示在2-5号重组克隆中克隆都得到了1.8 kb特异性扩增带, 可见此基因打靶的克隆阳性率非常高.
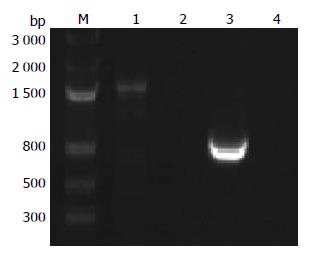
对于DNA水平鉴定为阳性菌株, 应用TRIzol提取细菌总RNA. 以hp0596基因特异性的引物p5/p8和p5/p6进行RT-PCR鉴定. 对于H. pylori 26695△0596基因完全敲除菌株, 用引物p5/p8和p5/p6扩不出条带, 而对照菌株则分别扩出一条1 500 bp和576 bp的条带, 实验结果说明在RNA水平上, hp0596基因已经被成功敲除(图3).
将在DNA、RNA水平鉴定为阳性hp0596基因缺失的菌株(两株)进行SDS-PAGE电泳分析, HP0596蛋白相对分子质量大小为21.7 000 Da, 在电泳上样量大致相当的情况下, 对照菌株H. pylori 26695的HP0596蛋白表达水平很高. 而相比之下, 缺失突变株在对应位置表达的蛋白却很少几乎没有表达, 这一结果也就从蛋白水平进一步证实成功敲除hp0596基因. 另外, 以HP0596蛋白的兔多抗血清作为一抗对其中两株重组菌进行免疫印迹分析也从另一个侧面证实了上述实验结果(图4).
hp0596[8]是H. pylori特有的基因, 与目前其他已知的H. pylori其他毒力基因如cagA、urease, vacA等没有序列相似性, 他只与H. pylori J99株的jhp0543、H. pylori SR7791株的HP-MP1[9]以及一些临床分离菌株的相似基因有同源性, 在H. pylori以外的生物中还未发现与其相似的基因.
H. pylori定植于胃黏膜上皮表面黏液层中的中性微需氧环境中, 通过刺激上皮细胞产生细胞因子, 并促使黏膜固有层的免疫炎症细胞的聚集与活化, 造成慢性胃炎. 已证实H. pylori相关的胃炎与IL-1, IL-6和TNF-α等因子的升高有关[10]. 大量调查研究显示[11], H. pylori阳性慢性胃炎患者胃黏膜组织TNF-α蛋白水平明显高于对照组, 而且H. pylori阳性慢性活动性胃炎患者经抗H. pylori治疗后, 胃窦黏膜组织分泌TNF-α水平明显降低(P<0.05). 提示H. pylori感染后, 胃窦黏膜组织TNF-α表达升高, 并引起胃黏膜细胞损伤[12]. 这些都说明TNF-α在慢性胃炎中起重要作用. TNF-α过度表达诱发炎症反应, 导致出现临床胃炎症状. 而H. pylori 26695菌株的基因产物HP0596蛋白已被鉴定为TNF-α诱发的蛋白, 与巨噬细胞共孵育可以刺激其分泌TNF-α[13].
为了更好地研究HP0596蛋白的功能, 本实验通过同源重组原理构建了H. pylori 26695△0596基因缺失突变株. 利用PCR技术, 分别扩增得到目的基因的上游同源臂和下游同源臂, 与两端带有FRT位点的氯霉素抗性基因片段共同构建同源重组载体pBS0596; 以重组载体为模板扩增打靶片段, 我们采用电穿孔转化技术, 将打靶载体pBS0596转化入H. pylori 26695. 在抗生素压力的帮助下, 打靶片段和菌体基因组发生同源重组, 通过氯霉素抗性筛选得到带有抗性标记的重组菌. 随后因突变载体不能在H. pylori 26695菌体内生长复制而丢失.
检测突变株H. pylori 26695△0596是否还存在hp0596基因或蛋白, 是最后认证hp0596基因缺失突变株构建成功与否的关键. 我们对野生株和突变株的基因组进行了PCR鉴定, 用hp0596基因两侧的引物进行长片段扩增, 野生株可以扩出完整的hp0596基因和非编码序列的长约1 500 bp片段, 而突变株可以扩出约1 800 bp的基因片段. 提示hp0596基因完整编码区(576 bp)被氯霉素抗性片段(1 033 bp)所取代. 另外, 在RNA水平和蛋白水平上也得到了相同的验证, 使用引物p5/p6, p7/p8进行RT-PCR分析. 野生株可以扩出约1 500 bp/576 bp大小的片段, 而突变株中没有相同的条带. 这一结果也就从RNA水平进一步证实hp0596基因敲除成功. 以HP0596蛋白的兔多抗血清作为一抗, 羊抗兔作为二抗重组菌进行免疫印迹分析的结果表明, 野生菌株特异蛋白表达约22 000 Da, 而突变株蛋白并未表达, 从而在蛋白水平上证实了上述实验结果. 本研究构建的hp0596基因缺失突变株为进一步研究幽门螺杆菌中hp0596基因的功能, 阐明其在H. pylori致病中的地位及作用奠定了实验基础. 目前, H. pylori 26695△0596与突变株相关功能的研究正在进行之中.
hp0596是H. pylori特有的基因, 与目前已知的H. pylori毒力基因cagA、 urease, vacA等没有序列相似性, 他只与J99株的jhp0543、SR7791株的HP-MP1同源以及一些临床分离菌株的相似基因有同源性, 在H. pylori以外的生物中还未发现与其相似的基因.
颜宏利, 教授, 中国人民解放军第二军医大学遗传学教研室
大量调查研究显示, H. pylori阳性慢性胃炎患者胃黏膜组织TNF-α蛋白水平明显高于对照组, 而且H. pylori阳性慢性活动性胃炎患者经抗H. pylori治疗后, 胃窦黏膜组织分泌TNF-α水平明显降低(P<0.05).
本文通过同源重组方法敲除H. pylori中H. pylori 26695△0596基因, 首次构建出源自幽门螺杆菌hp0596基因全部缺失的hp0596阴性突变株, 为研究中国幽门螺杆菌hp0596基因的生物学功能及其在毒力相关蛋白表达中的作用, 从而在明确hp0596基因与幽门螺杆菌致病性的关系等方面奠定实验基础.
为进一步探讨hp0596致癌机制, 本研究利用同源重组技术敲除了H. pylori 26695株的hp0596基因, 构建了H. pylori 26695△0596缺失突变体, 为系统研究hp0596基因功能创造了条件, 为进一步阐明H. pylori致病机制奠定基础.
本文结果可靠, 具有一定的研究意义及实用价值.
编辑: 曹丽鸥 电编:何基才
| 1. | Peek RM Jr, Blaser MJ. Helicobacter pylori and gastrointestinal tract adenocarcinomas. Nat Rev Cancer. 2002;2:28-37. [PubMed] [DOI] |
| 3. | Jang JY, Yoon HJ, Yoon JY, Kim HS, Lee SJ, Kim KH, Kim do J, Jang S, Han BG, Lee BI. Crystal structure of the TNF-alpha-Inducing protein (Tipalpha) from Helicobacter pylori: Insights into Its DNA-binding activity. J Mol Biol. 2009;392:191-197. [PubMed] [DOI] |
| 4. | J. 萨姆布鲁克, E.F. 弗里奇, T. 曼尼阿蒂斯. 分子克隆实验指南. 第2版. 北京: 科学出版社, 1992: 50-51. . |
| 6. | Yuan JP, Li T, Shi XD, Hu BY, Yang GZ, Tong SQ, Guo XK. Deletion of Helicobacter pylori vacuolating cytotoxin gene by introduction of directed mutagenesis. World J Gastroenterol. 2003;9:2251-2257. [PubMed] |
| 7. | Zeng X, He LH, Yin Y, Zhang MJ, Zhang JZ. Deletion of cagA gene of Helicobacter pylori by PCR products. World J Gastroenterol. 2005;11:3255-3259. [PubMed] |
| 8. | Kuzuhara T, Suganuma M, Tsuge H, Fujiki H. Presence of a motif conserved between Helicobacter pylori TNF-alpha inducing protein (Tipalpha) and penicillin-binding proteins. Biol Pharm Bull. 2005;28:2133-2137. [PubMed] [DOI] |
| 9. | Suganuma M, Kurusu M, Okabe S, Sueoka N, Yoshida M, Wakatsuki Y, Fujiki H. Helicobacter pylori membrane protein 1: a new carcinogenic factor of Helicobacter pylori. Cancer Res. 2001;61:6356-6359. [PubMed] |
| 10. | Gobert AP, Bambou JC, Werts C, Balloy V, Chignard M, Moran AP, Ferrero RL. Helicobacter pylori heat shock protein 60 mediates interleukin-6 production by macrophages via a toll-like receptor (TLR)-2-, TLR-4-, and myeloid differentiation factor 88-independent mechanism. J Biol Chem. 2004;279:245-250. [PubMed] [DOI] |
| 11. | Nahar IK, Shojania K, Marra CA, Alamgir AH, Anis AH. Infliximab treatment of rheumatoid arthritis and Crohn's disease. Ann Pharmacother. 2003;37:1256-1265. [PubMed] [DOI] |
| 12. | Tilly K, Elias AF, Bono JL, Stewart P, Rosa P. DNA exchange and insertional inactivation in spirochetes. J Mol Microbiol Biotechnol. 2000;2:433-442. [PubMed] |
| 13. | Godlewska R, Pawlowski M, Dzwonek A, Mikula M, Ostrowski J, Drela N, Jagusztyn-Krynicka EK. Tip-alpha (hp0596 gene product) is a highly immunogenic Helicobacter pylori protein involved in colonization of mouse gastric mucosa. Curr Microbiol. 2008;56:279-286. [PubMed] [DOI] |