修回日期: 2010-07-10
接受日期: 2010-07-21
在线出版日期: 2010-08-28
目的: 探讨化疗药物全反式维甲酸(ATRA)与奈达铂(nedaplatin)单独及联合应用对人肝癌细胞株Huh-7增殖与凋亡的影响.
方法: 选取不同浓度的ATRA(1×10-4、1×10-5、1×10-6 mol/L)、奈达铂(1、2、5 mg/L)并选用ATRA 1×10-5 mol/L联合不同浓度奈达铂(1、2、5 mg/L)分别作用于肝癌细胞24、48、72 h; 另外, 通过预实验筛选有效终浓度的ATRA(1×10-5 mol/L)+奈达铂(1 mg/L)作为联合处理组作用于肝癌细胞24、48、72 h; 采用倒置显微镜观察细胞形态学改变, MTT法观察ATRA、奈达铂及两药联合对Huh-7细胞增殖的影响; 应用流式细胞仪分析其对细胞凋亡率的影响.
结果: 不同浓度的ATRA(1×10-4、1×10-5、1×10-6 mol/L)和奈达铂(1、2、5 mg/L)单独作用于Huh-7细胞均有明显的抑制作用, 该作用随时间的延长、浓度的增加而逐渐增强(P<0.01); 两药联合表现为协同作用, 与单药相比具有显著性差异(P<0.01). Huh-7细胞经ATRA 1×10-5 mol/L、NDP 1 mg/L及两药联合作用48 h后, 流式细胞仪检测凋亡凋亡率分别为28.49%±0.6%, 42.57%±1.03%, 55.35%±1.30%, 单药组与联合组比较具有显著性差异(均P<0.01). 提示ATRA(1×10-5 mol/L)+奈达铂(1 mg/L)联合作用时具协同效应.
结论: ATRA与奈达铂对人肝癌细胞株Huh-7均有抑制增殖和促进凋亡的作用, 且与单药比较, ATRA联合奈达铂能够明显提高肝癌细胞对化疗的敏感性.
引文著录: 刘景, 徐晶, 丁剑午. ATRA联合奈达铂对人肝癌细胞株Huh-7增殖与凋亡的影响. 世界华人消化杂志 2010; 18(24): 2538-2544
Revised: July 10, 2010
Accepted: July 21, 2010
Published online: August 28, 2010
AIM: To observe the effects of all-trans retinoic acid (ATRA) and nedaplatin, alone or in combination, on cell proliferation and apoptosis in human hepatoma cell line Huh-7, and to determine whether the two drugs in combination have a synergistic effect in treating hepatocarcinoma.
METHODS: After Huh-7 cells were incubated with different concentrations of ATRA (10-4, 10-5 and 10-6 mol/L) and nedaplatin (1, 2 and 5 mg/L), alone or in combination, for 24, 48 and 72 h, cell morphology changes were observed using an inverted microscope; cell proliferation was evaluated by MTT assay; and apoptosis was evaluated by flow cytometry.
RESULTS: Both ATRA and nedaplatin could markedly inhibit cell proliferation in a time- and concentration-dependent manner (all P < 0.01). ATRA and nedaplatin in combination had a significant synergistic effect on cell proliferation compared with ATRA or nedaplatin alone (both P < 0.01). Both ATRA and nedaplatin promoted the apoptosis of Huh-7 cells. The apoptosis rate was significantly lower in Huh-7 cells treated with ATRA and nedaplatin alone for 48 h than in those treated with the two drugs in combination (28.49% ± 0.6%, 42.57% ± 1.03% vs 55.35% ± 1.30%, both P < 0.01), suggesting a synergistic effect of combined nedaplatin and ATRA on the apoptosis of Huh-7 cells.
CONCLUSION: Both ATRA and nedaplatin can inhibit cell proliferation and promote apoptosis in human hepatoma cell line Huh-7. ATRA combined with nedaplatin has a significant synergistic effect on the proliferation and apoptosis of Huh-7 cells.
- Citation: Liu J, Xu J, Ding JW. ATRA in combination with nedaplatin inhibits cell proliferation but promotes apoptosis in human hepatoma cell line Huh-7. Shijie Huaren Xiaohua Zazhi 2010; 18(24): 2538-2544
- URL: https://www.wjgnet.com/1009-3079/full/v18/i24/2538.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i24.2538
肝癌是目前最常见的恶性肿瘤之一, 手术、放疗、化疗、介入是其治疗的主要措施. 但肝癌常规化疗效果差, 而且容易产生对原化疗药物明显的耐药性. 为此, 寻求协同、增敏等肝癌有效的综合治疗方案成为人们一直研究的热点. 大量的研究表明[1-3], 全反式维甲酸(all-trans retinoic acid, ATRA)是治疗急性早幼粒细胞白血病的一种最有效的药物之一. 同时, ATRA在其他领域也发挥了很好的抗肿瘤效果, 如神经母细胞瘤、皮肤癌、乳腺癌、子宫内膜癌、卵巢癌、口腔癌、肺癌、胰腺癌、前列腺癌、黑色素瘤等[4-18]. 而奈达铂(nedaplatin, NDP)作为肝癌一线化疗药物顺铂的新的衍生物, 他较顺铂具有更宽的剂量域, 显示出更优越的抗肿瘤效果, 且不良反应较少. 本研究将以ATRA联合奈达铂作用于人肝癌细胞株Huh-7, 探讨两药对Huh-7细胞增殖和凋亡的影响.
人肝癌细胞株Huh-7由南昌大学第二附属医院分子生物中心提供. ATRA购自美国Sigma公司, 使用浓度为1×10-4、1×10-5、1×10-6 mol/L; 注射用NDP购自南京东捷药业公司, 使用浓度分别为1、2、5 mg/L, MTT试剂购自美国Sigma公司, DMEM培养液及胎牛血清购自Hyclon公司, Annexin-V-PI凋亡试剂盒购自南京凯基公司.
1.2.1 细胞培养和药物配制: Huh-7细胞用含100 mL/L胎牛血清的DMEM培养液, 在50 mL/L CO2, 37 ℃条件下的孵箱中培养, 细胞长满至瓶底80%左右时传代. ATRA用无水乙醇溶解配制成1×10-2 mol/L(100 mg ATRA溶于33.3 mL无水乙醇), NDP用生理盐水溶解配制成100 mg/L(10 mg NDP溶于100 mL生理盐水)的备用液, 需要时用培养液稀释至所需浓度.
1.2.2 分组: 根据预实验结果设ATRA单药浓度为1×10-4、1×10-5、1×10-6 mol/L 3组. 经MTT分析, 单药ATRA 1×10-5 mol/L对细胞有明显的抑制作用, 且在各时间点与ATRA 1×10-4 mol/L比较无明显统计学差异(均P>0.05), 因此选用ATRA 1×10-5 mol/L作为联合用药的处理浓度. 而NDP参照其药物动力学参数, 其在人体内达血药浓度峰值(总铂浓度、游离铂浓度)分别为6.72、6.5 mg/L, 选择其血浆峰浓度的0.1-1倍内设单药浓度为1、2、5 mg/L 3组. 最后筛选出细胞凋亡率明显且坏死率相对较低的NDP 1 mg/L+ATRA 1×10-5 mol/L作为联合用药组的有效终浓度. 将只加培养液组设为对照组. 设24、48、72 h 3个时间点.
1.2.3 倒置显微镜观察细胞形态变化: 倒置显微镜下观察各组细胞处理前后的形态变化.
1.2.4 MTT法观察药物对细胞增殖的影响: 将生长活力良好的Huh-7细胞以8 000个/孔接种于96孔板, 在37 ℃条件下, 含50 mL/L CO2的孵箱中培养24 h后按要求分别加入各实验组药物, 每组设4个复孔, 同时设空白对照组, 培养24、48、72 h后, 每孔加入MTT溶液(5 g/L)20 mL, 继续培养4 h后, 弃掉培养液, 每孔加入DMSO 100 mL, 振荡10 min, 使充分溶解混匀. 用酶标仪在492 nm处测定吸光度(A)值. 按公式计算细胞增殖抑制率. 细胞增殖抑制率 = [(对照孔A值-实验孔A值)/对照孔A值]×100%. 重复MTT法, 计算24、48、72 h后的细胞抑制率. 另外根据Web系数来判定联合用药后两药是否具有协同作用. 采用以下公式计算: 预估效应C = A1×A2, 其中A1、A2代表两种单药作用后的细胞存活率(%). 当C>实际存活率时, 代表两药作用协同. 当C = 实际存活率时, 代表两药作用相加. C<实际存活率时<A1、A2时, 代表两药作用次相加.
1.2.5 流式细胞仪检测细胞凋亡率: 将生长活力良好的Huh-7细胞接种于96孔板, 在37 ℃条件下, 含50 mL/L CO2的孵箱中培养24 h后按要求分别加入各实验组药物, 同时设对照组, 继续培养48 h后用2.5 g/L的胰酶消化成单细胞悬液, 1 000 r/min离心5 min, 弃上清, 用PBS洗涤1次, 1 000 r/min再次离心5 min, 弃上清, 按Annexin-V-PI试剂盒步骤操作后上机检测. 记录激发波长488 nm处红色荧光, 记数细胞为1 000个, 检测凋亡率.
统计学处理 采用SPSS11.5统计软件进行配对t检验分析, 所有数据采用mean±SD表示, 相关性以Pearson相关分析, 检验水准a = 0.05, P<0.01为差异性显著.
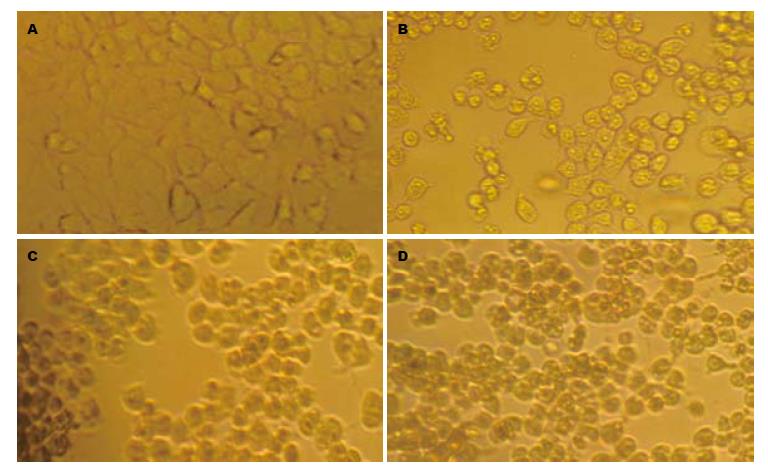
在倒置显微镜下观察, 正常细胞呈现弥漫均匀分布, 细胞边缘界线清楚, 凋亡细胞形态变圆, 大小不等, 体积缩小, 核碎裂或溶解. 本实验对照组活细胞生长良好, 而各处理组活细胞数目较对照组不同程度减少, 并可见较多的凋亡细胞, 而且ATRA+NDP联合用药组凋亡细胞明显较单药组增多(图1).
2.2.1 ATRA、NDP对Huh-7细胞生长抑制的效应: ATRA和NDP对Huh-7细胞均有明显的生长抑制作用, 且该作用呈时间、浓度依赖性, 即同一时间其抑制作用随药物浓度增加而增强, 同一浓度其抑制作用随作用时间延长而增强. 另外, ATRA 1×10-5 mol/L与NDP联合作用时, 其对Huh-7细胞的抑制作用较NDP单药相比有显著增加. 而相反, 随各组药物浓度增加、作用时间延长, 其活细胞A492下降明显. 各药物组作用后与对照组比较, 有显著统计学意义(均P<0.01, 表1).
| 分组 | 药物浓度 | 作用时间 | ||
| 24 h | 48 h | 72 h | ||
| ATRA(mol/L) | 1×10-4 | 0.315±0.166b | 0.592±0.008b | 0.594±0.018b |
| 1×10-5 | 0.322±0.017b | 0.609±0.016b | 0.628±0.020b | |
| 1×10-6 | 0.346±0.026b | 0.732±0.025b | 0.753±0.035b | |
| NDP(mg/L) | 5 | 0.321±0.019b | 0.677±0.027b | 0.670±0.039b |
| 2 | 0.331±0.021b | 0.701±0.018b | 0.716±0.012b | |
| 1 | 0.342±0.025b | 0.715±0.016b | 0.759±0.020b | |
| ATRA(mol/L)+ | 1×10-5+5 | 0.213±0.004b | 0.321±0.014b | 0.227±0.015b |
| NDP(mg/L) | 1×10-5+2 | 0.250±0.015b | 0.390±0.010b | 0.302±0.009b |
| 1×10-5+1 | 0.275±0.011b | 0.446±0.017b | 0.377±0.025b | |
| 对照组 | 0 | 0.380±0.024 | 0.849±0.021 | 0.969±0.042 |
2.2.2 ATRA联合NDP对Huh-7细胞的抑制作用: 选择ATRA 1×10-5 mol/L与NDP 1 mg/L联合作用于Huh-7细胞, 计算24、48、72 h的细胞抑制率(表2). 结果显示: (1)ATRA和NDP联合组与两单药组的作用比较, 抑制率有明显提高(均P<0.01); (2)根据单药作用结果计算出联合用药后24、48、72 h的预估细胞存活率C值分别为76.42%、60.76%、50.33%, 三者均高于其实际细胞存活率72.35%、52.48%、38.71%, 表现为两药协同作用.
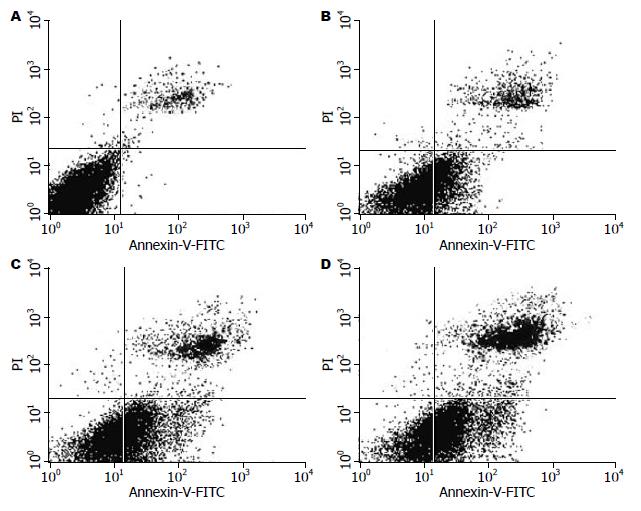
Huh-7细胞经ATRA 1×10-5 mol/L、NDP 1 mg/L及两药联合作用48 h后, 用流式细胞仪进行凋亡率检测, 结果显示: 对照组为0.82%±0.15%, NDP 1 mg/L组为28.49%±0.6%, ATRA 1×10-5 mol/L组为42.57%±1.03%, ATRA 1×10-5 mol/L+NDP 1 mg/L联合作用组为55.35%±1.30%. 与单药比较差异有显著统计学意义(均P<0.01, 图2).
众所周知, 维甲酸类药物是一种良好的诱导分化剂, 他能够完全缓解急性早幼粒细胞白血病的症状, 并已成功应用于临床白血病的治疗[1]. 除此以外, 维甲酸还能参与并调节细胞的其他活动, 包括细胞增殖、代谢、繁殖、形态并且可诱导细胞凋亡[19]. 在肝癌研究领域, Hsu等[20]使用终浓度为10 mmol/L的维甲酸处理人肝癌Hep3B细胞, 24 h即可见癌细胞凋亡迹象, 48-72 h用免疫荧光显微镜及DNA碎片分析显示明显的细胞凋亡, 其表现为核的固缩和碎裂, 并出现180-200 bp的DNA碎片梯度. Nakanishi等[21]也使用50 mmol/L的ATRA作用于肝癌HepG2细胞, 48 h后开始呈现细胞生长抑制现象, 凋亡明显. 因此, 从细胞形态学和分子生物学水平都进一步验证了维甲酸类药物可以诱导肝癌细胞凋亡. 同样, 在其他肿瘤实验研究中, Srivastava等[22]应用维甲酸与cAMP类似物8-Cl-cAMP分别作用于人卵巢癌细胞OVCAR-3和OVCAR-8, 实验发现两药物均能引起细胞生长抑制, 并产生细胞凋亡, 且维甲酸与8-Cl-cAMP联合诱导细胞凋亡的作用较单药作用增强. Das等[23]研究发现, 维甲酸能通过诱导分化及下调端粒酶的活性和原癌基因N-Myc表达而提高其对人恶性神经母细胞瘤SH-SY5Y的促凋亡作用. 还有, Zhang等[24]将10 mmol/L的ATRA作用于黑色素瘤细胞后, 经流式细胞仪检测发现肿瘤细胞凋亡明显. Dutta等[8]通过应用RT-PCR、Western blot等方法研究发现, ATRA作用于乳腺癌MCF-7细胞后, 能有效抑制基质金属蛋白酶-2(matrix metalloproteinase-2, MMP-2)在肿瘤中的高表达. 而最近的研究, Jiménez-Lara等[25]发现维甲酸的抗肿瘤作用, 可通过介导NF-kappaB的途径实现抑制乳腺癌细胞的增殖, 促进其凋亡. 除此之外, 在联合用药方面, Kucukzeybek等[26]发现ATRA和多西紫杉醇在前列腺癌DU-145细胞中有协同促凋亡作用, 主要因为联合用药后能大幅下调生存素BIRC5、髓样细胞白血病-1(myeloid cell leukemia-1, MCL-1)蛋白和淋巴毒素b受体(lymphotoxin b receptor, LTbR)基因的表达, 而这三者都是细胞凋亡和细胞周期调控中的关键角色. 基于维甲酸以上的多种功能, 又有研究者认为[27]维甲酸类化合物发挥其基因调控的作用是通过与两种不同的核受体相结合, 即RAR和RXR, 二者各自包括3种亚型a, b, g, 属于类固醇和甲状腺家族的一部分, 他们能与癌细胞中特异的DNA片段结合, 而达到抗肿瘤的效果.
而同样是作为目前广泛应用的第二代铂类抗癌药物-NDP, 其抗癌谱广, 尤其对于头颈部肿瘤疗效显著[28,29]. NDP的抗癌机制主要是与DNA结合从而抑制DNA的复制达到抗瘤作用. 且NDP与顺铂比较, 其治疗指数高, 不良反应小, 安全性好, 尤其是NDP消化系反应和肝、肾及神经毒性非常小[30].
在本研究中我们发现ATRA和NDP对人肝癌细胞株Huh-7均有抑制细胞生长、促进凋亡的作用, 经MTT法、流式细胞仪测定凋亡率可见, 在一定浓度范围内随浓度增加其抑制作用增强, 并且无论ATRA与NDP单用或联合作用, 随时间的延长同一药物浓度组对细胞的抑制作用逐渐增大. 此外, ATRA及NDP联合应用时两药表现为协同作用, 即两种药物对人肝癌细胞株Huh-7的联合作用效果优于单独用药.
由此可见, 本研究联合应用ATRA与NDP作用于人肝癌细胞株Huh-7的实验结果为治疗肝癌提供了新的、初步的实验依据, 同时也为进一步寻找肝癌的综合化学治疗拓宽了思路. 但是ATRA联合NDP能否用于临床治疗肝癌的推广, 其深入的作用机制仍然不很清楚, 因此, 还有待从分子靶向水平及综合不良反应的处理等诸多方面进行更进一步的研究.
原发性肝癌恶性程度高, 患者发现时大多已是晚期, 治疗棘手. 而经过多年的临床证实, ATRA对多种肿瘤治疗有效. 因此, 将ATRA联合其他化疗药物应用于癌症的综合治疗已成为当前研究的热点之一.
刘宝瑞, 教授, 南京大学医学院附属鼓楼医院肿瘤中心
肝癌是目前最常见的恶性肿瘤之一, 手术、放疗、化疗、介入是其治疗的主要措施. 但肝癌常规化疗效果差, 而且容易产生对原化疗药物明显的耐药性. 为此, 寻求协同、增敏等肝癌有效的综合治疗方案成为人们一直研究的热点.
Das等研究发现, 维甲酸能通过诱导分化及下调端粒酶的活性和原癌基因N-Myc表达而提高其对人恶性神经母细胞瘤SH-SY5Y的促凋亡作用.
本研究是国内首次将ATRA联合NDP应用于肝癌的研究, 其结果为治疗肝癌提供新的、初步的实验依据, 同时也为进一步寻找肝癌的综合化学治疗拓宽了思路.
本研究联合ATRA与NDP作用于人肝癌细胞株Huh-7的实验结果可能成为肝癌综合化疗的一个新选择, 同时也有望在进一步的肝癌分子靶向研究中取得新的突破.
本文选题新颖, 具有一定的临床实用价值.
编辑: 李军亮 电编:何基才
| 1. | Zhou GB, Zhang J, Wang ZY, Chen SJ, Chen Z. Treatment of acute promyelocytic leukaemia with all-trans retinoic acid and arsenic trioxide: a paradigm of synergistic molecular targeting therapy. Philos Trans R Soc Lond B Biol Sci. 2007;362:959-971. [PubMed] [DOI] |
| 2. | Frankfurt O, Tallman MS. Strategies for the treatment of acute promyelocytic leukemia. J Natl Compr Canc Netw. 2006;4:37-50. [PubMed] |
| 3. | Ozeki M, Shively JE. Differential cell fates induced by all-trans retinoic acid-treated HL-60 human leukemia cells. J Leukoc Biol. 2008;84:769-779. [PubMed] [DOI] |
| 4. | Jiang M, Zhu K, Grenet J, Lahti JM. Retinoic acid induces caspase-8 transcription via phospho-CREB and increases apoptotic responses to death stimuli in neuroblastoma cells. Biochim Biophys Acta. 2008;1783:1055-1067. [PubMed] |
| 5. | Alique M, Herrero JF, Lucio-Cazana FJ. All-trans retinoic acid induces COX-2 and prostaglandin E2 synthesis in SH-SY5Y human neuroblastoma cells: involvement of retinoic acid receptors and extracellular-regulated kinase 1/2. J Neuroinflammation. 2007;4:1. [PubMed] [DOI] |
| 6. | Chlapek P, Redova M, Zitterbart K, Hermanova M, Sterba J, Veselska R. Enhancement of ATRA-induced differentiation of neuroblastoma cells with LOX/COX inhibitors: an expression profiling study. J Exp Clin Cancer Res. 2010;29:45. [PubMed] [DOI] |
| 7. | Cheepala SB, Yin W, Syed Z, Gill JN, McMillian A, Kleiner HE, Lynch M, Loganantharaj R, Trutschl M, Cvek U. Identification of the B-Raf/Mek/Erk MAP kinase pathway as a target for all-trans retinoic acid during skin cancer promotion. Mol Cancer. 2009;8:27. [PubMed] [DOI] |
| 8. | Dutta A, Sen T, Banerji A, Das S, Chatterjee A. Studies on Multifunctional Effect of All-Trans Retinoic Acid (ATRA) on Matrix Metalloproteinase-2 (MMP-2) and Its Regulatory Molecules in Human Breast Cancer Cells (MCF-7). J Oncol. 2009;2009:627840. [PubMed] |
| 9. | Patel JB, Mehta J, Belosay A, Sabnis G, Khandelwal A, Brodie AM, Soprano DR, Njar VC. Novel retinoic acid metabolism blocking agents have potent inhibitory activities on human breast cancer cells and tumour growth. Br J Cancer. 2007;96:1204-1215. [PubMed] [DOI] |
| 10. | Phipps SM, Love WK, White T, Andrews LG, Tollefsbol TO. Retinoid-induced histone deacetylation inhibits telomerase activity in estrogen receptor-negative breast cancer cells. Anticancer Res. 2009;29:4959-4964. [PubMed] |
| 11. | Hong J, Samudio I, Chintharlapalli S, Safe S. 1,1-bis(3'-indolyl)-1-(p-substituted phenyl)methanes decrease mitochondrial membrane potential and induce apoptosis in endometrial and other cancer cell lines. Mol Carcinog. 2008;47:492-507. [PubMed] [DOI] |
| 12. | Malik M, Webb J, Catherino WH. Retinoic acid treatment of human leiomyoma cells transformed the cell phenotype to one strongly resembling myometrial cells. Clin Endocrinol (Oxf). 2008;69:462-470. [PubMed] [DOI] |
| 13. | Radu M, Soprano DR, Soprano KJ. S10 phosphorylation of p27 mediates atRA induced growth arrest in ovarian carcinoma cell lines. J Cell Physiol. 2008;217:558-568. [PubMed] [DOI] |
| 14. | Xu Q, Zhang Z, Zhang P, Chen W. Antisense oligonucleotides and all-trans retinoic acid have a synergistic anti-tumor effect on oral squamous cell carcinoma. BMC Cancer. 2008;8:159. [PubMed] [DOI] |
| 15. | Choi EJ, Whang YM, Kim SJ, Kim HJ, Kim YH. Combinational treatment with retinoic acid derivatives in non-small cell lung carcinoma in vitro. J Korean Med Sci. 2007;22 Suppl:S52-S60. [PubMed] [DOI] |
| 16. | Singh B, Murphy RF, Ding XZ, Roginsky AB, Bell RH Jr, Adrian TE. On the role of transforming growth factor-beta in the growth inhibitory effects of retinoic acid in human pancreatic cancer cells. Mol Cancer. 2007;6:82. [PubMed] [DOI] |
| 17. | Huynh CK, Brodie AM, Njar VC. Inhibitory effects of retinoic acid metabolism blocking agents (RAMBAs) on the growth of human prostate cancer cells and LNCaP prostate tumour xenografts in SCID mice. Br J Cancer. 2006;94:513-523. [PubMed] [DOI] |
| 18. | Lee JH, Kishikawa M, Kumazoe M, Yamada K, Tachibana H. Vitamin A enhances antitumor effect of a green tea polyphenol on melanoma by upregulating the polyphenol sensing molecule 67-kDa laminin receptor. PLoS One. 2010;5:e11051. [PubMed] [DOI] |
| 19. | Zhang XK. Vitamin A and apoptosis in prostate cancer. Endocr Relat Cancer. 2002;9:87-102. [PubMed] [DOI] |
| 20. | Hsu SL, Chen MC, Chou YH, Hwang GY, Yin SC. Induction of p21(CIP1/Waf1) and activation of p34(cdc2) involved in retinoic acid-induced apoptosis in human hepatoma Hep3B cells. Exp Cell Res. 1999;248:87-96. [PubMed] [DOI] |
| 21. | Nakanishi M, Tomaru Y, Miura H, Hayashizaki Y, Suzuki M. Identification of transcriptional regulatory cascades in retinoic acid-induced growth arrest of HepG2 cells. Nucleic Acids Res. 2008;36:3443-3454. [PubMed] [DOI] |
| 22. | Srivastava RK, Srivastave AR, Cho-Chung YS. Synergistic effects of 8-Cl-cAMP and retinoic acids in the inhibition of growth and induction of apoptosis in ovarian cancer cells: induction of retinoic acid receptor beta. Mol Cell Biochem. 2000;204:1-9. [PubMed] [DOI] |
| 23. | Das A, Banik NL, Ray SK. Retinoids induce differentiation and downregulate telomerase activity and N-Myc to increase sensitivity to flavonoids for apoptosis in human malignant neuroblastoma SH-SY5Y cells. Int J Oncol. 2009;34:757-765. [PubMed] |
| 24. | Zhang H, Satyamoorthy K, Herlyn M, Rosdahl I. All-trans retinoic acid (atRA) differentially induces apoptosis in matched primary and metastatic melanoma cells -- a speculation on damage effect of atRA via mitochondrial dysfunction and cell cycle redistribution. Carcinogenesis. 2003;24:185-191. [PubMed] [DOI] |
| 25. | Jiménez-Lara AM, Aranda A, Gronemeyer H. Retinoic acid protects human breast cancer cells against etoposide-induced apoptosis by NF-kappaB-dependent but cIAP2-independent mechanisms. Mol Cancer. 2010;9:15. [PubMed] [DOI] |
| 26. | Kucukzeybek Y, Gul MK, Cengiz E, Erten C, Karaca B, Gorumlu G, Atmaca H, Uzunoglu S, Karabulut B, Sanli UA. Enhancement of docetaxel-induced cytotoxicity and apoptosis by all-trans retinoic acid (ATRA) through downregulation of survivin (BIRC5), MCL-1 and LTbeta-R in hormone- and drug resistant prostate cancer cell line, DU-145. J Exp Clin Cancer Res. 2008;27:37. [PubMed] [DOI] |
| 27. | Chen Y, Dokmanovic M, Stein WD, Ardecky RJ, Roninson IB. Agonist and antagonist of retinoic acid receptors cause similar changes in gene expression and induce senescence-like growth arrest in MCF-7 breast carcinoma cells. Cancer Res. 2006;66:8749-8761. [PubMed] [DOI] |
| 28. | Sekine I, Sumi M, Ito Y, Kato T, Fujisaka Y, Nokihara H, Yamamoto N, Kunitoh H, Ohe Y, Tamura T. Phase I study of cisplatin analogue nedaplatin, paclitaxel, and thoracic radiotherapy for unresectable stage III non-small cell lung cancer. Jpn J Clin Oncol. 2007;37:175-180. [PubMed] [DOI] |
| 29. | Fuwa N, Kodaira T, Tachibana H, Nakamura T, Daimon T. Dose escalation study of nedaplatin with 5-fluorouracil in combination with alternating radiotherapy in patients with head and neck cancer. Jpn J Clin Oncol. 2007;37:161-167. [PubMed] [DOI] |
| 30. | Takaoka E, Kawai K, Ando S, Shimazui T, Akaza H. Neutropenic colitis during standard dose combination chemotherapy with nedaplatin and irinotecan for testicular cancer. Jpn J Clin Oncol. 2006;36:60-63. [PubMed] [DOI] |