修回日期: 2010-07-08
接受日期: 2010-07-12
在线出版日期: 2010-08-28
目的: 探讨哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)及CyclinD1蛋白表达与食管癌发生、发展及浸润、转移的关系.
方法: 应用免疫组织化学SP法检测食管鳞癌组织62例及正常食管黏膜组织56例中mTOR及Cyclin D1蛋白表达.
结果: 食管鳞癌组织中mTOR及CyclinD1蛋白阳性表达率均显著高于正常食管黏膜组织中二者蛋白阳性表达率(53.2% vs 30.4%, 77.4% vs 12.3%), 组间比较差异均有统计学意义(χ2 = 5.400, 48.106, 均P<0.05); 食管鳞癌组织中CyclinD1蛋白阳性表达率与癌的组织学分级密切相关, 组间比较差异具有统计学意义(χ2 = 3.960, P<0.05); mTOR与CyclinD1的蛋白表达呈正相关关系(gp = 0.344, P<0.05).
结论: mTOR和CyclinD1在食管癌的浸润、转移及黏膜上皮癌变过程中起重要作用, mTOR及CyclinD1的联合检测可望成为食管鳞癌早期诊断和判断预后的分子指标之一.
引文著录: 陈会枝, 崔黎, 李晟磊, 陈奎生, 杨建萍. mTOR及CyclinD1蛋白在食管鳞癌中表达的相关性及临床病理意义. 世界华人消化杂志 2010; 18(24): 2533-2537
Revised: July 8, 2010
Accepted: July 12, 2010
Published online: August 28, 2010
AIM: To explore the relationship of mammalian target of rapamycin (mTOR) and Cyclin D1 protein expression with the development, progression, invasion, and metastasis of esophageal squamous cell carcinoma.
METHODS: The expression of mTOR and Cyclin D1 proteins in 62 esophageal squamous cell carcinoma specimens and 56 normal esophageal epithelial tissue specimens was detected by immunohistochemistry using the streptaridin-peroxidase method.
RESULTS: The positive rates of mTOR and Cyclin D1 protein expression in esophageal squamous cell carcinoma were significantly higher than those in normal esophageal epithelium (53.2% vs 30.4% and 77.4% vs 12.3%; χ2 = 5.400 and 48.106; both P < 0.05). The positive rate of mTOR protein expression is closely correlated with tumor histological grade in esophageal squamous cell carcinoma (χ2 = 3.960, P < 0.05). There is a positive correlation between the expression of mTOR and Cyclin D1 proteins (gp = 0.344, P < 0.05).
CONCLUSION: Both mTOR and Cyclin D1 play an important role in the invasion, metastasis and mucosal epithelial canceration of esophageal squamous cell carcinoma. Combined detection of mTOR and Cyclin D1 expression is a promising molecular parameter for early diagnosis and prognostic evaluation of esophageal squamous cell carcinoma.
- Citation: Chen HZ, Cui L, Li SL, Chen KS, Yang JP. Clinical pathological significance of mTOR and Cyclin D1 protein expression in esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2010; 18(24): 2533-2537
- URL: https://www.wjgnet.com/1009-3079/full/v18/i24/2533.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i24.2533
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)是一种非典型的丝氨酸/苏氨酸蛋白激酶, mTOR信号通路对细胞的生长及增殖起重要调节作用[1-3]. 细胞周期调节蛋白D1(cyclinD1 protein)是一类在细胞周期中含量呈周期性变化的细胞周期调节蛋白, 作为细胞周期的启动因子, 与多种恶性肿瘤的发生发展关系密切[4,5]. mTOR信号通路对细胞的生长及增殖起重要调节作用. 目前, 关于mTOR基因与食管癌浸润、转移的关系及mTOR与CyclinD1表达相关性的研究, 迄今国内外均未见报道. 本文采用免疫组织化学SP法检测mTOR与CyclinD1在62例食管鳞癌组织及56例正常食管黏膜组织中的表达, 探讨mTOR与CyclinD1在食管癌发生、发展中的作用, 以期寻找食管癌早期诊断和判断预后的分子指标.
所有标本选用2006-06/2007-06郑州大学一附院食管癌根治术中手术切除的食管癌组织石蜡包埋的标本62例, 每例食管鳞癌组织病理切片均有病理专家确诊. 术前患者均未接受放疗、化疗及其他治疗. 兔抗人mTOR单克隆抗体购自武汉博士德生物技术有限公司, 鼠抗人单克隆抗体CyclinD1及SP免疫组织化学试剂盒购自北京中杉金桥生物技术有限公司公司.
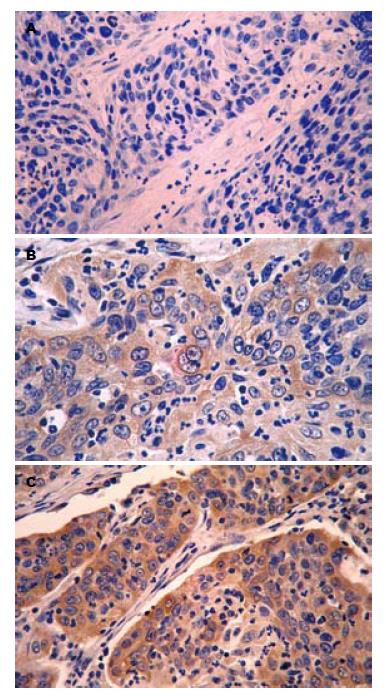
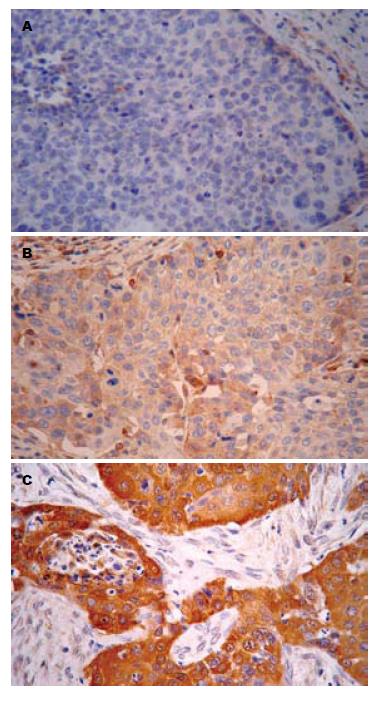
采用免疫组织化学SP法, mTOR及CyclinD1抗体稀释倍数为1:100及1:120, DAB显色, 苏木素复染. 染色步骤严格按说明书进行, 以PBS代替一抗作为阴性对照. mTOR与CyclinD1阳性信号是黄色颗粒样物质, 均位于细胞质内. 高倍镜下随机选取5个视野(每个视野观察细胞数不少于200个), 按阳性细胞所占百分比及着色深浅进行结果判定. 采用9分评分制: 按照阳性细胞比例≤10%为1分, 10%-50%为2分, >50%为3分; 按染色强弱: 阴性为0分; 淡黄色染色为1分; 中度黄色染色为2分, 棕黄色染色为3分. 然后按照"阳性细胞得分×染色强弱得分"计总分, 总分<3为阴性, 总分≥3为阳性[6,7].
统计学处理 应用SPSS13.0统计学软件, 行χ2检验和Spearman相关系数分析, 检验水准a = 0.05.
mTOR阳性表达蛋白主要位于肿瘤细胞的胞质中, 为浅黄色至深黄色颗粒样物质(图1). 其在食管鳞癌组织中的阳性表达率显著高于其在正常食管黏膜组织中的表达, 组间比较差异具有统计学意义(53.2% vs 30.4%, χ2 = 5.400, P<0.05, 表1). mTOR蛋白表达与食管鳞癌患者的组织学分级、浸润深度及有无淋巴结转移均无关(均P>0.05, 表2).
| n | mTOR | χ2值 | P值 | CyclinD1 | χ2值 | P值 | |||||
| -(n) | +(n) | 阳性率(%) | -(n) | +(n) | 阳性率(%) | ||||||
| 正常黏膜上皮 | 56 | 39 | 17 | 30.4 | 5.400 | 0.020 | 49 | 7 | 12.3 | 48.106 | 0.000 |
| 鳞癌 | 62 | 29 | 33 | 53.2 | 14 | 48 | 77.4 | ||||
| 病理特征 | mTOR | CyclinD1 | |||||
| n | 阳性表达n(%) | χ2值 | P值 | 阳性表达n(%) | χ2值 | P值 | |
| 分化程度 | |||||||
| 高-中分化 | 32 | 15(46.9) | 0.609 | 0.435 | 21(65.6) | 3.960 | 0.047 |
| 低分化 | 30 | 18(60.0) | 27(90.0) | ||||
| 浸润深度 | |||||||
| 浅层 | 25 | 12(48.0) | 0.175 | 0.676 | 20(80.0) | 0.008 | 0.928 |
| 深层 | 37 | 21(56.8) | 28(75.7) | ||||
| 淋巴结转移 | |||||||
| 无 | 33 | 16(48.5) | 0.295 | 0.587 | 33(69.7) | 1.555 | 0.212 |
| 有 | 29 | 17(58.6) | 25(86.2) | ||||
食管鳞癌是我国常见的消化系恶性肿瘤之一, 随着人类生活环境和饮食结构的改变, 食管鳞癌的发病率呈逐年上升趋势. 食管鳞癌的发生与发展是一个多因素作用的过程, 其中细胞信号传导通路上某些蛋白的异常对细胞恶变的影响已引起研究者的关注. 如何从分子水平来寻找食管癌可能的分子治疗靶点长期以来备受人们关注. 我们应用免疫组织化学技术系统对比研究了食管黏膜上皮癌变过程中mTOR及CyclinD1蛋白的变化规律及其与食管鳞癌临床生物学行为的关系.
tor基因是1991年在啤酒酵母的突变株TOR1和TOR2中发现的, tor1和tor2基因编码两个高度同源(70%)的TOR1和TOR2[8]. 后来在哺乳动物中也发现了结构和功能高度保守的TOR, 称为mTOR. 人类mtor基因定位于1p36.2, 编码的蛋白质含有2 549个氨基酸, 相对分子质量为280 000 Da. mTOR是一种高度保守的蛋白质, 属于丝氨酸/苏氨酸蛋白激酶PIKK家族(PtdInS3k-related kinase family)的成员. 在细胞周期中, mTOR在G1期向S期的转换过程中起着重要作用, 其主要功能是对蛋白的翻译进行调节. mTOR通过多条信号途径发挥其作用, 其中最重要的一条是PI3K/AKT途径[3,9], 细胞外界信号和膜受体结合后可激活位于膜上的PI3K, 活化PI3K激活下游的AKT, AKT活化后即可激活mTOR, mTOR两个下游底物分别是S6K1和4EBP1, 他们磷酸化后均可促进mRNA的翻译, 从而表达出大量与细胞生长增殖有关的蛋白质. 肿瘤的发生, 发展与细胞信号转导关系异常密切, 正常的细胞信号转导机制在肿瘤细胞中过度活跃, 或正常信号分子过度表达对肿瘤的发生有重要作用. 由于PI3K/AKT/mTOR信号通路被发现, 人类对PI3K/AKT/mTOR信号通路异常在肿瘤发生中的作用产生了浓厚的兴趣. 研究证明, 在肿瘤细胞中, mTOR上游负调节因子功能失调是mTOR信号通路激活的主要原因. 目前已知的上游调节因子包括PTEN、LKBT及SC1/TSC2等, 其中研究比较多的是PTEN[10], 他是一种重要的抑癌基因, PTEN的突变或缺失在乳腺癌、子宫内膜癌、前列腺癌等肿瘤中已被发现[11]. PTEN失活导致AKT信号活性增强, 从而进一步增强mTOR信号, 引发一系列细胞效应, 导致细胞恶变.
肿瘤的发生与发展是一个多因素作用的结果, 以往人们对肿瘤的研究多集中在癌基因和抑癌基因方面, 细胞信号转导通路的阐明, 极大地丰富了人们对细胞癌变机制的认识[12]. 现已发现, 许多肿瘤伴有mTOR信号通路的异常, 在该通路中mTOR过表达可对CyclinD1及Myc等癌基因在翻译水平上的表达产生影响[13]. mTOR的下游因子S6K1扩增或过表达的现象在多种肿瘤中亦有发生[14], S6K1中多个磷酸化位点受mTOR的直接调控, 其第389位苏氨酸残基可直接被mTOR磷酸化[15], 从而使S6K1活化. mTOR对S6K1的活化同时受TSC1/TSC2的影响. 有研究表明, 细胞内TSC1/TSC2的缺失可引起mTOR调节的S6K1活性升高[16,17]. mTOR的另一个下游因子为4EBP1, 4EBP1可被mTOR磷酸化, 磷酸化的4EBP1失去与eIF4E结合的能力, 从而促进mRNA的翻译[18]. 而eIF4E主要调控CyclinD1、Myc、Ras、NF-kB及Ki-67等蛋白质翻译, 其中很多蛋白质为细胞生长增殖所必须, 他具有促肿瘤发生作用[19]. 我们采用免疫组织化学法检测mTOR及CyclinD1在食管鳞癌组织及其相应正常黏膜组织中的表达. 结果显示, 二者在正常食管黏膜组织表达显著低于在食管鳞癌组织中的表达. mTOR蛋白表达与食管鳞癌组织的分化程度、浸润深度及淋巴结转移均无显著关系; CyclinD1蛋白表达与组织学分级密切相关, 而与食管癌的浸润、转移无明显关系. 这提示他在食管鳞癌的发生发展过程中起重要作用. mTOR蛋白与CyclinD1蛋白在食管鳞癌组织中的表达有显著的正相关性, 提示mTOR的过度表达, 可能通过上调CyclinD1蛋白的表达扰乱细胞正常的生长增殖周期, 从而促进细胞恶变. 两者在肿瘤的发生与分化中可能存在一定的相互协同效应. 结果还显示mTOR蛋白与CyclinD1表达的升高在食管鳞癌的发生与分化程度上起着重要的作用, 二者联合检测有助于准确评价食管癌的分化并估计其预后.
总之, 对mTOR及CyclinD1基因的深入研究有利于我们进一步的了解食管癌的生物学特性, 为食管癌的早期诊断和治疗提供一个新的发展方向.
细胞信号转导通路的阐明, 极大地丰富了人们对细胞癌变机制的认识. 现已发现, 许多肿瘤伴有mTOR信号通路的异常, 在该通路中mTOR过表达可对CyclinD1及Myc等癌基因在翻译水平上的表达产生影响. mTOR的下游因子S6K1扩增或过表达的现象在多种肿瘤中亦有发生.
李瑗, 教授, 广西肿瘤研究所
食管鳞癌的发生与发展是一个多因素作用的过程, 其中细胞信号传导通路上某些蛋白的异常对细胞恶变的影响已引起研究者的关注. 如何从分子水平来寻找食管癌可能的分子治疗靶点长期以来备受人们关注.
目前, 关于mTOR基因与食管癌浸润、转移的关系及mTOR与CyclinD1表达相关性的研究, 迄今国内外均未见报道. 本文采用免疫组织化学SP法检测mTOR与CyclinD1在62例食管鳞癌组织及56例正常食管黏膜组织中的表达, 探讨mTOR与CyclinD1在食管癌发生、发展中的作用, 以期寻找食管癌早期诊断和判断预后的分子指标.
本文可读性较好, 有一定的临床参考价值.
编辑: 李军亮 电编:何基才
| 1. | Habib N, Salaro C, Al-Ghaithi K, Phelps RG, Saggar S, Cohen SR. Severe aphthous stomatitis associated with oral calcineurin and mTOR inhibitors. Int J Dermatol. 2010;49:91-94. [PubMed] [DOI] |
| 2. | Wullschleger S, Loewith R, Hall MN. TOR signaling in growth and metabolism. Cell. 2006;124:471-484. [PubMed] |
| 3. | Ma L, Chen Z, Erdjument-Bromage H, Tempst P, Pandolfi PP. Phosphorylation and functional inactivation of TSC2 by Erk implications for tuberous sclerosis and cancer pathogenesis. Cell. 2005;121:179-193. [PubMed] |
| 4. | Lim EJ, Joung YH, Jung SM, Park SH, Park JH, Kim SY, Hwang TS, Hong DY, Chung SC, Ye SK. Hemin inhibits cyclin D1 and IGF-1 expression via STAT5b under hypoxia in ERalpha-negative MDA-MB 231 breast cancer cells. Int J Oncol. 2010;36:1243-1251. [PubMed] |
| 5. | Lehrbach DM, Cecconello I, Ribeiro U Jr, Capelozzi VL, Ab'saber AM, Alves VA. Adenocarcinoma of the esophagogastric junction: relationship between clinicopathological data and p53, cyclin D1 and Bcl-2 immunoexpressions. Arq Gastroenterol. 2009;46:315-320. [PubMed] [DOI] |
| 6. | 高 冬玲, 李 晟磊, 陈 奎生, 赵 志华, 赵 秋民, 刘 宗文, 张 云汉. 金属蛋白酶抑制基因RECK在食管鳞癌中的表达及生物学 意义. 世界华人消化杂志. 2008;16:1634-1638. [DOI] |
| 7. | 李 晟磊, 赵 秋民, 刘 宗文, 赵 志华, 高 冬玲, 郑 湘予, 陈 奎生, 张 云汉. 食管鳞癌中RECK和MMP-9蛋白表达的相关性及 临床病理意义. 世界华人消化杂志. 2007;15:1082-1086. [DOI] |
| 8. | Helliwell SB, Wagner P, Kunz J, Deuter-Reinhard M, Henriquez R, Hall MN. TOR1 and TOR2 are structurally and functionally similar but not identical phosphatidylinositol kinase homologues in yeast. Mol Biol Cell. 1994;5:105-118. [PubMed] |
| 9. | Janku F, Stewart DJ, Kurzrock R. Targeted therapy in non-small-cell lung cancer--is it becoming a reality? Nat Rev Clin Oncol. 2010;7:401-414. [PubMed] [DOI] |
| 10. | Peyrou M, Bourgoin L, Foti M. PTEN in non-alcoholic fatty liver disease/non-alcoholic steatohepatitis and cancer. Dig Dis. 2010;28:236-246. [PubMed] [DOI] |
| 11. | Law BK. Rapamycin: an anti-cancer immunosuppressant? Crit Rev Oncol Hematol. 2005;56:47-60. [PubMed] [DOI] |
| 12. | Johnson SM, Gulhati P, Rampy BA, Han Y, Rychahou PG, Doan HQ, Weiss HL, Evers BM. Novel expression patterns of PI3K/Akt/mTOR signaling pathway components in colorectal cancer. J Am Coll Surg. 2010;210:767-776, 776-778. [PubMed] |
| 13. | Gera JF, Mellinghoff IK, Shi Y, Rettig MB, Tran C, Hsu JH, Sawyers CL, Lichtenstein AK. AKT activity determines sensitivity to mammalian target of rapamycin (mTOR) inhibitors by regulating cyclin D1 and c-myc expression. J Biol Chem. 2004;279:2737-2746. [PubMed] [DOI] |
| 14. | Bjornsti MA, Houghton PJ. The TOR pathway: a target for cancer therapy. Nat Rev Cancer. 2004;4:335-348. [PubMed] [DOI] |
| 15. | Burnett PE, Barrow RK, Cohen NA, Snyder SH, Sabatini DM. RAFT1 phosphorylation of the translational regulators p70 S6 kinase and 4E-BP1. Proc Natl Acad Sci U S A. 1998;95:1432-1437. [PubMed] [DOI] |
| 16. | Veilleux A, Houde VP, Bellmann K, Marette A. Chronic inhibition of the mTORC1/S6K1 pathway increases insulin-induced PI3K activity but inhibits Akt2 and glucose transport stimulation in 3T3-L1 adipocytes. Mol Endocrinol. 2010;24:766-778. [PubMed] [DOI] |
| 17. | Alain T, Lun X, Martineau Y, Sean P, Pulendran B, Petroulakis E, Zemp FJ, Lemay CG, Roy D, Bell JC. Vesicular stomatitis virus oncolysis is potentiated by impairing mTORC1- dependent type I IFN production. Proc Natl Acad Sci U S A. 2010;107:1576-1581. [PubMed] [DOI] |
| 18. | Chen TJ, Wang DC, Chen SS. Amyloid-beta interrupts the PI3K-Akt-mTOR signaling pathway that could be involved in brain-derived neurotrophic factor-induced Arc expression in rat cortical neurons. J Neurosci Res. 2009;87:2297-2307. [PubMed] [DOI] |