修回日期: 2010-07-05
接受日期: 2010-07-21
在线出版日期: 2010-08-28
目的: 研究Sphk1对结肠癌细胞增殖、凋亡及侵袭的影响并探讨其机制.
方法: 将人结肠癌Lovo细胞株分成Sphk1激活组, Sphk1抑制组, 空白对照组. 以佛波醇-12-豆蔻酸酯-13-乙酸酯(phorbol 12-myristate 13-acetate, PMA)为Sphk1激活剂(终浓度为100 nmol/L), N, N-二甲基鞘胺醇(erythro-sphingosine N, N-Dimethyl, DMS)为Sphk1抑制剂(终浓度为50 mmol/L)处理Lovo细胞24 h后, 用MTT方法测定细胞的增殖活性, 用流式细胞术检测细胞凋亡, 用Transwell侵袭实验检测细胞侵袭能力, 用Western blot测定细胞Sphk1、ERK1/2、p-ERK1/2、NF-kB p65蛋白水平的变化.
结果: PMA可以明显诱导Sphk1蛋白的表达, 促进Lovo细胞生长, 抑制细胞的凋亡, 并促进细胞的侵袭; 相反, DMS明显抑制Sphk1的表达, 抑制细胞生长, 促进细胞的凋亡, 并抑制细胞的侵袭. Sphk1激活组、对照组、抑制组的细胞凋亡率分别是9.15%, 16.25%, 32.58%. 与对照组相比, Sphk1激活组、抑制组的细胞相对侵袭率分别是190.57%, 9.65%, 差异有统计学意义(均P<0.01). PMA诱导Sphk1表达, 同时伴有ERK1/2、p-ERK1/2和NF-kB p65蛋白表达的上调, DMS抑制Sphk1表达, 可抑制ERK1/2、p-ERK1/2、NF-kB p65蛋白的表达.
结论: Sphk1可促进Lovo细胞的生长增殖与侵袭并抑制细胞的凋亡, 其机制可能与ERK1/2和NF-kB信号通路的激活有关.
引文著录: 钟月圆, 黄杰安, 刘诗权, 覃蒙斌, 金卉. Sphk1对人结肠癌细胞株Lovo增殖与侵袭的影响及其作用机制. 世界华人消化杂志 2010; 18(24): 2528-2532
Revised: July 5, 2010
Accepted: July 21, 2010
Published online: August 28, 2010
AIM: To investigate the role of sphingosine kinase 1 (Sphk1) in the proliferation, apoptosis and invasion of colon cancer cells.
METHODS: Human colon cancer Lovo cells were divided into three groups: Sphk1 activation group [treated with 100 nmol/L phorbol 12-myristate 13-acetate (PMA)], Sphk1 suppression group [treated with 50 mmol/L N,N-dimethyl-D-erythro-sphingosine (DMS)], and control group (treated with 9 g/L NaCl). Cell proliferation activity was detected by MTT assay; cell apoptosis was detected by flow cytometry; cell invasion was detected by Transwell chamber assay; and the protein expression of Sphk1, ERK1/2, p-ERK1/2, and NF-kB p65 was detected by Western blot.
RESULTS: PMA significantly induced the expression of Sphk1 protein, promoted Lovo cell growth and invasion, inhibited cell apoptosis, and up-regulated the protein expression of ERK1/2, p-ERK1/2, and NF-kB p65. In contrast, DMS significantly inhibited the expression of Sphk1 protein, suppressed cell growth, promoted apoptosis, and down-regulated the protein expression of ERK1/2, p-ERK1/2, and NF-kB p65. The apoptosis rates in the Sphk1 activation group, Sphk1 suppression group and control group were 9.15%, 16.25% and 32.58%, respectively. The relative invasion rate in the Sphk1 activation group was significantly higher than that in the Sphk1 suppression group (190.57% vs 9.65%, P < 0.01).
CONCLUSION: Sphk1 promotes the proliferation and invasion but inhibits apoptosis of Lovo cells possibly via a mechanism associated with the activation of ERK1/2 and NF-kB signaling pathways.
- Citation: Zhong YY, Huang JA, Liu SQ, Qin MB, Jin H. Role of Sphk1 in the proliferation and invasion of human colon cancer Lovo cells. Shijie Huaren Xiaohua Zazhi 2010; 18(24): 2528-2532
- URL: https://www.wjgnet.com/1009-3079/full/v18/i24/2528.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i24.2528
鞘氨醇激酶-1(sphingosine kinase 1, Sphk1)是鞘脂代谢平衡的重要限速酶, Sphk1催化反应的产物1-磷酸鞘氨醇(sphingosine 1-phosphate, S1P)是一个同时具有细胞内第二信使和细胞外第一信使双重功能的脂类生物活性分子. Sphk1/S1P信号通路在调节细胞迁移、增殖、凋亡等过程中具有重要作用[1], 但Sphk1及其信号传导通路在结肠肿瘤中的作用及机制目前尚未阐明. 本研究通过化学方法调控Sphk1蛋白的表达, 观察Sphk1对结肠肿癌Lovo细胞的生长增殖、凋亡、侵袭及细胞外信号调节激酶(extracellular-signal regulated protein kinase, ERK1/2)、p-ERK1/2和NF-kB p65表达的影响, 以期明确Sphk1对人结肠癌细胞的增殖, 凋亡及侵袭的影响并探讨其机制, 为结肠癌的防治提供理论依据.
人结肠癌细胞株Lovo购自南京凯基生物科技发展有限公司; 胎牛血清购自杭州四季青生物工程材料有限公司; DMEM(高糖型)购自Invitrogen公司, PBS购自福州迈新生物技术开发有限公司; 细胞培养瓶及Transwell均购自Corning Costar公司; 佛波醇-12-豆蔻酸酯-13-乙酸酯(phorbol 12-myristate 13-acetate, PMA)购自Sigma-Aldrich公司; N, N-二甲基硝胺醇(erythro-sphingosine, N, N-Dimethyl-, DMS)购自Calbiochem公司; 四氮唑蓝购自北京索莱宝科技有限公司; Annexin V-FITC细胞凋亡检测试剂盒购自南京凯基生物科技发展有限公司; 蛋白提取试剂盒购自碧云天生物技术研究所; 鼠抗人Sphk1单克隆抗体购自Sigma-Aldrich公司, 兔抗人ERK1/2、p-ERK1/2多克隆抗体购自Cell Signaling Technology公司, 鼠抗人NF-kB p65多克隆抗体购自Santa Cruz, 辣根过氧化酶标记山羊抗鼠IgG2005、辣根过氧化酶标记山羊抗兔IgG2004均购自Santa Cruz.
1.2.1 细胞培养: 人结肠癌Lovo细胞置于含100 mL/L胎牛血清的DMEM培养基中, 37 ℃、50 mL/L CO2, 饱和湿度条件下培养.
1.2.2 MTT法测定Lovo细胞的增殖活性: 取对数生长期细胞制备细胞悬液, 调整细胞密度为2.5×104/mL, 接种至96孔板, 每孔200 mL(相当于5 000个细胞), 实验分3组: 空白对照组、Sphk1激活组和Sphk1抑制组, 每组重复3孔. 培养12 h后细胞贴壁后, Sphk1激活组加终浓度为100 nmol/L的PMA, Sphk1抑制组加终浓度为50 mmol/L的DMS. 作用后24 h后每孔加入MTT 20 mL(5 g/L), 继续培养4 h, 弃上清, 加入DMSO 150 mL, 上酶标仪, 以570 nm波长处测定吸光度(A)值, 以空白试剂为对照, 分析数据. 重复实验3次.
1.2.3 流式细胞术检测细胞凋亡率: 细胞处理同上, 干预24 h后用不含EDTA的胰酶消化收集细胞, 然后用PBS洗涤细胞2次(2 000 r/min离心5 min), 收集5×105细胞, 加入500 mL Binding Buffer悬浮细胞, 加入5 mL Annexin V-FITC混匀后, 加入5 mL 碘化丙啶(propidium iodide, PI), 混匀, 室温避光反应10 min, 1 h内进行流式细胞仪的观察和检测. 使用未经凋亡诱导处理的空白对照组的细胞进行荧光补偿调节去除光谱重叠和设定十字门的位置.
1.2.4 侵袭实验: 处理同上, 作用后24 h后用0.25%的胰酶消化细胞, 并用1%的含血清培养基洗涤细胞2次, 制备细胞悬液, 调整细胞密度为5×105/mL, 取200 mL细胞悬液种于铺好了Matrigel胶的Transwell内室中, 外室注入培养基. 24 h后倒置Transwell小室, 滤膜下表面朝上, 自然风干, 结晶紫染色, 再次倒置Transwell小室, 自然风干, 刀片取下滤膜置于载玻片上, 滴中性树脂, 盖上盖玻片. 显微镜计算3个视野中的细胞取平均值, 以空白试剂为对照, 分析数据. 重复实验3次.
1.2.5 Western blot检测: 将人结肠癌Lovo细胞接种于直径为6 cm的细胞培养皿中, 接种细胞密度为3×106/mL, 实验分组及细胞药物处理同上. 作用24 h后收集细胞, 按照每20 mL细胞沉淀加200 mL已添加了PMSF的细胞质蛋白抽提试剂, 冰浴15 min, 4 ℃ 12 000 r/min离心15 min, 上清即为抽提到的细胞质蛋白. 余沉淀用滤纸吸尽残余液体, 加入50 mL添加了PMSF的细胞核蛋白抽提试剂, 冰浴30 min, 4 ℃ 12 000 r/min离心20 min, 收集上清, 即为抽提到的细胞核蛋白. Bradford法测定蛋白浓度, 将5×SDS-PAGE蛋白上样缓冲液加入蛋白中煮沸变性. 取适量(60 mg)蛋白于SDS-PAGE分离后转至PVDF膜, 用5%的脱脂奶粉封闭1 h, 根据抗体说明书稀释抗体(Sphk1 1:500, ERK1/2 1:1 000, p-ERK1/2 1:1 000, NF-kB p65 1:800), 孵一抗(4 ℃, 摇床, 过夜), 根据抗体说明书稀释二抗(Sphk1、ERK1/2、p-ERK1/2、NF-kB p65对应的二抗稀释倍数分别是: 1:3 000, 1:4 000, 1:4 000, 1:3 000), 孵二抗(1 h, 摇床), ECL显影. 重复实验3次. 显影结果采用quanty-one分析软件进行图像分析.
统计学处理 采用单因素方差分析方法, 用SPSS11.5统计软件进行处理, 各实验结果以mean±SD表示, P<0.05表示具有显著性差异.
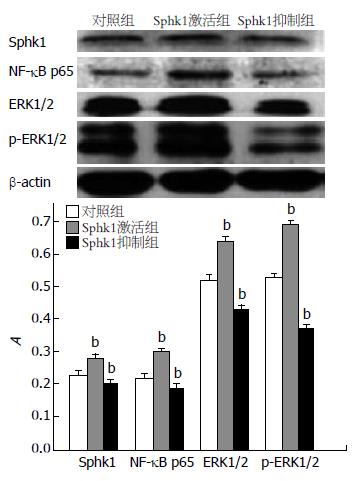
结肠癌Lovo细胞Sphk1在Western blot中显示一条明显的分子条带, 相对分子质量为44 000 Da. PMA可明显增加Sphk1的表达, 而DMS可明显抑制Sphk1蛋白的表达(图1). 增强Sphk1的活性, ERK1/2、p-ERK1/2蛋白表达上调, 相反, 抑制Sphk1的活性, ERK1/2、p-ERK1/2蛋白表达下调. ERK1/2、p-ERK1/2蛋白的表达在Sphk1激活组、对照组、抑制组逐渐减弱, 各组间差别均有显著性(均P<0.05). Sphk1的活性亦与NF-kB p65蛋白表达呈正相关, 增强Sphk1的活性, NF-kB p65蛋白表达上调, 相反, 抑制Sphk1的活性, NF-kB p65蛋白表达下调. NF-kB p65蛋白的表达在Sphk1激活组、对照组、抑制组逐渐减弱, 各组间差别均有显著性(P<0.05, 图1).
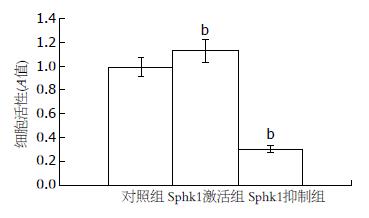
Sphk1激活剂PMA具有促进Lovo细胞生长增殖的作用, 相反, Sphk1抑制剂DMS可抑制Lovo细胞生长增殖(图2).
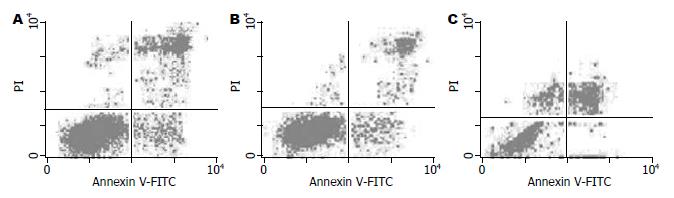
PMA显著抑制细胞凋亡率(P<0.01), 而DMS明显促进细胞凋亡(P<0.01, 图3). Sphk1激活组、对照组、抑制组的细胞凋亡率分别是9.15%, 16.25%, 32.58%.
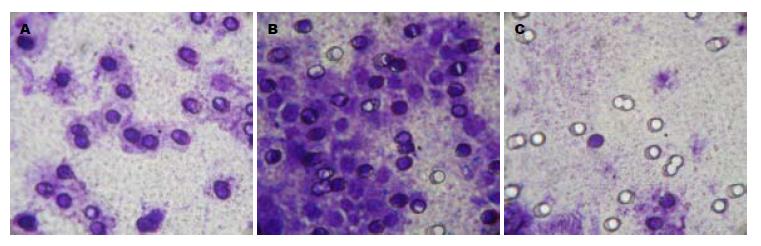
PMA显著促进细胞侵袭, 而DMS则明显抑制细胞侵袭. 与对照组相比Sphk1激活组、抑制组的细胞相对侵袭率分别是190.57%, 9.65%, 差异有统计学意义(均P<0.01, 图4).
现有资料表明, Sphk1在多种肿瘤包括结肠癌和胃癌[2]的表达增高, 他参与肿瘤的发生发展, 但其机制及信号传导通路目前尚不明确. Sphk1已被认为是一种潜在靶向治疗目标[3]. 有研究报道[4]PMA刺激Sphk1聚集在质膜脂质筏微区(plasma membrane lipid raft microdomain)从而导致Sphk1代谢产物S1P增多, 进而促进细胞生长. Koda等[5]报道Sphk1通过MEK/ERK信号通路参与双丁酰环磷酰苷(dibutyryl cyclic AMP, dbcAMP)诱导的HL60细胞增殖. 而应用多西他塞抑制Sphk1活性后可以促进前列腺癌细胞的凋亡[6]. 同时, Sphk1抑制剂SK1-Ⅰ通过抑制AKT磷酸化, 导致胶质母细胞瘤细胞生长受抑制, 引起细胞凋亡[7]. 我们检测了不同Sphk1活性调节剂对人结肠癌细胞株Lovo的影响, MTT检测结果与流式细胞术检测结果发现PMA能促进细胞增殖, 而DMS则促进细胞凋亡. 初步证实Sphk1具有促进细胞增殖作用. 在我们随后的研究中, Sphk1调节剂干预Lovo后, 与对照组比较, Sphk1激活组的Sphk1、ERK与p-ERK1/2的蛋白表达量明显增多, Sphk1抑制组的Sphk1、ERK与p-ERK1/2的蛋白表达量则减少. 我们推断Sphk1可能通过促进ERK1/2表达与活化而发挥促增殖的作用. 这是因为丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)途径是调节细胞生长增殖最重要的细胞通路, MAPK家族有3个主要亚型: ERK1/2, JNK(c-Jun amino-terminal kinase), p38 MAPK, 虽然这些激酶有60%-70%的同源性, 但他们受不同的刺激, 激活不同的活性部位, 发挥不同的生物学功能. 一般来说, ERK1/2受有丝分裂刺激因子及生长因子激活, 与细胞增殖相关[8]. 其中Ras/Raf/MEK/ERK通路与肿瘤细胞增殖的关系密切, 此信号通路被激活后, ERK1/2被磷酸化成p-ERK1/2, 转位至细胞核, 作用于转录因子(如NF-kB, c-Myc等), 调控基因的表达从而产生不同的作用[9]. 据McCubrey等报道[10]使用MEK抑制剂抑制该信号通路后, 肿瘤细胞增殖受到抑制, 促进肿瘤细胞凋亡, 如Matsui等[11]用MEK抑制剂JTP-70902作用人纤维肉瘤细胞后, 纤维肉瘤细胞生长增殖受到抑制并停留在G1/S期. 同时, 有报道[12]称血管活性肠肽激动剂VIP-DAP3(g-glutamyl l6-diaminopropane derivative of vasoactive intestinal peptide)在拮抗氧化作用中通过激活ERK1/2及AKT信号通路来促进非小细胞肺癌细胞增殖及生长. 而NF-kB p65作为一种转录因子, 其C末端有一转录激活区域, 这一结构是NF-kB p65参与基因转录的基本结构. 而异常活化的NF-kB p65与人类的诸多肿瘤有关, 其中抗凋亡作用在肿瘤治疗中降低了许多药物治疗的作用[13]. 本研究中Western blot检测结果发现与对照组比较, 在Sphk1激活组NF-kB p65蛋白表达量明显增多, 而Sphk1抑制组表达量减少. 我们认为在人结肠癌细胞株Lovo中Sphk1可能通过促进NF-kB p65蛋白的表达, 而发挥促增殖的作用. 其机制可能是NF-kB信号通路在肿瘤细胞中抑制细胞凋亡、促进细胞增殖[14]. 有学者[15]报道在鼠结肠肿瘤中虾青素通过抑制ERK2、NF-kB、AKT引起细胞凋亡.
另外, Sphk1催化反应产物S1P通过其5种G蛋白偶联受体在肿瘤细胞侵袭、迁移中发挥作用[16]. 在体外实验中发现Sphk1受转化生长因子b(transforming growth factor b, TGF-b)受体刺激后, S1P生成增多, 进一步地激活ERK1/2, 促进食管肿瘤细胞侵袭与迁移[17]. 我们研究发现在用不同活性的Sphk1调节剂处理细胞24 h后, 采用Transwell侵袭实验检测细胞侵袭力, 结果发现, 与对照组相比Sphk1激活组的侵袭力明显增强, 而Sphk1抑制组侵袭力下降. 其机制也可能与NF-kB在肿瘤发展中调节与侵袭相关因子(如基质金属蛋白酶)转录发挥其作用[18]有关.
总之, 我们在应用化学干预方法调控Sphk1的活性, 观察Sphk1对结肠癌细胞株Lovo的生长增殖, 凋亡及侵袭作用的研究中, 发现在人结肠肿瘤细胞株Lovo中, Sphk1通过提高ERK1/2蛋白表达, 促进ERK1/2磷酸化成p-ERK1/2, 促进NF-kB p65蛋白的表达参与, 促进Lovo细胞增殖, 减少细胞凋亡, 促进细胞侵袭.
Sphk1催化反应的产物1-磷酸鞘氨醇(S1P)是一个同时具有细胞内第二信使和细胞外第一信使双重功能的脂类生物活性分子. Sphk1/S1P信号通路在调节细胞迁移、增殖、凋亡等过程中具有重要作用, 但Sphk1及其信号传导通路在结肠肿瘤中的作用及机制目前尚未阐明.
张国梁, 主任医师, 天津市第一中心医院消化内科
现有资料表明, Sphk1在多种肿瘤包括结肠癌和胃癌的表达增高, 他参与肿瘤的发生发展, 但其机制及信号传导通路目前尚不明确.
Koda等报道Sphk1通过MEK/ERK信号通路参与双丁酰环磷酰苷(dbcAMP)诱导的HL60细胞增殖. 而应用多西他塞抑制Sphk1活性后可以促进前列腺癌细胞的凋亡.
本研究通过化学方法调控Sphk1蛋白的表达, 观察Sphk1对结肠肿癌Lovo细胞的生长增殖、凋亡、侵袭及ERK1/2、p-ERK1/2和NF-κB p65表达的影响, 以期明确Sphk1对人结肠癌细胞的增殖与凋亡及侵袭的影响并探讨其机制, 为结肠癌的防治提供理论依据.
本文观点新颖, 结果可靠, 分析有深度, 具有一定的临床实用价值.
编辑: 李军亮 电编:何基才
| 1. | Spiegel S, Milstien S. Sphingosine-1-phosphate: an enigmatic signalling lipid. Nat Rev Mol Cell Biol. 2003;4:397-407. [PubMed] [DOI] |
| 2. | French KJ, Schrecengost RS, Lee BD, Zhuang Y, Smith SN, Eberly JL, Yun JK, Smith CD. Discovery and evaluation of inhibitors of human sphingosine kinase. Cancer Res. 2003;63:5962-5969. [PubMed] |
| 3. | Cuvillier O. Sphingosine kinase-1--a potential therapeutic target in cancer. Anticancer Drugs. 2007;18:105-110. [PubMed] [DOI] |
| 4. | Hengst JA, Guilford JM, Fox TE, Wang X, Conroy EJ, Yun JK. Sphingosine kinase 1 localized to the plasma membrane lipid raft microdomain overcomes serum deprivation induced growth inhibition. Arch Biochem Biophys. 2009;492:62-73. [PubMed] [DOI] |
| 5. | Koda M, Murate T, Wang S, Ohguchi K, Sobue S, Ikeda M, Tamiya-Koizumi K, Igarashi Y, Nozawa Y, Banno Y. Sphingosine kinase 1 is involved in dibutyryl cyclic AMP-induced granulocytic differentiation through the upregulation of extracellular signal-regulated kinase, but not p38 MAP kinase, in HL60 cells. Biochim Biophys Acta. 2005;1733:101-110. [PubMed] |
| 6. | Sauer L, Nunes J, Salunkhe V, Skalska L, Kohama T, Cuvillier O, Waxman J, Pchejetski D. Sphingosine kinase 1 inhibition sensitizes hormone-resistant prostate cancer to docetaxel. Int J Cancer. 2009;125:2728-2736. [PubMed] [DOI] |
| 7. | Kapitonov D, Allegood JC, Mitchell C, Hait NC, Almenara JA, Adams JK, Zipkin RE, Dent P, Kordula T, Milstien S. Targeting sphingosine kinase 1 inhibits Akt signaling, induces apoptosis, and suppresses growth of human glioblastoma cells and xenografts. Cancer Res. 2009;69:6915-6923. [PubMed] [DOI] |
| 8. | Kyriakis JM, Avruch J. Mammalian mitogen-activated protein kinase signal transduction pathways activated by stress and inflammation. Physiol Rev. 2001;81:807-869. [PubMed] |
| 9. | Steelman LS, Pohnert SC, Shelton JG, Franklin RA, Bertrand FE, McCubrey JA. JAK/STAT, Raf/MEK/ERK, PI3K/Akt and BCR-ABL in cell cycle progression and leukemogenesis. Leukemia. 2004;18:189-218. [PubMed] [DOI] |
| 10. | McCubrey JA, Steelman LS, Abrams SL, Chappell WH, Russo S, Ove R, Milella M, Tafuri A, Lunghi P, Bonati A. Emerging MEK inhibitors. Expert Opin Emerg Drugs. 2010;15:203-223. [PubMed] [DOI] |
| 11. | Matsui TA, Murata H, Sowa Y, Sakabe T, Koto K, Horie N, Tsuji Y, Sakai T, Kubo T. A novel MEK1/2 inhibitor induces G1/S cell cycle arrest in human fibrosarcoma cells. Oncol Rep. 2010;24:329-333. [PubMed] |
| 12. | Stiuso P, Giuberti G, Lombardi A, Dicitore A, Limongelli V, Cartenì M, Abbruzzese A, Caraglia M. Gamma-glutamyl 16- diaminopropane derivative of vasoactive intestinal peptide: a potent anti-oxidative agent for human epidermoid cancer cells. Amino Acids. 2010;39:661-670. [PubMed] [DOI] |
| 13. | Baldwin AS. Control of oncogenesis and cancer therapy resistance by the transcription factor NF-kappaB. J Clin Invest. 2001;107:241-246. [PubMed] [DOI] |
| 14. | Orlowski RZ, Baldwin AS Jr. NF-kappaB as a therapeutic target in cancer. Trends Mol Med. 2002;8:385-389. [PubMed] [DOI] |
| 15. | Nagendraprabhu P, Sudhandiran G. Astaxanthin inhibits tumor invasion by decreasing extracellular matrix production and induces apoptosis in experimental rat colon carcinogenesis by modulating the expressions of ERK-2, NFkB and COX-2. Invest New Drugs. 2009; Oct 30. [Epub ahead of print]. [PubMed] |
| 16. | Shida D, Takabe K, Kapitonov D, Milstien S, Spiegel S. Targeting SphK1 as a new strategy against cancer. Curr Drug Targets. 2008;9:662-673. [PubMed] [DOI] |
| 17. | Miller AV, Alvarez SE, Spiegel S, Lebman DA. Sphingosine kinases and sphingosine-1-phosphate are critical for transforming growth factor beta-induced extracellular signal-regulated kinase 1 and 2 activation and promotion of migration and invasion of esophageal cancer cells. Mol Cell Biol. 2008;28:4142-4151. [PubMed] [DOI] |
| 18. | Aggarwal BB. Nuclear factor-kappaB: the enemy within. Cancer Cell. 2004;6:203-208. [PubMed] [DOI] |