修回日期: 2010-07-07
接受日期: 2010-07-12
在线出版日期: 2010-08-28
目的: 探讨低氧条件下三氧化二砷(As2O3)对人肝癌细胞株HepG2增殖、凋亡及HIF-1α表达的影响.
方法: 用氯化钴(CoCl2)创造低氧条件, 取1.0、2.0、4.0、8.0 µmol/L的As2O3分别在常氧和低氧条件下作用于HepG2细胞12、24和48 h后, MTT法检测细胞活力, Hoechst染色法检测细胞凋亡. 设常氧对照组、低氧对照组、低氧下不同浓度As2O3(4.0、8.0 µmol/L)组, 用免疫细胞化学法观察不同浓度As2O3作用于HepG2细胞48 h后HIF-1α蛋白表达的变化.
结果: MTT法和Hoechst染色法分别显示, 在常氧和低氧两种条件下, As2O3均呈时间剂量依赖性地抑制和诱导HepG2细胞增殖和凋亡(均P<0.01), 8.0 µmol/L As2O3作用HepG2细胞48 h后其抑制率和凋亡率分别为38.40%, 37.83%和45.25%, 49.28%. 在常氧和低氧两种条件下, HepG2细胞生长抑制率及凋亡率的差异均无统计学意义. 免疫细胞化学法显示, 常氧条件下HIF-1α蛋白呈弱阳性表达, 低氧诱导48 h后HIF-1α蛋白表达显著升高(t = 114.37, P<0.05), 低氧条件下HIF-1α蛋白表达随As2O3浓度的增加而逐渐降低(F = 347.042, P<0.01).
结论: 低氧条件下, As2O3能抑制HepG2细胞增殖并诱导其凋亡, 其机制可能与As2O3下调HIF-1α的表达有关.
引文著录: 夏德涛, 张栋, 肖伟玲. 三氧化二砷在低氧下对人肝癌细胞株HepG2增殖、凋亡及HIF-1α表达的影响. 世界华人消化杂志 2010; 18(24): 2515-2520
Revised: July 7, 2010
Accepted: July 12, 2010
Published online: August 28, 2010
AIM: To investigate the effects of arsenic trioxide (As2O3) on cell proliferation, apoptosis and hypoxia-inducible factor-1α (HIF-1α) expression in human liver cancer HepG2 cells cultured under hypoxic conditions.
METHODS: Hypoxia was induced with cobalt chloride (CoCl2). After HepG2 cells were incubated with different concentrations of As2O3 (1.0, 2.0, 4.0 and 8.0 µmol/L) for 12, 24 and 48 h under hypoxic conditions, cell proliferation was determined by MTT assay, and cell apoptosis was evaluated by Hoechst staining. HepG2 cells were then divided into three groups: normal control group, hypoxia group, and As2O3 treatment group. After HepG2 cells were incubated with As2O3 at concentrations of 4.0 and 8.0 µmol/L for 48 h under hypoxia, the expression of HIF-1α protein was detected by immunocytochemistry.
RESULTS: As2O3 inhibited proliferation but induced apoptosis of HepG2 cells in a dose- and time-dependent manner under both normoxic and hypoxic conditions (both P < 0.01). No significant differences were noted in the reduced proliferation rates of cell proliferation (38.40% vs 37.83%, P > 0.05) and apoptosis rates (45.25% vs 49.28%, P > 0.05) between HepG2 cells treated with 8.0 µmol/L As2O3 for 48 h under normoxic and hypoxic conditions. Immunocytochemistry analysis revealed that HIF-1α was weakly expressed in HepG2 cells under normoxia. After hypoxic induction for 48 h, HIF-1α expression was significantly up-regulated (t = 114.37, P < 0.05). The expression of HIF-1α protein gradually decreased with the increase in the concentration of As2O3 under hypoxia (F = 347.042, P < 0.01).
CONCLUSION: As2O3 can inhibit proliferation but induce apoptosis of HepG2 cells under hypoxia possibly by down-regulating HIF-1α protein expression.
- Citation: Xia DT, Zhang D, Xiao WL. Effects of arsenic trioxide on cell proliferation, apoptosis and HIF-1α expression in human liver cancer HepG2 cells cultured under hypoxic conditions. Shijie Huaren Xiaohua Zazhi 2010; 18(24): 2515-2520
- URL: https://www.wjgnet.com/1009-3079/full/v18/i24/2515.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i24.2515
研究已经证实, 肿瘤内存在低氧微环境[1,2]. 低氧微环境导致多种实质性肿瘤包括肝癌发生一系列生物学效应, 使肿瘤细胞发生一系列适应性变化, 如促进肿瘤血管生成、增强无氧糖酵解、凋亡耐受等[3], 而低氧诱导因子-1α(hypoxia inducible factor-1 alpha, HIF-1α)是肿瘤低氧应答的关键因子, HIF-1α与肿瘤血管生成、化疗抵抗、无氧糖酵解及恶性演进、浸润转移等密切相关[4-7]. 大量研究表明, 低氧微环境是导致肿瘤细胞对化疗药物产生抵抗的重要原因[4-7]. 因此, 寻找低氧条件下仍然有效的抗肿瘤药物成为目前研究的热点[8]. 三氧化二砷(arsenic trioxide, As2O3)是砒霜的主要成分之一, 最初被用于急性早幼粒细胞白血病的治疗, 随后发现其对胃癌、肺癌、肝癌等多种实体瘤具有明显的杀伤作用[9-11]. 近年来研究表明, As2O3在低氧条件下能诱导肺癌细胞、急性早幼粒白血病等一些肿瘤细胞发生凋亡[12,13], 但其对低氧条件下肝癌细胞的作用及相关机制有待进一步探讨. 为此, 我们以经典的化学缺氧剂CoCl2模拟低氧微环境, 分别在常氧和低氧条件下观察了不同浓度As2O3对人肝癌细胞HepG2增殖、凋亡的影响, 探讨其与HIF-1α蛋白表达的关系.
人肝癌细胞株HepG2购自山东省医学科学院. As2O3注射液购自黑龙江哈尔滨医大药业有限公司. Hoechst32258荧光染色试剂盒及CoCl2购于美国Sigma公司. DMEM培养基及甲基噻唑基四唑(MTT)购自美国Gibco公司. 胎牛血清(杭州四季青)、PV-9000免疫组织化学试剂盒及鼠抗人HIF-1α单克隆抗体购自北京中杉金桥生物技术有限公司.
1.2.1 细胞培养: 取指数生长期的人肝癌细胞株HepG2接种于含100 mL/L胎牛血清、青霉素、链霉素各1×105 U/L的DMEM培养液中, 置于37 ℃, 50 mL/L CO2培养箱内常规传代培养.
1.2.2 低氧培养条件: 预先在常氧条件下培养, 待细胞贴壁进入对数生长期后加入化学缺氧剂CoCl2, 其终浓度为150 μmol/L, 置于37 ℃, 50 mL/L CO2培养箱内常规传代培养.
1.2.3 MTT法检测HepG2细胞增殖抑制率: 分别观察常氧和低氧条件下不同浓度As2O3对人肝癌细胞株HepG2增殖抑制的影响. 取对数生长期的人肝癌HepG2细胞, 按照3×107/L的密度接种于96孔培养板, 每孔体积为200 μL. 待细胞贴壁后分别加入As2O3(终浓度1.0、2.0、4.0、8.0 μmol/L), 并设阴性对照组(细胞正常生长组), 每个浓度组设5个复孔, 四周加入不含药物的细胞培养液为空白对照. 分别在常氧和低氧条件下培养至12、24和48 h后, 每孔加入5 g/L的MTT溶液20 μL, 继续培养4 h, 吸出培养液, 每孔加入DMSO 150 μL, 振荡10 min, 在酶标仪上以490 nm波长测每孔的吸光度A值, 并取5孔的平均值. 实验重复3次, 计算细胞生长抑制率. 细胞生长抑制率 = (对照孔A值-实验孔A值)/对照孔A值×100%.
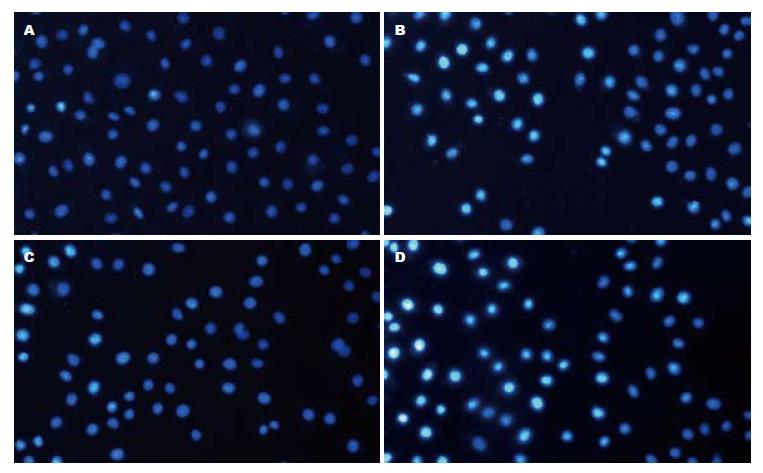
1.2.4 Hoechst染色法检测HepG2细胞凋亡率: 分别观察常氧和低氧条件下不同浓度As2O3对人肝癌细胞株HepG2凋亡的影响. 取对数生长期的HepG2细胞制成2×108/L的细胞悬液, 每孔0.5 mL, 加入放有盖玻片的24孔板内. 待细胞贴壁后分别加入As2O3(终浓度1.0、2.0、4.0、8.0 μmol/L), 并设阴性对照组(细胞正常生长组), 每个浓度组设5个复孔, 分别在常氧及低氧条件下培养12、24、48 h后, 取出细胞爬片, 甲醇/冰醋酸固定液固定5 min后, 加入荧光染液Hoechst33258重悬细胞, 室温避光l h, PBS冲洗, 用抗荧光液封片. 然后置于BH-2型荧光显微镜下, 采用激发波长350 nm, 发射波长460 nm镜检. 判定标准: 正常细胞核为蓝色, 凋亡的细胞核为白色. 每片连续观察10个细胞分布均匀的200倍镜视野, 每视野计数50个细胞, 共500个细胞, 计算其阳性率百分数, 并取其均值. 凋亡率 = 凋亡细胞数/(正常细胞数+凋亡细胞数).
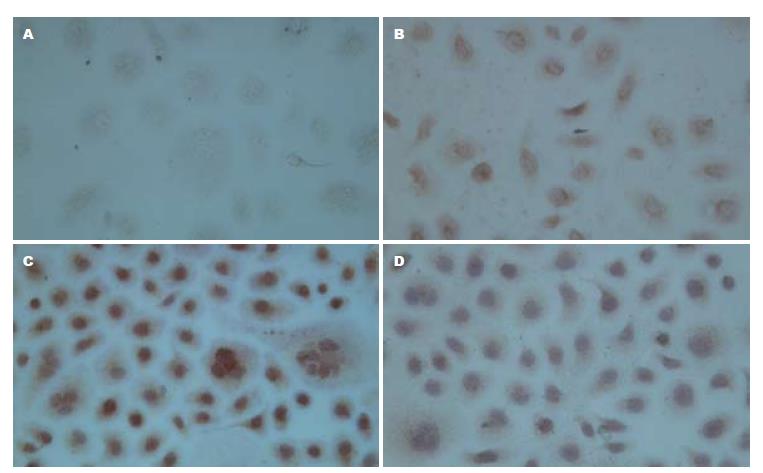
1.2.3 免疫细胞化学两步法观察低氧条件下HepG2细胞HIF-1α的表达: 取对数生长期的HepG2细胞制成2×108/L的细胞悬液, 每孔0.5 mL, 加入放有盖玻片的24孔板内, 设常氧对照组、低氧对照组和低氧下不同浓度As2O3组, 待细胞贴壁后分别加入CoCl2和As2O3(终浓度4.0、8.0 μmol/L), 48 h后取出细胞爬片, 冷丙酮固定5 min, PBS冲洗, 按PV-9000试剂盒步骤检测HIF-1α, DAB显色, 脱水, 透明, 中性树胶封片. 用已知阳性的乳腺癌切片作为阳性对照, 以PBS代替一抗作为阴性对照. 结果判定: 细胞核内出现棕黄色颗粒判定HIF-1α为阳性. 采用HPAIS-1000高清晰度彩色病理图文分析系统, 检测HIF-1α蛋白阳性细胞的平均A值, 以间接反映HIF-1α阳性蛋白的表达量, 并取其均值.
统计学处理 实验数据用mean±SD表示, 数据均用统计软件SPSS16.0分析, 组间比较用t检验和单因素方差分析, 两变量间用Pearson直线相关分析, P<0.05为有统计学意义.
不同浓度As2O3在常氧和低氧条件下作用于HepG2细胞12、24和48 h后, 均呈时间剂量依赖性地抑制HepG2细胞增殖(常氧下F = 119.527, 218.732, 364.612, 低氧下F = 283.116, 341.629, 514.721, 均P<0.01), 在常氧和低氧条件下8.0 μmol/L As2O3作用HepG2细胞48 h后其增殖抑制率分别为38.40%和37.83%. 对照组内各时间点HepG2细胞增殖抑制率均无显著差异. HepG2细胞增值抑制率在相同作用时间、相同处理浓度, 但在常氧和低氧两种条件下的差异无统计学意义(表1).
| As2O3(μmol/L) | 12 h | 24 h | 48 h | ||||||
| 常氧条件 | 低氧条件 | 常氧条件 | 低氧条件 | 常氧条件 | 低氧条件 | ||||
| 对照组 | 2.85±1.13 | 2.92±1.08 | 2.83±1.02 | 2.94±1.17 | 2.92±1.14 | 2.89±1.03 | |||
| 1.0 | 5.75±4.23b | 5.82±2.11b | 9.23±2.46bd | 9.46±1.52bd | 16.73±1.26bd | 17.03±1.04bd | |||
| 2.0 | 9.57±3.16b | 9.71±3.21b | 18.33±1.37bd | 17.96±2.11bd | 26.35±3.14bd | 27.13±2.46bd | |||
| 4.0 | 16.19±4.02b | 16.32±5.13b | 24.14±2.18bd | 24.36±3.02bd | 31.63±2.77bd | 32.04±1.76bd | |||
| 8.0 | 22.01±1.82b | 21.89±1.79b | 28.26±2.71bd | 28.69±2.43bd | 38.40±3.25bd | 37.83±3.46bd | |||
不同浓度As2O3在常氧和低氧条件下作用于HepG2细胞12、24和48 h后, 均呈时间剂量依赖性地促进HepG2细胞凋亡(常氧下F = 382.429, 469.517, 719.262, 低氧下F = 457.323, 639.216, 882.541, 均P<0.01), 8.0 µmol/L As2O3作用HepG2细胞48 h后其凋亡率分别为45.25%和49.28%. 对照组内各时间点HepG2细胞凋亡率均无显著差异. HepG2细胞凋亡率在相同作用时间、相同处理浓度, 但在常氧和低氧两种条件下的差异无统计学意义(表2, 图1).
| As2O3(μmol/L) | 12 h | 24 h | 48 h | ||||||
| 常氧条件 | 低氧条件 | 常氧条件 | 低氧条件 | 常氧条件 | 低氧条件 | ||||
| 对照组 | 1.04±0.11 | 2.08±0.47 | 1.32±0.21 | 2.11±0.17 | 1.24±0.14 | 2.32±0.12 | |||
| 1.0 | 4.85±0.53b | 6.51±0.36b | 8.93±1.31bd | 12.37±0.87bd | 12.41±1.16bd | 17.58±1.21bd | |||
| 2.0 | 6.73±0.75b | 10.69±0.93b | 15.12±1.48bd | 18.75±0.94bd | 20.50±2.31bd | 24.86±1.73bd | |||
| 4.0 | 12.79±1.23b | 15.13±1.21b | 20.36±2.41bd | 24.13±1.64bd | 29.22±2.42bd | 32.31±2.05bd | |||
| 8.0 | 23.26±1.62b | 25.45±1.23b | 27.39±2.56bd | 31.18±2.21bd | 45.25±1.18bd | 49.28±1.46bd | |||
常氧条件下HIF-1α蛋白呈弱阳性表达, 加入CoCl2创造低氧条件诱导48 h后HIF-1α蛋白表达显著升高(t = 114.37, P<0.05), 低氧条件下4.0、8.0 µmol/L As2O3作用细胞48 h后, HIF-1α蛋白表达随As2O3浓度的增加而逐渐降低, 与低氧对照组比较有统计学意义(0.546±0.028, 0.395±0.017 vs 0.773±0.047, F = 347.042, 均P<0.01, 图2).
低氧微环境是多种实质性肿瘤包括肝癌在内的共同特征, 其缺氧主要是由于肿瘤细胞生长失控, 而血管生长却相对滞后, 致使耗氧量超过了微血管所能提供的氧量, 从而导致肿瘤内低氧微环境的形成[14]. 低氧微环境可使肿瘤基因组和蛋白质组不稳定, 导致介导肿瘤细胞的恶性筛选出现化疗耐受, 进而浸润转移[3]. 而低氧诱导HIF-1α表达与肿瘤的血管生成、凋亡耐受、化疗抵抗及侵袭转移等方面密切相关[4-7]. 低氧微环境是肿瘤细胞对多种化疗药物如氟尿嘧啶、阿霉素等产生抵抗性的重要原因[15,16], Tan等[17]体外实验发现, 低氧可降低SW480细胞对氟尿嘧啶的敏感性, 其机制可能与上调HIF-1α、血红素氧合酶-1表达有关. 因此, 寻找以HIF-1α为靶点的、低氧下仍然有效的抗肿瘤药物成为国内外研究的热点[8,18]. 研究发现, As2O3对胃癌、肺癌、肝癌等多种实体瘤具有明显的杀伤作用[9-11], 近年来研究表明, As2O3在低氧条件下能诱导肺癌细胞、急性早幼粒白血病等一些肿瘤细胞发生凋亡[12,13], 但其对低氧条件下肝癌细胞的作用及相关机制报道不多.
我们在常氧和低氧两种条件下系统地观察了不同浓度As2O3对HepG2细胞增殖、凋亡的影响及其与HIF-1α表达的关系. MTT实验发现: 在常氧和低氧两种条件下, As2O3均可呈剂量和时间依赖性地显著抑制HepG2细胞的增殖, 8.0 µmol/L As2O3作用HepG2细胞48 h后, 其抑制率分别为38.40%和37.83%, 常氧和低氧两种条件下细胞增殖抑制率的差异无统计学意义. 最近, Qu等[13]研究发现, As2O3可以在低氧环境下抑制人肺癌细胞生长并诱导其凋亡, 可能与阻滞细胞周期进程有关. 我们应用Hoechst染色法进一步观察, 结果显示在常氧和低氧两种条件下, 不同浓度As2O3均呈时间剂量依赖性促进HepG2细胞凋亡, 8.0 µmol/L As2O3作用HepG2细胞48 h后其凋亡率分别为45.25%和49.28%, 常氧和低氧条件下细胞凋亡率的差异无统计学意义. 上述结果表明, As2O3可以通过诱导细胞凋亡来发挥对HepG2细胞的杀伤作用, 这种作用不受低氧条件的影响. Pettersson等[11]发现, As2O3对小细胞肺癌有高度细胞毒性, 能诱导肺癌细胞发生凋亡, 但其具体机制有待深入研究. 刘晓川等[19]研究亦发现, 缺氧条件下As2O3能诱导人肝癌BEL-7402细胞发生凋亡, 其机制可能与As2O3下调HIF-1α、多药耐药基因的表达有关. HIF-1是低氧条件下产生的一种异源二聚体转录因子, 主要由HIF-1α和HIF-1β两个亚单位组成, 其中HIF-1α是主要的氧调节亚单位, 对HIF-1的活性起着关键作用. 许多研究表明, 低氧诱导HIF-1α表达使肿瘤细胞耐受凋亡[12,13]. 为此, 我们进一步应用免疫细胞化学法观察发现, 低氧下HIF-1α表达较常氧下明显升高(均P<0.05), 而As2O3呈剂量依赖性地抑制HIF-1α表达, 与低氧对照组比较有统计学意义(均P<0.01). 近年来, 许多研究亦发现, HIF-1α表达下调可增强抗肿瘤药物的杀伤作用[6,20]. Kung等[21]实验发现, 应用一种多肽阻断HIF-1α与p300/CREB的结合以阻遏HIF-1α的转录活性, 该多肽可以抑制结肠癌和乳腺癌移植瘤的生长. 研究发现, 低氧下As2O3能对急性早幼粒细胞白血病细胞产生生长抑制作用, 其中HIF-1α和维甲酸受体α发挥了重要作用[12]. 最近, 邢国辉等[22]研究发现, 在低氧环境下, 丹参酮ⅡA可增强5-氟尿嘧啶抑制SGC-7901细胞增殖及诱导凋亡作用, 可能与其抑制HIF-1α及突变型P53蛋白表达有关. 因此, 我们推测, 低氧条件下As2O3可能通过下调HIF-1α的表达诱导HepG2细胞的凋亡, 从而发挥对HepG2细胞的杀伤作用.
我们的研究结果提示, As2O3可能通过下调HIF-1α的表达诱导细胞凋亡来发挥对HepG2细胞的杀伤作用, 这种作用不受低氧条件的影响, 为其合理的运用于临床提供理论思路. 预示着As2O3在肝癌的治疗上有着广泛的前景, 其具体的作用机制有待进一步研究.
肿瘤低氧微环境是肿瘤化疗抵抗的重要原因, HIF-1α是重要的氧调节转录因子, 寻找以HIF-1α为靶点的、低氧下仍然有效的抗肿瘤药物成为国内外研究的热点. 三氧化二砷对多种实体瘤具有杀伤作用, 近年来研究发现, 三氧化二砷在低氧条件下能诱导肺癌细胞、急性早幼粒白血病等一些肿瘤细胞发生凋亡, 但其对低氧条件下肝癌细胞的作用及相关机制报道不多.
吴君, 主任医师, 贵阳医学院附属医院感染科
大量研究表明, 低氧微环境是导致肿瘤细胞对化疗药物产生抵抗的重要原因. 因此, 寻找低氧条件下仍然有效的抗肿瘤药物成为目前研究的热点.
本研究以经典的化学缺氧剂CoCl2模拟低氧微环境, 分别在常氧和低氧两种条件下观察不同浓度三氧化二砷对人肝癌细胞增殖、凋亡的影响, 并研究其与低氧下重要的分子标志物HIF-1α蛋白表达的关系, 这有望为肝癌的治疗提供合理的用药及科学的理论基础.
本研究发现, 在低氧条件下, 三氧化二砷仍具有抗肿瘤活性, 且与常氧条件下相比, 其抗肿瘤能力没有减弱, 这种作用可能与其抑制HIF-1α蛋白表达有关. 研究结果表明, 三氧化二砷作为一种对HIF-1α具有抑制作用的抑制剂, 在临床治疗中可作为一种重要的辅助化疗药物与化疗药物联用, 增强化疗药物的抗肿瘤能力.
本文设计合理, 为三氧化二砷将来应用于临床提供了一些数据, 有一定的实际应用价值.
编辑: 李军亮 电编:何基才
| 1. | Thomlinson RH, Gray LH. The histological structure of some human lung cancers and the possible implications for radiotherapy. Br J Cancer. 1955;9:539-549. [PubMed] |
| 2. | Graeber TG, Osmanian C, Jacks T, Housman DE, Koch CJ, Lowe SW, Giaccia AJ. Hypoxia-mediated selection of cells with diminished apoptotic potential in solid tumours. Nature. 1996;379:88-91. [PubMed] [DOI] |
| 3. | Zhou J, Schmid T, Schnitzer S, Brüne B. Tumor hypoxia and cancer progression. Cancer Lett. 2006;237:10-21. [PubMed] [DOI] |
| 4. | Unruh A, Ressel A, Mohamed HG, Johnson RS, Nadrowitz R, Richter E, Katschinski DM, Wenger RH. The hypoxia-inducible factor-1 alpha is a negative factor for tumor therapy. Oncogene. 2003;22:3213-3220. [PubMed] [DOI] |
| 5. | Cosse JP, Michiels C. Tumour hypoxia affects the responsiveness of cancer cells to chemotherapy and promotes cancer progression. Anticancer Agents Med Chem. 2008;8:790-797. [PubMed] |
| 6. | Sermeus A, Cosse JP, Crespin M, Mainfroid V, de Longueville F, Ninane N, Raes M, Remacle J, Michiels C. Hypoxia induces protection against etoposide-induced apoptosis: molecular profiling of changes in gene expression and transcription factor activity. Mol Cancer. 2008;7:27. [PubMed] [DOI] |
| 7. | Hu Y, Kirito K, Yoshida K, Mitsumori T, Nakajima K, Nozaki Y, Hamanaka S, Nagashima T, Kunitama M, Sakoe K. Inhibition of hypoxia-inducible factor-1 function enhances the sensitivity of multiple myeloma cells to melphalan. Mol Cancer Ther. 2009;8:2329-2338. [PubMed] [DOI] |
| 8. | Wouters A, Pauwels B, Lardon F, Vermorken JB. Review: implications of in vitro research on the effect of radiotherapy and chemotherapy under hypoxic conditions. Oncologist. 2007;12:690-712. [PubMed] [DOI] |
| 9. | Dilda PJ, Hogg PJ. Arsenical-based cancer drugs. Cancer Treat Rev. 2007;33:542-564. [PubMed] [DOI] |
| 10. | Bangoura G, Yang LY, Huang GW, Wang W. Expression of HIF-2alpha/EPAS1 in hepatocellular carcinoma. World J Gastroenterol. 2004;10:525-530. [PubMed] |
| 11. | Pettersson HM, Pietras A, Munksgaard Persson M, Karlsson J, Johansson L, Shoshan MC, Påhlman S. Arsenic trioxide is highly cytotoxic to small cell lung carcinoma cells. Mol Cancer Ther. 2009;8:160-170. [PubMed] [DOI] |
| 12. | Yan H, Peng ZG, Wu YL, Jiang Y, Yu Y, Huang Y, Zhu YS, Zhao Q, Chen GQ. Hypoxia-simulating agents and selective stimulation of arsenic trioxide-induced growth arrest and cell differentiation in acute promyelocytic leukemic cells. Haematologica. 2005;90:1607-1616. [PubMed] |
| 13. | Qu GP, Xiu QY, Li B, Liu YA, Zhang LZ. Arsenic trioxide inhibits the growth of human lung cancer cell lines via cell cycle arrest and induction of apoptosis at both normoxia and hypoxia. Toxicol Ind Health. 2009;25:505-515. [PubMed] [DOI] |
| 14. | Dachs GU, Tozer GM. Hypoxia modulated gene expression: angiogenesis, metastasis and therapeutic exploitation. Eur J Cancer. 2000;36:1649-1660. [PubMed] [DOI] |
| 15. | Yoshiba S, Ito D, Nagumo T, Shirota T, Hatori M, Shintani S. Hypoxia induces resistance to 5-fluorouracil in oral cancer cells via G(1) phase cell cycle arrest. Oral Oncol. 2009;45:109-115. [PubMed] [DOI] |
| 16. | Ravizza R, Molteni R, Gariboldi MB, Marras E, Perletti G, Monti E. Effect of HIF-1 modulation on the response of two- and three-dimensional cultures of human colon cancer cells to 5-fluorouracil. Eur J Cancer. 2009;45:890-898. [PubMed] [DOI] |
| 17. | Tan ZM, Wu Y, Zhang HL, Xiao XZ. [CoCl2-induced chemotherapy resistance in SW480 cells and its mechanism]. Zhongnan Daxue Xuebao Yixueban. 2006;31:345-349. [PubMed] |
| 18. | Melillo G. Inhibiting hypoxia-inducible factor 1 for cancer therapy. Mol Cancer Res. 2006;4:601-605. [PubMed] [DOI] |
| 20. | Hussein D, Estlin EJ, Dive C, Makin GW. Chronic hypoxia promotes hypoxia-inducible factor-1alpha-dependent resistance to etoposide and vincristine in neuroblastoma cells. Mol Cancer Ther. 2006;5:2241-2250. [PubMed] [DOI] |