修回日期: 2010-07-08
接受日期: 2010-07-21
在线出版日期: 2010-08-18
目的: 研究食管癌癌变过程中血清低相对分子质量蛋白的细微变化, 探索食管癌发生的机制, 寻找食管癌早期诊断的生物标志物和方法.
方法: 应用表面激光解析电离飞行时间质谱技术对食管癌患者血清和健康对照血清进行蛋白质谱指纹图谱检测, 通过Biomarker Wizard软件筛选差异蛋白, 使用人工神经网络软件建立食管癌早期诊断模型并用盲法验证其诊断效果; 将食管癌早期和中晚期食管癌患者血清质谱图进行比对分析, 寻找各期差异蛋白, 并建立分期诊断模型.
结果: 发现食管癌和正常人差异蛋白5种, 早期食管癌和中晚期食管癌差异蛋白3种. 通过早期食管癌组和健康对照组建立早期诊断模型的灵敏度87.88%, 特异度91.43%, 准确度89.71%, 经过盲法验证结果为灵敏度95.83%, 特异度89.13%, 准确度91.43%. 早期食管癌和中晚期筛选的差异蛋白建立的分期诊断模型灵敏度75.76%, 特异度79.17%, 准确度77.19%.
结论: 表面增强激光解析离子化飞行时间质谱联合人工神经网络技术操作较为简便, 在食管癌的诊断和分期上具有可行性.
引文著录: 任兴军, 谭小林, 杨成虎, 李小琼, 冯峰, 胡琼英, 丁银环, 戴天阳, 王开正. 血清低相对分子质量差异蛋白质组在食管癌诊断和分期中的作用. 世界华人消化杂志 2010; 18(23): 2472-2477
Revised: July 8, 2010
Accepted: July 21, 2010
Published online: August 18, 2010
AIM: To find biomarkers for early diagnosis of esophageal cancer (EC) by detecting differentially expressed low molecular weight serum proteins using mass spectrometry.
METHODS: The serum proteomic patterns of EC patients and healthy controls were detected using the surface-enhanced laser desorption/ionization-time of flight-mass spectrometry (SELDI-TOF-MS). Differential protein peaks between EC patients and controls were analyzed using the Biomarker Pattern Software, and a model for early diagnosis of EC was developed and validated using an artificial neural network (ANN). Differential protein peaks between early and advanced EC patients were analyzed to establish a model for staging of EC.
RESULTS: Five differential serum proteins were identified between EC patients and controls, and three differential serum proteins were found between early and advanced EC. The diagnostic model established based on the five differential serum proteins between EC patients and controls had a sensitivity of 87.88%, a specificity of 91.43%, and an accuracy of 89.71%. The blind test generated a sensitivity of 95.83%, a specificity of 89.13%, and an accuracy of 91.43%. The staging model established based on the three differential serum proteins between early and advanced EC had a sensitivity of 75.76%, a specificity of 79.17%, and an accuracy of 77.19%.
CONCLUSION: SELDI-TOF-MS in combination with ANN is simple and feasible for the diagnosis and staging of EC.
- Citation: Ren XJ, Tan XL, Yang CH, Li XQ, Feng F, Hu QY, Ding YH, Dai TY, Wang KZ. Detection of differentially expressed low molecular weight serum proteins for diagnosis and staging of esophageal cancer. Shijie Huaren Xiaohua Zazhi 2010; 18(23): 2472-2477
- URL: https://www.wjgnet.com/1009-3079/full/v18/i23/2472.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i23.2472
食管癌位居我国恶性肿瘤的前列, 其发病机制和早期诊断技术一直是国内外学者研究的热点. 因早期癌变是否能够发现已成为目前食管癌预后的决定因素, 故本研究采用能够检测1 fmol级别的微量蛋白的表面激光解析电离飞行时间质谱(surface-enhanced laser desorption/ionization-time of flight-mass spectrometry, SELDI-TOF-MS)技术, 检测食管癌的各期(从0期到Ⅳ期)的血清中的蛋白组学变化, 寻找相关差异蛋白, 旨在提高食管癌的早期诊断率, 阐明食管癌的相关发病机制并探索低相对分子质量差异蛋白组在食管癌诊断和分期中的作用.
试验对象分为3组: 早期食管癌组、中晚期食管癌组和健康对照组. 食管癌患者来自2008-07/2009-12泸州医学院附属医院收治的食管癌患者. 根据术后病理诊断, 以国际抗癌联盟(UICC)食管癌TNM分期标准(2002), 所有食管癌均经过病理证实为食管鳞癌. 早期诊断模型建模组和验证组食管癌病例构成: 男36例, 女21例, 平均年龄59.6(31-83)岁. 其中早期诊断模型食管癌建模组33例: 其中0期1例, Ⅰ期1例, ⅡA期31例; 早期诊断模型验证组食管癌24例: 0期2例, Ⅰ期3例, ⅡA期19例. 中晚期食管癌组24例: 男16例, 女8例, 平均年龄60.7(33-87)岁, 其中ⅡB期3例, Ⅲ期20例, Ⅳ期1例. 健康对照组82例: 男51例, 女31例, 平均年龄54.5(27-79)岁, 所有健康对照组标本均源于泸州医学院附属医院的2008-07/2009-12健康体检者. 所有癌症患者均于术前1 d空腹无菌采取静脉血, 均于术后病理学确证且在采血之前未经任何放化疗治疗. 健康对照组, 每例标本均做常规生化检测, 肝肾功能, 血脂、血糖均处于正常范围, 并排除了肝炎, 糖尿病, 结缔组织病等易使血清中产生干扰蛋白的疾病. 所有试验样本无溶血. 早期食管癌, 中晚期食管癌和正常人在年龄和性别上无统计学差异. 蛋白指纹图谱分析仪(PBS Ⅱ/C)Ciphergen Biosystem Inc. 美国), 水(HPLC级), 三氟乙酸(trifluoro-acetic acid, TFA)(Sigma USA), 芥子酸(sinapic acid, SPA Sigma USA), 能量吸收分子, 乙腈(acetonitrile, HPLC grade), PBS(磷酸盐缓冲液, 10×), 均购自美国Sigma公司. 96孔蛋白质芯片工作平台(Ciphergen Biosystem Inc.美国), Au蛋白芯片.
1.2.1 标本的采集和处理: 抽取清晨空腹前臂静脉全血3 mL于洁净试管(不抗凝), 避免溶血, 置4 ℃冰箱中1-2 h, 然后4 ℃ 3 000 r/min离心10 min; 取上清加入eppendof管. 再次3 000 r/min离心5 min, 0.5 mL eppendof管分装, 30-100 μL每管, 放入-80 ℃保存, 每个样本至少3管以上.
1.2.2 芯片预处理和血清样本准备: 将芯片装入96孔芯片处理器中进行预处理, 在处理血清样本的同时活化芯片. 先在每孔中依次加入丙酮, 盐酸(0.01 mmol/L), 盐酸甲醇(1:1混合), 甲醇, 每次加入后振荡5 min, 拍干, 卸下芯片, 室温干燥后点样. 与此同时, 预先将血清从-80 ℃冰箱取出, 在冰上缓慢融化(30-60 min), 放入低温离心机4 ℃离心2 min. 取200 μL离心管编号, 于每管中分别加入5 μL PBS, 5 μL待检血清, 充分混匀. 在活化芯片至第3步时, 即芯片处理器开始振荡时加入盐酸甲醇, 立即向血清样本中加入10 μL半饱和SPA, 同时充分混匀后点样于芯池中, 再次点样加能量吸收分子, 干燥上机检测.
1.2.3 数据采集与处理: 用ProteinChip Software 3.2软件收集质谱信号, 设置激光强度为190, 检测灵敏度9, 检测上限100 000 m/z, 优化收集数据2 000-20 000 m/z, 信号收集位置20-80, 每个样本取140个点所收集信号的平均值. 所有样本均使用相同的参数设置. 使用Biomarker Wizard 软件去除噪音, 初始的噪音过滤值为5, 第2次的噪音过滤值为2, 以10%为最小阈值进行聚类, 相对分子质量偏差设为0.3%后, 结合早期食管癌, 中晚期食管癌以及正常人质谱图筛选差异蛋白.
1.2.4 建立模型和盲法验证: 使用筛选出的差异蛋白, 结合人工神经网络(artificial neural network, ANN)软件-人工神经网络Office插件2.01(Youngfan开发)版本. 早期食管癌和健康对照组建的早期诊断模型采用早期食管癌33例, 健康对照组35例建立模型, 剩下未参与建模(24例早期食管癌和46例健康对照)的样本作为验证组. 分期诊断模型使用早期食管癌33例和中晚期食管癌24例建立模型. 早期诊断模型输入层、隐含层、输出层的节点分别设置5、3、1, 以筛选的差异蛋白峰强度作为输入节点, 设定训练组食管癌患者的目标输出值为1, 正常对照的目标输出值为0, 训练次数为1 000, 学习率为0.02(此时网络误差基本恒定且最小), 采用反向传播(back-propagation)算法, 建立并存储人工神经网络诊断模型. 盲法验证: 利用双盲方法, 将验证组中食管癌和健康对照血清蛋白标志物质谱数据输入模型进行模拟仿真计算. 根据建模时尤登指数最好时设定cut-off值, 通过模拟计算的结果, 对模型的预测诊断效能进行评价. 分期诊断模型输入层、隐含层、输出层的节点分别设置3、3、1, 以筛选的差异蛋白峰强度作为输入节点, 设定训练组中晚期食管癌患者的目标输出值为1, 早期食管癌的目标输出值为0, 训练次数为1 000, 学习率为0.02, 建立并存储ANN诊断模型. 并将建模组数据回纳入所建模型, 根据仿真计算值计算模型的诊断效能.
1.2.5 差异蛋白统计学处理和诊断模型诊断效能评估: 使用SPSS11.5软件对早期、中晚期食管癌和健康对照所筛选差异蛋白强度分别进行方差分析; 对早期和晚期食管癌差异蛋白单独进行t检验, 分析其差异有无显著性. 两个诊断模型中各个差异蛋白的独立诊断价值使用SPSS进行分析, 以尤登指数最高时确定诊断阈值, 并计算此时的灵敏度和特异度. 对两个模型的ANN预测值与各个差异蛋白强度同时输入SPSS软件绘制ROC曲线图, 计算并比较曲线下面积大小. 最后对ANN软件联合各个差异蛋白后的预测诊断效能和各个差异蛋白单独诊断食管癌的价值进行分析.
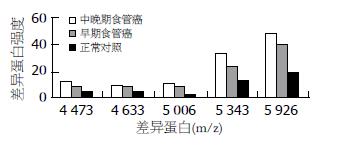
早期食管癌例, 中晚期食管癌和正常人, 在相对分子质量2 000-20 000 Da共检测到有统计学差异的56个(P<0.05). 筛选出5个差异蛋白分别是4 473、4 633、5 006、5 343、5 926(表1), 3组中各个差异蛋白表达. 其变化均是在食管癌中增高, 中晚期食管癌较早期食管癌更高(图1). 单独分析早期食管癌和中晚期食管癌质谱图发现了3个显著差异(P<0.001)差异蛋白, 分别是4 473、5 334、5 890. 3个差异蛋白强度情况. 均是中晚期食管癌患者明显增高(表2), 这3个蛋白建立的分期诊断模型能够很好地区分早期和中晚期食管癌患者.
| 差异蛋白(m/z) | 峰强度 | 方差分析 | |||
| 晚期食管癌 | 早期食管癌 | 正常对照 | F值 | P值 | |
| 4 473 | 11.48±8.59 | 7.70±4.98 | 4.29±3.34 | 11.45 | <0.001 |
| 4 633 | 9.70±4.55 | 7.52±3.80 | 4.82±3.05 | 12.43 | <0.001 |
| 5 006 | 9.92±3.68 | 7.81±3.85 | 2.54±2.36 | 40.25 | <0.001 |
| 5 343 | 32.97±16.07 | 23.67±12.72 | 13.12±9.17 | 18.28 | <0.001 |
| 5 926 | 48.11±19.84 | 40.61±15.63 | 19.89±12.54 | 26.34 | <0.001 |
| 差异蛋白(m/z) | 峰强度 | t检验 | ||
| 早期食管癌 | 中晚期食管癌 | t值 | P值 | |
| 4473 | 7.7±4.98 | 11.57±8.50 | 2.158 | 0.035 |
| 5334 | 23.86±12.64 | 33.40±15.55 | 2.554 | 0.013 |
| 5890 | 10.28±8.11 | 17.18±14.70 | 2.260 | 0.028 |
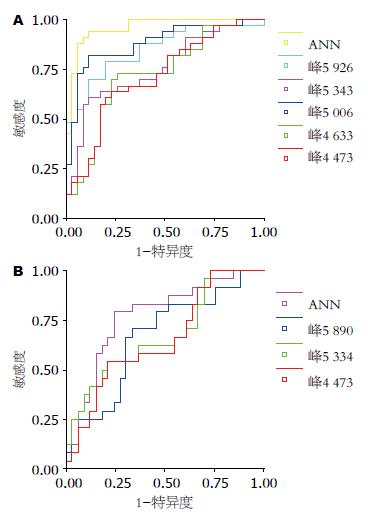
早期和分期诊断模型中各个差异蛋白的诊断价值如下(表3, 表4), 早期诊断模型中ANN预测值和质荷比为5 006、5 926、5 343、4 633、4 473的ROC曲线(图2A)下面积分别为0.958、0.88、0.848、0.758、0.725、0.716. 分期诊断模型中ANN预测值和质荷比为5 334、5 890、4 473的ROC曲线(图2B)面积分别为0.774、0.678、0.670、0.657.
| 差异蛋白m/z | 诊断阈值 | 灵敏度(%) | 特异度(%) |
| 4 473 | 6.45 | 64.71 | 80.00 |
| 4 633 | 5.43 | 73.53 | 77.14 |
| 5 006 | 4.86 | 82.35 | 91.43 |
| 5 343 | 22.70 | 61.76 | 91.43 |
| 5 926 | 30.99 | 79.41 | 82.86 |
| 差异蛋白m/z | 诊断阈值 | 灵敏度(%) | 特异度(%) |
| 4 473 | 10.04 | 81.82 | 54.17 |
| 5 334 | 33.12 | 81.82 | 54.17 |
| 5 890 | 11.65 | 72.73 | 66.67 |
使用5个差异蛋白建立早期食管癌和正常人的诊断模型. 该模型的灵敏度87.88%, 特异度91.43%, 准确度89.71%, 使用未参与建模的病例盲法验证结果为灵敏度95.83%, 特异度89.13%, 准确度91.43%. 使用3个在早期和中晚期食管癌的差异蛋白建立的区别食管癌病理分期模型的诊断效率是: 灵敏度75.76%, 特异度79.17%, 准确度77.19%.
食管癌已成为我国危害人们健康的常见肿瘤, 目前临床就诊的手术患者中多数为Ⅱ、Ⅲ期患者, 占90%以上, 但目前Ⅱ、Ⅲ食管癌5年生存率在20%-36%[1]. 目前张合林等[2]发现淋巴结转移已成为食管癌预后的重要因素, 王永岗[3]研究发现有淋巴结转移者的5年生存率为16.4%, 明显低于无淋巴结转移者的51.9%, 且ⅡB期患者的5年生存率和Ⅲ期患者相近. 故本研究据淋巴结转移的与否将食管癌分为早期食管癌(0、Ⅰ、ⅡA期)、中晚期食管癌(ⅡB、Ⅲ、Ⅳ期), 以便于更好地分析食管癌癌变过程中蛋白变化情况, 探索食管癌癌变机制.
本项研究筛选出食管癌低相对分子质量差异蛋白质共计56个(P<0.05), 其中表达明显差异(P<0.001)的有5个, 他们对于食管癌的诊断价值大小依次为: 5 006 Da>5 926 Da>5 343 Da>4 633 Da>4 473 Da, 其灵敏度在64.71%-82.35%, 特异性为77.17%-91.43%. 而在分期诊断模型中, 3个差异蛋白的诊断价值大小分别为5 334 Da>5 890 Da>4 473 Da, 其灵敏度为72.73%-81.82%, 特异度在54.17%-66.67%. 陈建平等[4]研究食管癌患者和正常人血清发现, 差异蛋白强度在正常人中均高于食管癌, 而本研究与王英等[5], 王立东等[6], 刘茶珍等[7], 施民新等[8], Xu等[9], 亦不全相同. 各个研究所筛选差异蛋白和建立模型的诊断效果不同, 这可能与多种因素有关. (1)病例选择: 如王士杰等[10]只选择了高发区病例; 有的学者只选用食管鳞癌或腺癌[11], 有的两者兼有. (2)芯片种类: WCX2芯片主要和蛋白质表面的正电荷基团相互作用(如赖氨酸, 精氨酸, 组氨酸)而捕获蛋白质; IMAC3芯片可以螯合金属离子(Cu2+, Ni2+. Ca2+)等, 通过色氨酸, 半胱氨酸及磷酸化氨基酸等与血清中蛋白质相结合以检查磷酸化蛋白质或生物标志分子; 而本研究所用金芯片是在将样品经过适当处理后直接点样干燥后检测. (3)数据挖掘软件. ANN是一种大规模并行非线性处理系统, 具有良好的抗干扰能力, 适应性、自学习能力, 在数据挖掘方面较决策树和支持向量机有其独特的优势. ANN联合分析差异蛋白质组, 建立的早期诊断模型和分期诊断模型明显提高了诊断效率, ROC曲线下面积为0.958和0.774, 较单个差异蛋白的诊断价值明显增高, 提示ANN具有综合能力及提高多项试验联合诊断的潜力. ANN联合SELDI技术筛选差异蛋白诊断疾病模型有其显著的优势, 余捷凯等[12]用于卵巢癌, 姜伟等[13]用于精神分裂症都取得了很好的诊断效果.
食管癌患者明显表达增高的5个差异蛋白质组与疾病发展阶段呈现正相关的现象, 在肿瘤晚期其表达强度增高明显. 因所选差异蛋白均带一个电荷, 所以其质核比就代表了其相对分子质量. 经Swiss-Prot蛋白质数据库初步检索, 4 633 Da的蛋白质可能为一种等电点PI: 9.05, 相对分子质量为4 632的蛋白质-单链DNA结合蛋白(single-stranded DNA-binding protein MSSP-1). 其可能作用于原癌基因的上游区局部, 与DNA复制相关. 相对分子质量为5334的蛋白可能为β-防御素134(beta-defensin 134), 相对分子质量5 324 Da, PI: 6.73. 防御素是一类相对分子质量在4 000 Da左右的阳离子抗菌肽, 普遍分布于哺乳动物、昆虫及植物体内, 而人防御素属于抗菌肽家族防御素类, 是人体免疫系统的重要组成部分, 为4 000-6 000 Da的阳离子短肽, 是人体内源性免疫系统的重要组成部分. β-防御素(HBD3)在成年人心脏, 骨骼肌, 胸腺, 食管、口腔黏膜等中均有表达[14]. 然而迄今为止β-防御素家族的基因发现的不多, 功能也不很清楚, 故其在食管癌的发生和进展中是否有作用以及作用如何尚需进一步研究. 其他几个相对分子质量没有在此数据库中发现相关蛋白.
在分期诊断模型中各个差异蛋白在食管癌中晚期的表达强度较早期食管癌高, 且差异有显著性. 差异蛋白之一5 890查阅数据库鉴定为为纤维蛋白原α链(fibrinogen alpha chain frag). 目前发现血浆中纤维蛋白原增高与多种肿瘤的发生、发展、转移和预后相关[15,16]. 而纤维蛋白原α链表达强度增高是否与血浆中纤维蛋白原含量相关目前还有待进一步研究. 差异蛋白4 473鉴定为抗凝血酶Ⅲ(antithrombin-Ⅲ). 抗凝血酶Ⅲ是一种球蛋白, 在肝脏内合成, Allard等[17]发现其与脑卒中关系密切. 目前大多文献报道在肿瘤患者血中抗凝血酶Ⅲ浓度较健康正常人低, 可能是由于癌肿中有凝血活酶物质释放到血流中促进凝血过程, 从而使其浓度下降. 本研究筛选出差异蛋白虽然较健康对照高, 但是其强度仍较大多数差异蛋白低. 本研究其他几个差异蛋白未在蛋白组学数据库中找到人类相对应的蛋白, 可能是未被人们发现的新蛋白. 分期诊断模型在经过大样本验证可行后, 就可以在食管癌患者术前就可以明确其是否属于中晚期食管癌, 对手术方式的选择和术前治疗药物的选择方面有重大的意义. 在蛋白组学技术结合实验数据库的应用方面, 蔡建等[18]利用http://www.dbmi.pitt.edu/EPO-KB/Query.jsp软件鉴定了结直肠癌标志物血小板因子4, 并通过ELISA验证. 因此通过SELDI技术筛选差异蛋白并经数据库鉴定具有较好的准确性和较大的可行性. 本研究采用高通量高灵敏度的SLEDI检测技术, 从食管癌在发生发展过程中蛋白质代谢的细微变化探索疾病过程的内在联系, 建立早期和分期诊断模型, 进而寻找一种能够在食管癌早期就能够较好诊断和在食管癌术前就能够明确进行分期诊断的新方法. 这可能为肿瘤的诊断和防治以及发病机制的探索找到一种新的方法. 鉴于淋巴结转移将显著影响患者的预后, 而如果能够在患者手术治疗前发现患者存在淋巴结转移, 则可预先进行淋巴结清扫等处理提高患者的术后生存率. 因此我们下一步将扩大样本量, 多中心, 更长时间的重复验证早期和分期诊断模型的诊断效果, 并将结合最新食管癌分期UICC(2009年)进一步分析差异蛋白是否随转移的淋巴结数目增多而变化并且鉴定其相关蛋白. 更大样本的双盲验证和完善的诊断模型, 促使其早日用于临床.
食管癌早期诊断和分期诊断对食管癌的研究具有重要价值, 目前急需寻找能够诊断早期食管癌的方法, 以提高食管癌患者的生存率; 急需寻找可以在术前明确分期的方法, 利于手术方式的选择和术前的治疗. SELDI蛋白芯片技术在这方面研究上有其显著的优势.
吕宾, 教授, 浙江中医学院附属医院(浙江省中医院、浙江省东方医院)消化科
随着SELDI技术的研究深入, 其在肿瘤方面的应用前景亦有越来越广阔. 如何设计更好的实验用于肿瘤的诊断、治疗、疗效判断和预后估计, 并使之能够早日用于临床已是当前研究者面临的主要问题之一. 食管癌作为危害我国人民健康的主要肿瘤之一, 已成为目前SELDI-TOF-MS研究的焦点.
国内外许多学者对使用SELDI技术诊断食管癌进行了广泛的研究, 差异蛋白筛选结合蛋白组学数据库初步鉴定后, 再经过其他技术(2-DE等)验证鉴定后建立诊断模型, 这可能是进一步探讨食管癌发病机制和提高诊断食管癌诊断率的关键.
本研究建立了一种对食管癌进行早期诊断和分期诊断的模型, 并具有较高的诊断效能, 可以在大样本验证后用于临床辅助诊断.
差异蛋白筛选结合蛋白组学数据库鉴定为探索食管癌的发病机制提出新的方法; 建立诊断模型为SELDI技术用于食管癌的临床诊断提供参考数据.
本文整体设计尚合理, 结果可靠, 为食管癌发病机制的研究奠定基础, 具有一定的临床参考价值.
编辑: 曹丽鸥 电编:吴鹏朕
| 1. | Lowy AM, Firdaus I, Roychowdhury D, Redmond K, Howington JA, Sussman JJ, Safa M, Ahmad SA, Reed MF, Rose P. A phase II study of sequential neoadjuvant gemcitabine and paclitaxel, radiation therapy with cisplatin and 5-fluorouracil and surgery in locally advanced esophageal carcinoma. Am J Clin Oncol. 2006;29:555-561. [PubMed] [DOI] |
| 5. | 王 英, 张 自森, 刘 芳, 毛 友生, 张 金生, 张 德超, 邓 碧萍, 马 龙华, 许 洋, 赵 晓航. 食管鳞癌血清WCX2蛋白芯片诊断模型的研究. 中华检验医学杂志. 2004;27:634-637. |
| 6. | 王 立东, 王 道存, 郑 树, 范 宗民, 李 吉林, 冯 常炜, 张 延瑞, 刘 宾, 高 珊珊, 何 欣. 河南林州食管癌高发区食管癌和癌前病变患者血清蛋白质谱. 癌症. 2006;25:549-554. |
| 8. | 施 民新, 刘 茶珍, 刘 继斌, 强 福林, 朱 佩云, 廖 萍, 王 文静, 张 一心, 杨 磊. 应用SELDI-TOF-MS技术分析南通地区食管癌血清差异表达蛋白. 现代肿瘤医学. 2006;14:1360-1361. |
| 9. | Xu SY, Liu Z, Ma WJ, Sheyhidin I, Zheng ST, Lu XM. New potential biomarkers in the diagnosis of esophageal squamous cell carcinoma. Biomarkers. 2009;14:340-346. [PubMed] [DOI] |
| 10. | 王 士杰, 张 立玮, 于 卫芳, 余 捷凯, 郑 树, 李 英赛, 尔 丽绵, 温 登瑰, 高 金宏, 徐 志彬. 高发区筛查人群食管鳞癌血清蛋白指纹图谱诊断模型的建立及临床价值. 中华肿瘤杂志. 2007;29:441-443. |
| 11. | Hammoud ZT, Dobrolecki L, Kesler KA, Rahmani E, Rieger K, Malkas LH, Hickey RJ. Diagnosis of esophageal adenocarcinoma by serum proteomic pattern. Ann Thorac Surg. 2007;84:384-392; discussion 392. [PubMed] [DOI] |
| 13. | 姜 伟, 王 开正, 白 克镇, 邓 剑, 蔡 美珠. 精神分裂症患者血清蛋白标志物的临床应用研究. 中国神经精神疾病杂志. 2008;34:27-30. |
| 14. | Jia HP, Schutte BC, Schudy A, Linzmeier R, Guthmiller JM, Johnson GK, Tack BF, Mitros JP, Rosenthal A, Ganz T. Discovery of new human beta-defensins using a genomics-based approach. Gene. 2001;263:211-218. [PubMed] |
| 15. | Yamashita H, Kitayama J, Nagawa H. Hyperfibrinogenemia is a useful predictor for lymphatic metastasis in human gastric cancer. Jpn J Clin Oncol. 2005;35:595-600. [PubMed] [DOI] |
| 16. | Takeuchi H, Ikeuchi S, Kitagawa Y, Shimada A, Oishi T, Isobe Y, Kubochi K, Kitajima M, Matsumoto S. Pretreatment plasma fibrinogen level correlates with tumor progression and metastasis in patients with squamous cell carcinoma of the esophagus. J Gastroenterol Hepatol. 2007;22:2222-2227. [PubMed] [DOI] |
| 17. | Allard L, Lescuyer P, Burgess J, Leung KY, Ward M, Walter N, Burkhard PR, Corthals G, Hochstrasser DF, Sanchez JC. ApoC-I and ApoC-III as potential plasmatic markers to distinguish between ischemic and hemorrhagic stroke. Proteomics. 2004;4:2242-2251. [PubMed] [DOI] |