修回日期: 2010-07-28
接受日期: 2010-08-03
在线出版日期: 2010-08-18
目的: 探讨组蛋白去乙酰化酶(HDAC)抑制剂曲古菌素A(TSA)对胃癌细胞系SGC-7901中组蛋白H3乙酰化水平及细胞凋亡的影响.
方法: 流式细胞仪检测细胞凋亡率, 免疫细胞化学法检测75 μg/L TSA干预前胃癌细胞系SGC-7901中乙酰化组蛋白H3的表达.
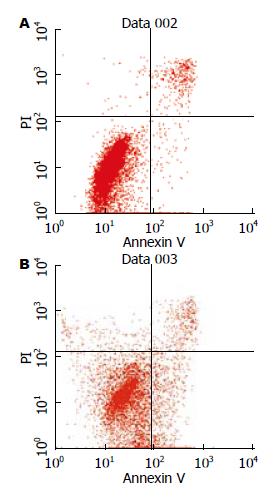
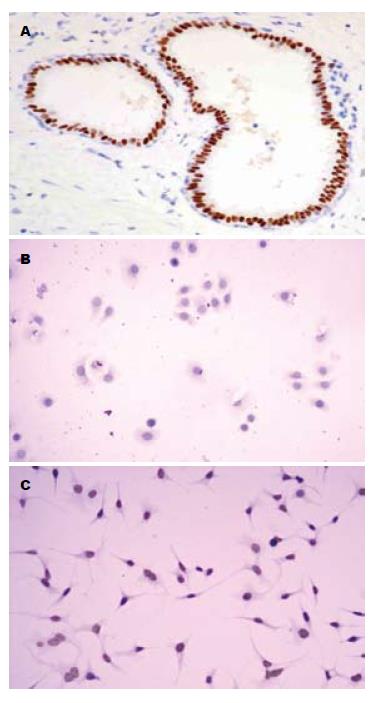
结果: TSA干预后胃癌细胞系SGC-7901中乙酰化组蛋白H3的表达水平明显升高, 乙酰化组蛋白H3阳性细胞数从1.12±1.06上升至35.43±6.05, 与未干预相比两者表达有显著性差异(P<0.01), 流式细胞仪分析显示细胞凋亡率增加到22.13%±3.49%.
结论: TSA可诱导细胞凋亡, 促进胃癌细胞系SGC-7901中乙酰化组蛋白H3的表达.
引文著录: 杨桐树, 李云龙, 赵婷. 曲古菌素A对人胃癌细胞SGC-7901中组蛋白H3乙酰化水平及细胞凋亡的影响. 世界华人消化杂志 2010; 18(23): 2469-2471
Revised: July 28, 2010
Accepted: August 3, 2010
Published online: August 18, 2010
AIM: To investigate the effects of trichosttain A (TSA), a histone deacetylase inhibitor, on apoptosis in hunman gastric cancer cell line SGC-7901.
METHODS: After SGC-7901 cells were incubated with 75 μg/L TSA for 48 h, cell apoptosis was measured by flow cytometry, and the expression of acetylated histone H3 was detected by immunohistochemistry.
RESULTS: TSA could significantly inhibit proliferation and induce apoptosis of SGC-7901 cells. The expression level of acetylated histone H3 was higher in SGC-7901 cells treated with TSA (75 μg/L for 48 h) than in control cells (35.43 ± 6.05 vs 1.12 ± 1.06). The apoptosis rate was significantly different between SGC-7901 cells treated with TSA (75 μg/L for 48 h) and control cells (P < 0.05).
CONCLUSION: TSA can induce SGC-7901 cell apoptosis possibly by up-regulating the expression of acetylated histone H3.
- Citation: Yang TS, Li YL, Zhao T. Trichostatin A increases histone H3 acetylation and promotes apoptosis in gastric cancer cell line SGC-7901. Shijie Huaren Xiaohua Zazhi 2010; 18(23): 2469-2471
- URL: https://www.wjgnet.com/1009-3079/full/v18/i23/2469.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i23.2469
组蛋白乙酰化酶(histoneacetylase, HAT)和组蛋白去乙酰化酶(histonedeacetylase, HDAC)是调节组蛋白乙酰化状态的一对功能相互拮抗的蛋白酶, 二者之间的动态平衡控制着染色质的结构和基因的表达. 曲古菌素A(trichostatin A, TSA)是一种异羟肟酸类组蛋白去乙酰化酶抑制剂(histonedeacetylase inhibitors, HDACi), 能抑制HDAC的活性, 影响细胞增殖[1,2]. 本研究以TSA作用胃癌细胞系SGC-7901, 观察SGC-7901细胞中组蛋白H3乙酰化的变化及其对该细胞凋亡的影响, 初步探讨其在胃癌细胞系SGC-7901中的作用.
胃癌细胞株SGC-7901由黑龙江省肿瘤防治研究所惠赠. 100 mL/L胎牛血清、100 g/L链霉素、含100 kU/L青霉素的RPMI 1640(Gibco公司)培养液. 兔抗人乙酰化组蛋白H3多克隆抗体购自美国Upstate公司, 其工作浓度为1:100. 增强型SABC免疫组织化学检测试剂盒购自北京中山公司. TSA购于Sigma公司, 批号T8552/028k4153.
1.2.1 分组: 实验设空白对照组和75 μg/L TSA组[3].
1.2.2 细胞培养: SGC-7901细胞常规培养于胎牛血清(杭州四季青生物工程材料有限公司)、100 kU/L青霉素和100 mg/L链霉素的RPMI 1640培养液中, 在37 ℃, 50 mL/L CO2培养箱中贴壁培养. 每1-2 d传代1次, 取对数生长期细胞进行实验.
1.2.3 流式细胞术: 收集培养48 h对照组和处理组细胞, 离心, PBS洗2次, 用Annexin V缓冲液重悬细胞, 取5×106细胞加入5 μL Annexin V-FITC(Pharmingen)混匀, 室温避光孵育10 min. 离心, 弃上清, 用190 μL Annexin V-FITC缓冲液重悬细胞, 加入20 mg/L PI 10 μL, 用流式细胞仪检测凋亡细胞.
1.2.4 免疫组织化学检测: 采用SABC法. 各组按说明书进行操作. 染色结果以细胞核内出现明确的棕黄色或棕褐色判定为阳性表达. 采用图像分析软件UTHSCSA Image Tool 3.0版, 随机选取10个高倍视野(×200)计数阳性细胞数, 计算平均数.
统计学处理 采用SPSS17.0统计分析软件. 数据用mean±SD表示, 组间差异采用F检验, P<0.05有统计学意义.
流式细胞术检测, 75 μg/L TSA处理SGC-7901细胞48 h和对照组细胞相比, SGC-7901细胞凋亡率达到22.13%±3.49%(图1).
各组免疫细胞化学采用图像分析软件处理(图2), 对照组蛋白H3阳性细胞数为1.12±1.06, 而TSA组则为35.43±6.05, TSA组较对照组阳性细胞数显著增高(P<0.01).
组蛋白乙酰化/去乙酰化修饰是基因转录调控的关键机制之一. 乙酰化是最早被发现的与转录有关的组蛋白修饰方式, 主要发生在组蛋白H3和H4的尾部比较保守的赖氨酸残基. 组蛋白乙酰化水平受一对互相拮抗的蛋白酶-HAT和HDAC调控, HAT/HDAC活性紊乱会使基因表达失控, 导致癌症的发生[4]. HDACi可以通过抑制HDAC活性, 诱导组蛋白高乙酰化, 调节基因表达, 从而发挥抗癌效应.
TSA是第一个来源于天然产物的HDACi, 是HDACi的代表药物之一, 属异羟肟酸类化合物, 可通过其异羟肟酸配基与HDAC管状结构底部的锌离子结合抑制HDACs的活性[5]. 本实验采用流式细胞仪检测75 μg/L TSA处理胃癌SGC-7901细胞的凋亡率, 48 h后出现明显的凋亡, 凋亡率达到22.13%±3.49%, TSA在SGC-7901细胞中所诱导的细胞凋亡效应与TSA在其他恶性肿瘤细胞中的作用相符[6-9].
本实验采用免疫细胞化学方法检测TSA(75 μg/L)干预前后, 胃癌细胞系SGC-7901乙酰化组蛋白H3表达水平, 正常培养的SGC-7901细胞乙酰化组蛋白H3呈低水平表达, TSA干预后, SGC-7901细胞乙酰化组蛋白H3表达水平明显增加(P<0.01). 这种生物学效应表明, TSA通过抑制HDAC[6], 打破了SGC-7901细胞原有的组蛋白乙酰化调控状态, 使得SGC-7901细胞中乙酰化组蛋白H3表达增多.
去乙酰化转移酶抑制剂抗肿瘤主要通过调控与肿瘤相关的基因来实现的, 具体的机制因肿瘤和去乙酰化转移酶抑制剂的种类不同而有所不同[10-13], 其对肿瘤细胞的效应主要通过以下几个途径来实现: (1)阻滞细胞周期、诱导细胞分化; (2)诱导细胞凋亡; (3)抑制血管生成; (4)增加肿瘤细胞对化疗和放疗的敏感性. TSA等HDACi作为HDAC抑制剂, 可诱导组蛋白的高乙酰化状态, 而组蛋白高乙酰化很可能是TSA等HDACi作用的始动环节, 因此, 我们推测TSA等HDACi有可能通过诱导组蛋白高乙酰化激活或抑制相关基因转录, 直接或间接诱导肿瘤细胞凋亡.
我们的研究初步表明, TSA可以促进胃癌细胞系SGC-7901中乙酰化组蛋白H3的表达, 诱导SGC-7901细胞凋亡, 这极有可能发展为一种新的治疗胃癌的方法, 但TSA的具体作用机制有待进一步研究.
组蛋白乙酰化酶(HAT)和组蛋白去乙酰化酶(HDAC)二者之间的动态平衡控制着染色质的结构和基因的表达. 曲古菌素A(TSA)是一种异羟肟酸类HDAC抑制剂, 能抑制组蛋白去乙酰化酶的活性.
谢敏, 主任医师, 南京大学医学院附属鼓楼医院普外科
体外培养已经证实, TSA能促进多种肿瘤的凋亡, 但对TSA在胃癌中的凋亡作用和TSA可以促进胃癌细胞系SGC-7901中乙酰化组蛋白H3表达的研究不多.
国内外有关报道提示TSA对多种肿瘤细胞有显著抑制作用, 抑制肿瘤细胞凋亡.
国内外大多以研究胃癌细胞系的增殖为目标, 对于细胞凋亡的研究大多使用流式细胞仪检测细胞周期. 而本研究是将凋亡与免疫组织化学结合起来, 探讨H3的表达及细胞凋亡.
本文选题较好, 数据可靠, 对胃癌的治疗有一定的参考价值.
编辑: 曹丽鸥 电编:吴鹏朕
| 1. | 马 俊芬, 江 亚南, 赵 继敏, 黄 幼田, 赵 明耀, 董 子明. 曲古菌素A对食管癌EC1细胞增殖和细胞周期的影响及其分子机制. 世界华人消化杂志. 2009;17:3534-3537. [DOI] |
| 3. | Zou XM, Li YL, Wang H, Cui W, Li XL, Fu SB, Jiang HC. Gastric cancer cell lines induced by trichostatin A. World J Gastroenterol. 2008;14:4810-4815. [PubMed] [DOI] |
| 4. | Dhordain P, Lin RJ, Quief S, Lantoine D, Kerckaert JP, Evans RM, Albagli O. The LAZ3(BCL-6) oncoprotein recruits a SMRT/mSIN3A/histone deacetylase containing complex to mediate transcriptional repression. Nucleic Acids Res. 1998;26:4645-4651. [PubMed] [DOI] |
| 5. | Marks PA, Richon VM, Breslow R, Rifkind RA. Histone deacetylase inhibitors as new cancer drugs. Curr Opin Oncol. 2001;13:477-483. [PubMed] [DOI] |
| 7. | Duan H, Heckman CA, Boxer LM. Histone deacetylase inhibitors down-regulate bcl-2 expression and induce apoptosis in t(14;18) lymphomas. Mol Cell Biol. 2005;25:1608-1619. [PubMed] [DOI] |
| 11. | 陈 萦恒, 房 静远. P21WAF1的调节-乙酰化和甲基化. 国外医学·肿瘤学分册. 2002;29:263-266. |
| 13. | 王 立明, 曲 巍. 肿瘤抗异常转录治疗研究进展. 国外医学·肿瘤学分册. 2005;32:420-423. |