修回日期: 2010-06-14
接受日期: 2010-06-28
在线出版日期: 2010-08-18
目的: 观察突变型DNA聚合酶β(DNA polymerase β, polβ)的碱基切除修复(base excision repair, BER)功能的改变.
方法: 将polβ真核表达载体pcDNA4-C-polβ1, pcDNA4-C-polβ2以脂质体介导方式转染polβ基因敲除的EC9706细胞, G418筛选得到稳定转染pcDNA4-C-polβ1, pcDNA4-C-polβ2的细胞克隆; 通过镍柱亲和层析法纯化蛋白; 退火合成含有单碱基缺失的DNA底物, 与纯化的野生型和突变型polβ蛋白进行BER修复实验.
结果: G418筛选得到稳定转染pcDNA4-C-polβ1, pcDNA4-C-polβ2的EC9706细胞; 提取并纯化出polβ1、polβ2蛋白与退火合成单碱基缺口的DNA底物进行BER实验. 在BER实验中, 野生型polβ能够在DNA底物的酶切位点处将其完全切开, 而突变型polβ仅将其部分切开.
结论: 野生型的polβ能够修复单碱基缺失的DNA底物, 而突变型的polβ碱基切除修复功能明显减弱.
引文著录: 赵四敏, 陈旭东, 张成娟, 赵国强, 董子明. DNA聚合酶β在食管癌组织中的修复功能. 世界华人消化杂志 2010; 18(23): 2460-2463
Revised: June 14, 2010
Accepted: June 28, 2010
Published online: August 18, 2010
AIM: To observe the variation in base excision repair (BER) function of mutant DNA polymerase β (polβ).
METHODS: The plasmids pcDNA4-C-polβ1 and pcDNA4-C-polβ2 were transfected into polβ-knockout EC9706 cells by lipotransfection. The stable transfectants were screened in the medium containing G418. The recombinant proteins were purified by nickel column chromatography. DNA substrate that contains a single-base deletion was synthesized to test the BER function of the purified recombinant proteins.
RESULTS: Cell strains stably transfected with pcDNA4-C-pol β1 and pcDNA4-C-pol β2 were successfully obtained. Purified proteins polβ1 and polβ2 were incubated with synthesized DNA substrate that contains a single-base deletion to test their BER function. Wild-type polβ could completely excise the DNA substrate while the mutant polβ could only partly excise the DNA substrate.
CONCLUSION: Wide-type polβ has stronger activity than mutant polβ in repairing DNA substrate that contains a single-base deletion.
- Citation: Zhao SM, Chen XD, Zhang CJ, Zhao GQ, Dong ZM. DNA repair function of DNA polymerase β in human esophageal cancer. Shijie Huaren Xiaohua Zazhi 2010; 18(23): 2460-2463
- URL: https://www.wjgnet.com/1009-3079/full/v18/i23/2460.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i23.2460
DNA聚合酶β(DNA polymerase β, polβ)是DNA聚合酶家族中的一员, 为一看家基因. 其主要功能被认为是参与DNA修复, 在碱基切除修复(base excision repair, BER)过程中填补单核苷酸缺口[1], 包括短补丁(单一核苷酸)BER途径和/或长补丁(几个核苷酸合并)BER途径[2], 是目前已知BER中最重要的聚合酶之一[3]. 迄今为止, 已在直肠癌、前列腺癌、食管癌、胃癌、鼻咽癌等多种人类肿瘤组织中发现polβ基因的突变和表达异常[4-8]. 近年来许多学者对polβ在肿瘤组织及细胞系中的突变, 表达状态进行了系统研究, 然而肿瘤组织中突变polβ的功能改变鲜见报道. 本课题组曾在世界上首次发现在食管癌高发区及非高发区食管癌患者中有polβ基因的突变存在[9], 人食管癌组织polβ基因突变突变率达36%, 且其突变形式与已报道的在其他肿瘤中polβ基因的突变形式不尽相同有以A/G转换和G/T颠换为热点等的多种突变形式[10]. 作为该课题的后继研究, 本实验选择利用先前所构建的野生型和食管癌突变型polβ基因真核表达载体(pcDNA4-C-polβ1和pcDNA4-C-polβ2), 转染入polβ基因敲除的EC9706细胞(本实验室前期构建并冻存), 纯化得到39 000 Da的polβ蛋白, 检测其对单碱基缺失DNA底物的修复能力, 为探讨polβ基因突变在肿瘤发生发展中的作用积累实验依据.
野生型和食管癌突变型polβ基因真核表达载体(pcDNA4-C-polβ1和pcDNA4-C-polβ2)均由本实验室构建保存; HislinkTM蛋白纯化试剂盒、限制性内切酶HindⅢ购自Promega公司; G418购自Gibco公司; 脂质体(LipofectamineTM2000)购自Invitrogen公司; DMEM、胎牛血清购自杭州四季青生物工程研究所.
1.2.1 细胞转染及蛋白纯化: 将本实验室先前构建的质粒pcDNA4-C-polβ1和pcDNA4-C-polβ2分别以脂质体包裹的方式转染入polβ基因敲除的EC9706细胞, 转染6 h后换为含100 mL/L BSA的DMEM完全培养基继续培养, 继续培养24 h后G418筛选2 wk, G418筛选浓度为700 g/L, 得到稳定表达pcDNA4-C-polβ1, pcDNA4-C-polβ2的细胞克隆, 收集稳定转染的细胞使用HislinkTM蛋白纯化试剂盒纯化蛋白; 纯化的蛋白通过紫外分光光度法测定蛋白含量, 将得到的野生型和突变型polβ蛋白均稀释为400 μg/L.
1.2.2 聚丙烯酰胺凝胶电泳: 浓缩胶浓度为5%, 分离胶浓度为15%. 分别取pcDNA4-C-polβ1, pcDNA4-C-polβ2稳定转染后超声破碎细胞的上清液以及HislinkTM蛋白纯化试剂盒纯化的蛋白, 加入相应体积的5×Loading Buffer, 95 ℃煮5 min后SDS-PAGE电泳, 考马斯亮蓝R-250染色30 min, 甲醇-冰醋酸脱色并观察. 采用凝胶分析系统扫描, 分析SDS-PAGE后凝胶上的染色条带.
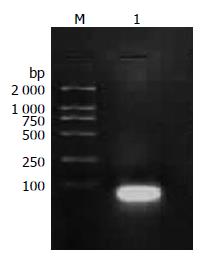
1.2.3 BER修复实验DNA底物的制备: 合成带有HindⅢ酶切位点的单碱基缺失DNA底物的3条单链P1、P2、P3分别为P1: 5'TACCGCGGCCGAACTCCATCTGGATAA3'; P2: 5'CTTAGAACGCTCGGTTGCTATTGGGTAC3'; P3: 5'GTACCCAATAGCAACCGAGCGTT CTAAGCTTATCCAGATGGAGTTCGGCCGCGGTA3'; 由上海生工公司合成. 退火反应体系50 μL, 其中P1 11.25 μL, P2 11.25 μL, P3 22.5 μL, 10×Buffer 5 μL. 退火条件为: 95 ℃煮沸3 min, 自然降温至70 ℃维持10 min, 再自然降温至37 ℃, 1.5%琼脂糖凝胶电泳并凝胶成像分析, 退火产物大小56 bp.
1.2.4 BER修复及酶切鉴定: 设计的DNA底物碱基缺口处含有HindⅢ酶切位点, 如果缺口能被polβ蛋白修复, 则完整的DNA底物能被HindⅢ切开, 分别成为27和28 bp的两个片段, 如果polβ蛋白修复功能丧失或不足, 则缺失不能或只能部分被修复, DNA底物不能或部分被HindⅢ切开. 但如果存在蛋白浓度过高可以将底物全部修复或蛋白浓度过低底物全不能修复这类情况, 则不能观察出野生型和突变型polβ的功能差别. 因此按1:4, 1:8和1:16分别稀释400 μg/L polβ1和polβ2蛋白. BER修复反应体系6 μL, 10×Buffer 0.6 μL, 修复实验DNA底物3 μL, 4×dNTP 0.6 μL, 稀释后polβ1(或polβ2)蛋白0.6 μL, MilliQ-H2O 1.2 μL, 37 ℃水浴30 min, 后70 ℃灭活10 min. 酶切体系为10 μL, 其中Buffer 1 μL, HindⅢ 1 μL, BER修复产物5 μL, MilliQ-H2O 3 μL, 37 ℃酶切2 h, 2%琼脂糖凝胶电泳, 凝胶分析系统扫描分析结果.
3条单链P1、P2、P3退火后形成含有单碱基缺失的56 bp的DNA底物, 琼脂糖凝胶电泳后凝胶成像分析, 条带单一位置正确, 说明退火产物与预期结果相符(图1).
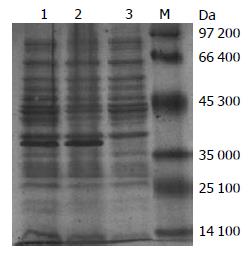
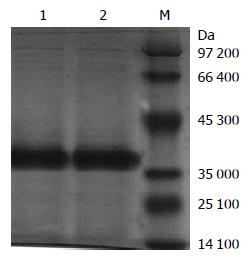
表达产物经SDS-PAGE分析, 结果显示, 在相对分子质量约为39 000 Da的蛋白条带处, 转染重组质粒组明显亮于转染空质粒组, 与预期的融合蛋白大小相符(图2); HislinkTM蛋白纯化试剂盒纯化的蛋白仅在39 000 Da位置有一条带, 说明蛋白表达及纯化成功(图3).
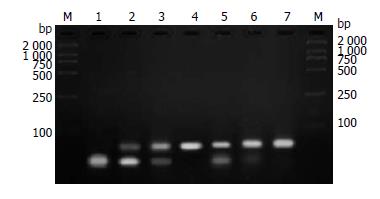
当含有碱基缺失的DNA底物得到BER修复, 可被HindⅢ切开成为27和28 bp的两个短片段. 1:4稀释polβ1蛋白的BER产物, 经HindⅢ酶切, 56 bp的DNA底物带完全消失, 说明彻底修复DNA底物上的碱基缺失; 而对应的1:4稀释polβ2蛋白的BER产物, HindⅢ酶切后仍然存在明显的56 bp DNA底物带, 说明突变型polβ蛋白仅能部分修复DNA底物上的碱基缺失. polβ蛋白进一步稀释, 1:8稀释时polβ1的BER作用也显著高于polβ2; 1:16稀释时, polβ1还能修复部分DNA底物上的碱基缺失, 而对应polβ2已完全没有修复活性, 电泳结果仅有1条未修复的56 bp DNA底物带(图4).
肿瘤的发生是多个基因突变累积的结果. 这些突变包括参与DNA复制和修复以及维持基因稳定性和完整性的基因, 其中polβ基因和肿瘤的关系受到越来越多的关注. polβ是一重要的DNA 修复酶, 该酶在哺乳类动物细胞的同源性以及在结构进化中的高度保守性说明他在生命活动中起着重要作用[11]. 自从重组全DNA技术克隆出了DNA聚合酶β的cDNA以后, 他的生物学功能越来越受到人们的重视. 有人称其为生物进化过程的"看家酶". 其突变的存在与一些肿瘤的发生有关[12].
野生型polβ最为重要的功能是在DNA切除修复中填补由碱基切除所产生的单个核苷酸缺口, 一般而言, 他并不参与其他DNA聚合酶的催化反应. 但在应对外来损伤因素时, 高表达的polβ则有可能参与DNA跨损伤合成或者其他的DNA修复途径等, 引起DNA合成和修复中的突变机会的增加[13]. polβ是BER过程的重要组成部分, 而BER又是异常基因修复的重要途径, 对于细胞的正常生长具有至关重要的作用. polβ异常的细胞会显示BER的缺乏以及增加对损伤碱基的物质的敏感性, 也会增加抑癌基因, 原癌基因以及其他控制生长的重要基因的突变频率, 从而增加肿瘤的发生几率.
本研究结果显示: 野生型polβ能够修复单碱基缺失的56 bp的DNA底物, HindⅢ发挥作用, 得到27和28 bp的两个片段, 提示野生型polβ BER功能正常; 食管癌组织中突变的polβ不能或只能部分修复单碱基缺失的56 bp的DNA底物, 提示突变的polβBER功能丧失或减弱. polβ突变是一种负性显性突变, 可能引起碱基切除修复功能缺陷, 从而可能参与了肿瘤的发生[14]. 在体外突变的polβ可以抑制野生型polβ的BER活性[15]. 缺陷的polβ失去了正常的BER功能, 同时还可能抑制细胞本身野生型polβ的BER功能, 不能修复细胞自发的或内源性的DNA损伤, 引起基因突变的积累, 也增加了原癌基因和抑癌基因突变的积累, 导致增变基因表型.
polβ基因和肿瘤之间的关系正逐渐受到关注, 很多的研究证明他参与了肿瘤的发生和发展, 进一步研究polβ及其在DNA修复中作用的规律和机制, 及其在人类肿瘤中的表达特征已经成为深入研究肿瘤分子机制中一个新的领域, 他将有助于了解肿瘤的发病机制, 对于肿瘤的基因治疗和抗药性以及化疗药物选择方面也会给以有益的提示.
DNA聚合酶β主要功能被认为是参与DNA修复, 他是目前已知碱基切除修复(BER)中最重要的聚合酶之一. 研究结果显示, 在多种肿瘤组织中发现polβ基因的突变和表达异常, 然而对于突变和表达异常的polβ基因其修复功能有无改变, 目前相关资料较少.
石毓君, 副研究员, 四川大学华西医院
polβ是一重要的DNA 修复酶, polβ是BER 过程的重要组成部分, polβ异常的细胞表现为BER的缺乏和对损伤碱基物质敏感性的增加, 也会增加抑癌基因, 原癌基因以及其他控制生长的重要基因的突变频率, 从而增加肿瘤的发生几率.因此进一步研究polβ及其在DNA修复中作用的规律和机制, 及其在人类肿瘤中的表达特征已经成为肿瘤分子机制深入研究中的一个新领域.
有调查显示: 分析90种肿瘤有超过35%的肿瘤存在polβ基因的突变.但关于突变polβ基因的功能改变少有报道. 本实验分析食管癌突变型polβ基因的碱基切除修复功能改变, 并且本实验选用的细胞株是polβ基因敲除的EC9706细胞, 确保发挥作用的是转染细胞的polβ基因, 排除了本底干扰的问题.
本文创新性一般, 实验方法较合理, 结果可靠, 有一定的科学价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Beard WA, Wilson SH. Structure and mechanism of DNA polymerase Beta. Chem Rev. 2006;106:361-382. [PubMed] [DOI] |
| 2. | Sobol RW, Prasad R, Evenski A, Baker A, Yang XP, Horton JK, Wilson SH. The lyase activity of the DNA repair protein beta-polymerase protects from DNA-damage-induced cytotoxicity. Nature. 2000;405:807-810. [PubMed] [DOI] |
| 3. | Matsuda T, Vande Berg BJ, Bebenek K, Osheroff WP, Wilson SH, Kunkel TA. The base substitution fidelity of DNA polymerase beta-dependent single nucleotide base excision repair. J Biol Chem. 2003;278:25947-25951. [PubMed] [DOI] |
| 4. | Bhattacharyya N, Chen HC, Wang L, Banerjee S. Heterogeneity in expression of DNA polymerase beta and DNA repair activity in human tumor cell lines. Gene Expr. 2002;10:115-123. [PubMed] |
| 6. | Starcevic D, Dalal S, Sweasy JB. Is there a link between DNA polymerase beta and cancer? Cell Cycle. 2004;3:998-1001. [PubMed] |
| 7. | Podlutsky AJ, Dianova II, Wilson SH, Bohr VA, Dianov GL. DNA synthesis and dRPase activities of polymerase beta are both essential for single-nucleotide patch base excision repair in mammalian cell extracts. Biochemistry. 2001;40:809-813. [PubMed] [DOI] |
| 8. | Lang T, Maitra M, Starcevic D, Li SX, Sweasy JB. A DNA polymerase beta mutant from colon cancer cells induces mutations. Proc Natl Acad Sci U S A. 2004;101:6074-6079. [PubMed] [DOI] |
| 10. | 赵 国强, 郑 乃刚, 赵 勤, 杨 洪艳, 刘 栋, 赵 继敏, 金 戈, 高 丽, 董 子明. 人食管癌组织中DNA聚合酶β基因突变特点分析. 郑州大学报(医学版). 2003;38:499-500. |
| 11. | Nowak R, Woszczynski M, Siedlecki JA. Changes in the DNA polymerase beta gene expression during development of lung, brain, and testis suggest an involvement of the enzyme in DNA recombination. Exp Cell Res. 1990;191:51-56. [PubMed] [DOI] |
| 13. | 金 戈, 杨 洪艳, 赵 继敏, 黄 幼田, 郑 智敏, 赵 国强, 赵 勤, 吴 景兰, 董 子明. 稳定表达野生型和突变型DNA聚合酶β的NIH3 T3细胞系的建立及其生长特性. 郑州大学学报(医学版). 2005;40:819-822. |
| 14. | Wang L, Patel U, Ghosh L, Banerjee S. DNA polymerase beta mutations in human colorectal cancer. Cancer Res. 1992;52:4824-4827. [PubMed] |