修回日期: 2010-06-08
接受日期: 2010-06-22
在线出版日期: 2010-08-18
目的: 探讨肝癌组织中及肝癌细胞HepG2中HDGF的表达及其意义.
方法: 收集10对配对的新鲜肝癌及其癌旁组织, 提取总RNA, 并用同样的方法提取HepG2细胞的总RNA. 随后利用M-MLV逆转录酶逆转录成cDNA, RT-PCR检测HDGF在肝癌组织、癌旁组织及HepG2细胞中的表达情况. 收集137例肝癌和49例正常对照组织石蜡切片, 免疫组织化学检测HDGF在肝癌与非癌组织之间的差异表达, 并分析该基因表达与肝癌患者临床病理参数之间的关系.
结果: 成功提取肝癌及其癌旁组织和HepG2细胞的总RNA. RT-PCR检测显示在肝癌组织及HepG2细胞中HDGF mRNA表达量都明显高于癌旁临近的非癌组织, 最高分别为癌旁组织的21.11倍和11.39倍. 免疫组织化学分析显示HDGF在肝癌组织中高表达占77.4%, 明显高于正常组织(51.5%, P = 0.011), 且高表达的HDGF与肝癌的临床分期、N分类和T分类呈明显相关(均P<0.05). Cox模型单变量分析显示, N分类、临床分期、HDGF表达水平与患者的生存预后明显相关(P = 0.028, 0.041, 0.000; HR = 1.557, 1.526, 2.316). 多变量分析, HDGF表达水平可以作为独立的预后因素影响疾病的发生及发展(P = 0.000, HR = 0.358). Kaplan-Meier生存分析, 过表达的HDGF可明显缩短患者的生存时间.
结论: 在肝癌组织和HepG2细胞中HDGF高表达. HDGF是肝癌患者一个独立的预后预测因子.
引文著录: 周南翔, 周艳艳, 霍继荣. HDGF在肝癌组织和肝癌细胞HepG2中的表达及其意义. 世界华人消化杂志 2010; 18(23): 2427-2433
Revised: June 8, 2010
Accepted: June 22, 2010
Published online: August 18, 2010
AIM: To investigate the expression of hepatoma-derived growth factor (HDGF) in hepatocellular carcinoma (HCC) tissue and HepG2 cells and to analyze its significance.
METHODS: Ten HCC tissue samples and matched noncancerous tissue samples were collected. The mRNA expression of HDGF in these HCC samples, noncancerous tissue samples and HepG2 cells was detected by real-time RT-PCR. The protein expression of HDGF in 137 HCC tissue samples and 49 normal liver tissue samples was examined by immunohistochemistry. The relationship between HDGF expression and clinicopathological parameters in HCC was then analyzed.
RESULTS: The expression levels of HDGF mRNA were 21.11 and 11.39 times higher in HCC tissue and HepG2 cells than in noncancerous tissue, respectively. The positive rate of HDGF expression in HCC tissue was significantly higher than that in normal liver tissue (77.4% vs 51.5%, P = 0.011). High expression of HDGF protein was positively correlated with T classification, N classification and clinical stage (all P < 0.05) in HCC patients. Univariate Cox analysis showed that HDGF expression, N classification and clinical stage had significant correlation with survival prognosis of HCC patients (P = 0.028, 0.041 and 0.000; HR = 1.557, 1.526 and 2.316, respectively). Multivariate analysis showed that HDGF expression might be an independent prognostic indicator (P = 0.000, HR = 0.358) for the development and progression of HCC. Patients with higher HDGF expression showed a significantly shorter overall survival time than those with low HDGF expression.
CONCLUSION: HDGF is highly expressed in HCC tissue and HepG2 cells. High HDGF expression is an independent prognostic factor in HCC patients. High HDGF expression is associated with poor overall survival in patients with HCC.
- Citation: Zhou NX, Zhou YY, Huo JR. Significance of HDGF expression in hepatocellular carcinoma tissue and HepG2 cells. Shijie Huaren Xiaohua Zazhi 2010; 18(23): 2427-2433
- URL: https://www.wjgnet.com/1009-3079/full/v18/i23/2427.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i23.2427
肝细胞癌(hepatocelluar carcinoma, HCC)的致死率及发病率分别占世界的第3位和第5位, 每年约有600 000患者死于肝癌, 每年新增病例约100万[1]. 我国地属B型肝炎病毒慢性感染率和饮食结构中黄曲霉素暴露率较高的东亚地区, 是肝癌的高发国家, 在世界每年肝癌死亡病例和新增病例中, 我国占全世界的45%和40%以上[2]. 目前引起肝癌发病的因素有多种, 包括病毒性肝炎、黄曲霉素、遗传因素等, 他们导致癌基因的过度表达, 抑癌基因丢失表达, 最终引起肝癌的发生. 肝癌细胞衍生生长因子(hepatoma-derived growth factor, HDGF)是一个肝癌获得性的生长因子, 于1986年由Klagsbrun等[3]首先从肝癌细胞培养上清液中分离, 1994年该基因由Nakamura等克隆[4]. HDGF具有促进细胞增殖、血管生成及营养神经活性, 与包括肝癌在内的多种肿瘤的发生和进展相关[5]. 本研究先通过RT-PCR分析新鲜的肝癌与癌旁组织配对标本和肝癌细胞HepG2中HDGF mRNA的表达情况, 再通过免疫组织化学在蛋白水平分析肝癌和正常组织中该因子的表达情况, 并分析其与肝癌患者临床病理参数之间的关系, 旨在探讨HDGF的临床病理意义.
收集2008-05/2009-06中南大学湘雅二医院经病理诊断为HCC的新鲜肝癌和对应的临近癌旁组织共10对, 液氮冻存后转入-70 ℃冰箱保存. HepG2细胞由中南大学肿瘤研究所保存, 该细胞在RPMI 1640+100 mL/L FBS的生长培基中, 37 ℃、50 mL/L CO2饱和湿度条件下培养生长. 收集2008-12/2009-12中南大学湘雅二医院肝癌137例和对照正常组织石蜡切片49例, 其中肝癌患者患病年龄17-79(中位患病年龄48)岁. 入选者的病史资料齐全. 依照国际抗癌联盟于2002年提出的最新恶性消化系肿瘤的TMN6分期标准[6], 将入选患者的肝癌进行分期. DEPC, TRIzol, 荧光定量PCR试剂盒, Taq酶和DNA marker(大连宝生物公司); TIANScript cDNA第一链合成试剂盒(Tiangen公司); PCR试剂盒, DNA Marker, DEPC(TaKaRa公司); HDGF、内参GAPDH基因PCR引物(上海英骏生物公司); HDGF兔抗人多克隆抗体(武汉三鹰公司); Beta-actin(Santa Cruz 公司); SP超敏试剂盒, 内源性生物素阻断试剂盒, DAB显色液(福州迈新生物技术公司).
1.2.1 提取肝癌组织及其配对癌旁组织, 肝癌细胞HepG2的总RNA: 取组织100 mg研磨至粉末, 加入TRIzol 1 mL混匀, 转入1.5 mL EP管. 取对数生长期肝癌细胞HepG2, 预冷的PBS洗2次, 加入TRIzol 1 mL, 冰上静置10 min后吹打, 将悬液转移到1.5 mL EP管中. 每升TRIzol加氯仿0.2 L, 紧闭离心管, 剧烈摇荡15 s, 室温放置2 min, 4 ℃, 12 000 g, 30 min. 取上层水相转入新的离心管, 等比例加入异丙醇, 上下颠倒10次后, 4 ℃, 12 000 g, 30 min. 弃上清液, 加入1 mL的750 mL/L乙醇, 混匀, 4 ℃, 12 000 g, 10 min. 弃上清, 超净台内室温干燥10 min. 将RNA溶于30 μL DEPC水中, 4 ℃过夜, 分装保存于-80 ℃. 1%琼脂糖凝胶电泳观察RNA质量, 并用紫外分光光度计测定抽提RNA浓度、纯度.
1.2.2 逆转录合成cDNA和实时qPCR反应: 取3 μg总RNA按照逆转录第一链合成试剂盒说明书进行cDNA的合成. RT-PCR法按照试剂盒说明书进行操作, 95 ℃预变性, 95 ℃变性, 上荧光定量仪反应, 检测各模板的Ct值. 采用相对定量法来比较mRNA表达的差异: 以临近癌旁组织GAPDH为内参, 计算肝癌组织的ΔΔCt值, ΔΔCt = (样品目的基因的Ct值-对照目的基因的Ct值)-(样品看家基因的Ct值-对照看家基因的Ct值). 通过2-ΔΔCt法确定各肝癌细胞株中HDGF表达特性, 用单因素方差分析肝细胞、肝癌细胞株之间HDGF的表达差异. PCR引物由上海英骏生物公司合成: GAPDH sense: 5'-GCACCGTCAAGGCTGAGAAC-3'; Antisense: 5'-TGGTGAAGACGCCAGTGGA-3'; HDGF sense: 5'-GAGGGTGACGGTGATAAGAA-3'; Antisense: 5'-GAAACATTGGTGGCTACAGG-3'.
1.2.3 免疫组织化学检测: 石蜡切片常规脱蜡, 入水, 高温高压修复抗原; 滴加内源性过氧化物酶阻断剂, 37 ℃ 10 min, PBS冲洗3次×5 min; 滴加非免疫性动物血清, 37 ℃ 10 min; 弃去非免疫性动物血清; 滴加一抗HDGF多克隆抗体(稀释比例为1:50), 4 ℃过夜, PBS洗3次×5 min; 滴加二抗生物素标记的羊抗鼠/兔IgG(SP试剂盒C液), 37 ℃孵育30 min, PBS洗3次×5 min; 滴加链霉素抗生物素蛋白-过氧化物酶溶液, 37 ℃孵育30 min, PBS洗3次×5 min; 滴加新鲜配制的DAB溶液, 显色5-10 min; 自来水冲洗, 苏木素复染, 酒精脱水, 二甲苯透明, 中性树胶封片. PBS替代一抗作为空白对照, 细胞膜及细胞质中呈现棕黄色颗粒为阳性. HDGF主要以核内表达为主, 该基因也同样在内皮细胞中表达较高. 因此我们评估HDGF表达强度的评价的方法为: 在检测的5个视野中, 每个视野平均有90%以上的细胞为表达阳性, 同时表达水平应相当或高于内皮细胞核表达为HDGF表达指数水平Ⅱ(expression index, EI levels Ⅱ)即高表达(high expression), 反之为表达指数水平Ⅰ(expression index , EI levelsⅠ)即低表达(low expression).
统计学处理 采用SPSS17.0统计软件包进行统计学处理. 荧光定量PCR法检测肝癌细胞株HDGF表达特性, 结果比较采用单因素方差分析, 多重比较采用SNK检验. χ2检测HDGF蛋白表达与临床病理参数之间的相关性. Kaplan-Meier和Log-rank test方法分别绘制和比较生存曲线. Cox风险比例模型分析影响肝癌患者预后的因素.
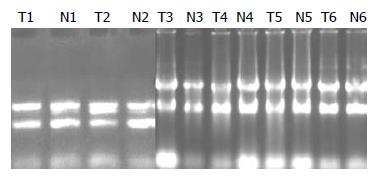
提取的肝癌和其对应的癌旁临近组织, 以及HepG2细胞RNA用1%琼脂糖凝胶电泳检测其完整性. 电泳检测有3条清晰的rRNA带: 28S、18S、5S, 说明RNA无降解, 质量较好(图1).
通过2-ΔΔCt法确定肝癌组织及HepG2细胞HDGF mRNA的表达差异. 我们以HDGF表达最小的癌旁组织N5作为对照, 计算各自组织细胞中HDGF的表达量(表1). 与非癌肝组织相比, 所有的肿瘤组织及HepG2细胞都展示了HDGF高表达, 其中T9样品表达量最高, 为21.11倍. 而HepG2细胞第3高表达为11.39倍.
| 标本样品 | ΔCt | 2-ΔΔCt(folds) |
| N1 | 7.13±0.86 | 1.49 |
| T1 | 4.53±0.32 | 9.06 |
| N2 | 6.95±0.76 | 1.69 |
| T2 | 4.60±0.37 | 8.63 |
| N3 | 6.78±0.37 | 1.90 |
| T3 | 4.35±0.87 | 10.27 |
| N4 | 6.28±1.171 | 2.69 |
| T4 | 4.65±0.58 | 8.34 |
| N5 | 7.71±1.82 | 1.00 |
| T5 | 5.40±1.31 | 4.96 |
| N6 | 6.29±0.51 | 2.67 |
| T6 | 4.77±0.51 | 7.67 |
| N7 | 6.13±1.24 | 2.99 |
| T7 | 4.54±1.08 | 9.00 |
| N8 | 6.85±1.19 | 1.82 |
| T8 | 4.79±0.85 | 7.57 |
| N9 | 6.81±1.01 | 1.87 |
| T9 | 3.31±0.81 | 21.11 |
| N10 | 6.58±0.36 | 2.19 |
| T10 | 3.77±0.71 | 15.35 |
| HepG2 | 4.20±0.35 | 11.39 |
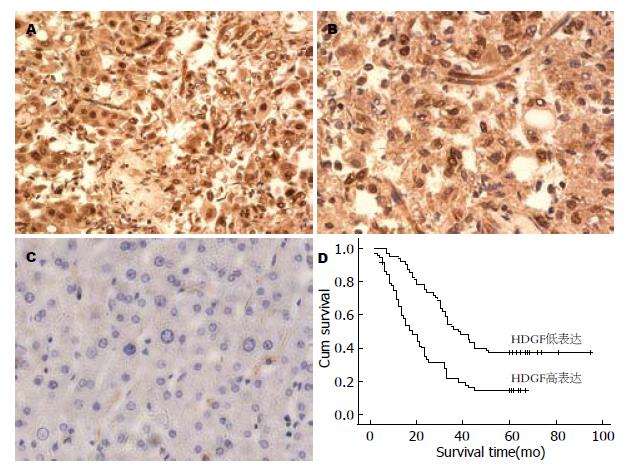
137例肝癌组织和49例正常肝组织中HDGF的表达结果显示, HDGF主要在细胞核中表达, 且肝癌组织HDGF的表达明显比正常组织中高(P = 0.011, 表2).
| 标本分组 | n | HDGF | P值 | |
| 高表达 | 低表达 | |||
| 肝癌组织 | 137 | 73(77.4) | 64(26.6) | |
| 正常肝组织 | 49 | 16(51.5) | 33(48.5) | 0.011 |
HDGF在细胞核中过表达与年龄、性别、是否吸烟、饮酒以及HBV感染、有无远处转移无关, 但与疾病的临床分期、T分类和N分类明显相关(表3).
| 临床病理参数 | n | HDGF | P值 | |
| 高表达 | 低表达 | |||
| 标本分组 | ||||
| 肝癌组织 | 137 | 73(77.4) | 64(26.6) | |
| 正常肝组织 | 49 | 16(51.5) | 33(48.5) | 0.011 |
| 性别 | ||||
| 男 | 87 | 51(81.0) | 36(19.0) | |
| 女 | 50 | 22(43.6) | 28(56.4) | 0.112 |
| 年龄(岁) | ||||
| ≥50 | 69 | 36(75.3) | 33(24.7) | |
| <50 | 68 | 37(47.7) | 31(52.3) | 0.865 |
| 吸烟 | ||||
| 是 | 47 | 24(79.5) | 23(20.5) | |
| 否 | 90 | 49(76.8) | 41(23.2) | 0.722 |
| 饮酒 | ||||
| 是 | 48 | 28(0.0) | 20(0.0) | |
| 否 | 89 | 45(0.0) | 44(0.0) | 0.473 |
| HBV感染 | ||||
| 是 | 103 | 54(0.0) | 49(0.0) | |
| 否 | 34 | 19(0.0) | 15(0.0) | 0.843 |
| T分类 | ||||
| T1-T2 | 98 | 42(73.3) | 56(26.7) | |
| T3-T4 | 39 | 31(87.5) | 8(12.5) | 0.000 |
| N分类 | ||||
| N0-N1 | 64 | 22(66.2) | 42(33.8) | |
| N2-N3 | 73 | 51(86.7) | 22(13.3) | 0.000 |
| 远处转移 | ||||
| 有 | 33 | 22(87.5) | 11(12.5) | |
| 无 | 104 | 51(76.9) | 53(23.1) | 0.109 |
| 临床分期 | ||||
| Ⅰ-Ⅱ | 56 | 11(54.5) | 45(45.5) | |
| Ⅲ-Ⅳ | 81 | 62(89.0) | 19(11.0) | 0.000 |
单变量分析显示, N分类、临床分期、HDGF表达水平与患者的生存预后明显相关(P = 0.028, 0.041, 0.000; HR = 1.557, 1.526, 2.316). 高表达的HDGF, N2, N3和临床分期为Ⅲ、Ⅳ期使肝癌的不良预后的风险增加, 并且是影响其预后的独立因素. 多变量分析, HDGF表达水平可以作为独立的预后因素影响疾病的发生及发展(P = 0.000, HR = 0.358). Kaplan-Meier生存分析, HDGF高表达的HCC患者其最长生存时间为72 mo, 且仅为患者总数的17%, 而HDGF低表达的患者最长生存时间为96 mo, 占总数的38%. 说明高表达的HDGF可明显缩短患者的生存时间(图2, 表4).
| 临床参数 | 单变量分析 | 多变量分析 n(%) | |||||
| P值 | HR | 95%CI | P值 | HR | 95%CI | ||
| ≥50 vs <50 | 0.321 | 1.219 | 0.825-1.801 | ||||
| 性别 | |||||||
| 男vs女 | 0.310 | 1.229 | 0.826-1.829 | ||||
| 吸烟 | |||||||
| 是vs否 | 0.784 | 1.059 | 0.701-1.601 | ||||
| 饮酒 | |||||||
| 是vs否 | 0.468 | 0.861 | 0.574-1.291 | ||||
| HBV感染 | |||||||
| 是vs否 | 0.866 | 1.040 | 0.661-1.634 | ||||
| T分类 | |||||||
| T3-T4vs T1-T2 | 0.390 | 1.202 | 0.790-1.828 | ||||
| N分类 | |||||||
| N2-N3vs N0-N1 | 0.028 | 1.557 | 1.048-2.314 | 0.267 | 0.722 | 0.406-1.283 | |
| M分类 | |||||||
| M0vs M1 | 0.170 | 0.731 | 0.468-1.143 | ||||
| 临床分期 | |||||||
| Ⅲ-Ⅳ vs Ⅰ-Ⅱ | 0.041 | 1.526 | 1.017-2.290 | 0.335 | 1.443 | 0.684-3.044 | |
| HDGF表达指数(EI) | |||||||
| Ⅱ vs Ⅰ | 0.000 | 2.316 | 1.548-3.464 | 0.000 | 0.358 | 0.210-0.610 | |
肝癌与其他肿瘤一样, 是一个多因素参与、多阶段发展的复杂过程. HDGF是HDGF家族的第一位成员, 是一种肝素结合蛋白, 他具有高度保守的N端氨基酸序列, 称其为"hath(homologous to amino terminus of HDGF)"区[6,7]. HDGF通过核定位信号序列转位于细胞核中, 并在诱导细胞生长活性中必不可少, 对某些HCC细胞及成纤维细胞, 内皮细胞, 血管平滑肌细胞, 胚胎肝细胞具有促有丝分裂的作用[4,8-10], 研究表明HDGF是在肝脏的再生的DNA合成前的一种重要的自分泌因子, 能够促进肝组织的再生[11]. HDGF在多种肿瘤细胞中高表达, 并与肿瘤的不良预后密切相关. Ren等[12]的研究表明, HDGF在肺癌中过表达, 与其侵袭性生物学行为和不良临床预后相关, 并证实HDGF的多克隆抗体对于肺癌细胞A549的异种移植瘤模型具有抗肿瘤活性. Yamamoto等[13]对于食管癌的研究也表明, HDGF的表达情况是评价早期食管癌(1-2期)预后的独立因素, 但不能作为评价进展期食管癌(3-4期)的独立因素. Mao等[14]的研究表明HDGF的高表达将通过Erk1/2的活化和促进细胞锚定非依赖性生长而促使胃上皮肿瘤化, 且与胃癌的低分化和淋巴转移倾向相关. 廖斐等[15]通过siRNA抑制HDGF mRNA和蛋白质的表达, 发现其可能通过下调PCNA的表达和抑制p-ERK1/2蛋白活化而抑制大肠癌LoVo细胞的增殖. Tsang等[16,17]研究证实, 敲低HDGF表达的HepG2细胞, 促凋亡蛋白Bad的表达上调并且有ERK和Akt的激活, 导致细胞固有性凋亡途径被激活, 同时还通过NF-κB信号通路激活Fas而诱导非固有凋亡途径, HDGF可能是肿瘤细胞的生存因子并将成为肿瘤治疗的靶点之一. Yamamoto等[18]最近的研究证实VitK2正是通过抑制HDGF的mRNA和蛋白的表达对肝癌细胞HepG2具有剂量依赖性抑制增殖作用.
目前关于HDGF在中国肝癌患者中的表达研究报道不多, 在本研究中, 首先利用实时荧光定量PCR技术比较了10对配对的肝癌与其临近的非癌肝组织, 以及HepG2细胞中HDGF表达水平. 结果显示, 与非癌肝组织相比, 所有的肿瘤组织及HepG2细胞都显示HDGF明显高表达(较非癌肝组织高), 其中T9样品表达量最高, 为21.11倍. 而HepG2细胞第3高表达为11.39倍. 对于137个HCC患者和49个非癌正常肝组织标本的免疫组织化学结果显示, HDGF主要在核中表达, 胞质也部分表达. 统计分析显示, HDGF蛋白表达也和mRNA表达水平类似, 明显在癌组织中高表达(P = 0.011). Enomoto等[19]发现HDGF的过表达能够部分抑制小鼠肝细胞的成熟分化. Okuda等将HDGF基因导入NIH3T3细胞中[20], 稳定高表达HDGF蛋白虽然不能对细胞在软琼脂分析中产生重要的锚定非依赖生长, 但该细胞却在裸鼠中产生了肉瘤样肿瘤, CD31免疫组织化学分析该组织发现产生了许多的新生血管. 瞬时转染发现, HDGF能促进VEGF基因的表达明显增高. Chang等[21]免疫组织化学分析52例大肠基质肿瘤HDGF表达. 核高表达的HDGF正向相关于肿瘤有丝分裂细胞计数、肿瘤大小、PCNA和Ki-67表达、细胞多形性现象和NIH风险水平. 此外, 核和胞质HDGF高表达的患者无病生存期明显减少. 日本Yoshida等[22]通过HDGF抗体研究发现HDGF在肝癌细胞的胞核与胞质中的表达远高于癌周正常肝细胞, 在肿瘤中的表达也大大高于临近脂肪肝或脂肪肝. 在肝癌FLS小鼠模型建立中也发现, HDGF的表达在肿瘤形成的早期就已经增高, 他能够加强DNA合成及细胞中脂滴微粒的形成从而激活巨噬细胞集落. 说明HDGF是在FLS小鼠中可能是通过旁分泌的方式而从受到刺激的肝细胞中释放或分泌, 并通过自分泌的方式刺激肝肿瘤细胞的生长. 以上研究报道都证实HDGF在肿瘤的发生, 发展中起到了重要作用, 本阶段试验的结果也提示, HDGF的高表达可能与中国人肝癌发生有密切关系.
目前, 在以HepG2为研究对象对HDGF促使肿瘤发生的作用机制研究中发现, 过表达的HDGF不但能加快细胞的增殖, 还能促进细胞的恶性转化. 在抑制HDGF表达后能抑制肿瘤细胞生长, 并促使细胞发生凋亡. Hu等[23]利用反义寡核苷酸抑制敲低HDGF表达不但可以抑制HepG2细胞的生长, 而且还能抑制HDGF表达同时诱导HepG2细胞和其他肿瘤细胞发生凋亡. 进一步研究机制发现, 抑制HDGF表达可以促进细胞中促凋亡蛋白Bad表达, 也使ERK和Akt失活, 这种方式又反过来促使Bad蛋白上的Ser-112核Ser-136发生去磷酸化, 然后激活内在的凋亡信号通路, 如线粒体膜去极化、线粒体细胞色素C(Cyt C)释放以及激活caspase-9和3, 加快促凋亡的过程. Abouzied等[24]还在HepG2细胞中敲低HDGF表达后, 通过NF-κB信号通路触发Fas介导的外部凋亡信号转导通路. 降低的HDGF表达能增加Fas启动子活性和Fas的表达. 抑制Fas表达能减轻抑制HDGF表达后细胞凋亡的诱导和生长抑制. 通过BAY11-7082抑制NF-κB表达, 能减少HDGF敲低表达后对于Fas启动子活性的影响, 增加Fas的表达、凋亡的诱导和生长的抑制. 结合本试验研究结果, 可以推测HDGF在中国人肝癌的发展过程中起到了重要的作用. 即肝癌组织和HepG2细胞中HDGF的高表达, 既可能是肝癌的诱发和促进因素之一, 也有可能是肝癌发生和进展的结果表现, 这与肝细胞在DNA复制前能够自分泌HDGF的特点相符合[11].
国内外多种肿瘤研究中表明HDGF是一个独立的预后预测因子, 其中也包括了肝癌. Yoshida等[25]对于100位接受了手术治疗的HCC患者的肝癌标本进行免疫组织化学分析HDGF表达, 并对其中10例进行RT-PCR检测mRNA表达情况. 生存分析和多因素分析显示, HDGF指数阳性(>90%的肝癌细胞中核及胞质中均有阳性染色)的患者无瘤生存和总生存率明显低于HDGF指数阴性(除前者以外)的患者, 提示HDGF是评价HCC预后的较好指标. Hu等[26]对105例HCC标本应用免疫染色检验HDGF表明, 其在肝癌细胞核中的表达与患者的临床分期相关, 并可以作为HCC患者术后评估无病和总生存率的新的预后指标之一. 本研究发现, 过表达的HDGF与肝癌的临床分期、N分类和T分类(均P = 0.000)明显相关. 生存曲线分析发现, HDGF的表达与患者的预后明显相关. HDGF表达越高, 患者的生存时间愈短. Cox回归模型分析显示, 过表达的HDGF可作为中国肝癌患者独立的预后因子.
总之, HDGF参与了中国人肝癌的发生和进展, 其表达水平与临床病理指标和预后有一定关系, 可作为肝癌患者预后的指标之一.
HDGF是HDGF家族的第一位成员, 是一种肝素结合蛋白, 他具有高度保守的N端氨基酸序列, 称其为"hath"区. HDGF通过核定位信号序列转位于细胞核中, 并在诱导细胞生长活性中必不可少. HDGF是在肝脏再生的DNA合成前的一种重要的自分泌因子, 能够促进肝组织的再生. HDGF在多种肿瘤细胞中高表达, 并与肿瘤的不良预后密切相关.
秦成勇, 教授, 山东省立医院消化内科
研究表明HDGF是在肝脏的再生的DNA合成前的一种重要的自分泌因子, 能够促进肝组织的再生. HDGF在多种肿瘤细胞中高表达, 并与肿瘤的不良预后密切相关.
Ren等的研究表明, HDGF在肺癌中过表达, 与其侵袭性生物学行为和不良临床预后相关, 并证实HDGF的多克隆抗体对于肺癌细胞A549的异种移植瘤模型具有抗肿瘤活性.
目前关于HDGF在中国肝癌患者中的表达研究报道不多, 在本研究中, 首先利用实时荧光定量PCR技术比较了10对配对的肝癌与其临近的非癌肝组织, 以及HepG2细胞中HDGF表达水平.
HDGF参与了中国人肝癌的发生和进展, 其表达水平与临床病理指标和预后有一定关系, 可作为肝癌患者预后的指标之一.
本文设计合理, 方法先进, 具有一定的临床参考价值.
编辑: 曹丽鸥 电编:吴鹏朕
| 1. | Schütte K, Bornschein J, Malfertheiner P. Hepatocellular carcinoma--epidemiological trends and risk factors. Dig Dis. 2009;27:80-92. [PubMed] [DOI] |
| 2. | 韩 泽广. 肝癌基因组学研究进展. 中国科学C辑: 生命科学. 2008;38:907-912. |
| 3. | Klagsbrun M, Sasse J, Sullivan R, Smith JA. Human tumor cells synthesize an endothelial cell growth factor that is structurally related to basic fibroblast growth factor. Proc Natl Acad Sci U S A. 1986;83:2448-2452. [PubMed] [DOI] |
| 4. | Nakamura H, Izumoto Y, Kambe H, Kuroda T, Mori T, Kawamura K, Yamamoto H, Kishimoto T. Molecular cloning of complementary DNA for a novel human hepatoma-derived growth factor. Its homology with high mobility group-1 protein. J Biol Chem. 1994;269:25143-25149. [PubMed] |
| 5. | Abouzied MM, El-Tahir HM, Prenner L, Häberlein H, Gieselmann V, Franken S. Hepatoma-derived growth factor. Significance of amino acid residues 81-100 in cell surface interaction and proliferative activity. J Biol Chem. 2005;280:10945-10954. [PubMed] [DOI] |
| 6. | International Union Against Cancer (UICC). Sobin LH, Wittekind C, editors. TNM classifiction of malignant tumors. New York: Wiley-Liss 2002; 81-83. |
| 7. | Izumoto Y, Kuroda T, Harada H, Kishimoto T, Nakamura H. Hepatoma-derived growth factor belongs to a gene family in mice showing significant homology in the amino terminus. Biochem Biophys Res Commun. 1997;238:26-32. [PubMed] [DOI] |
| 8. | Kishima Y, Yamamoto H, Izumoto Y, Yoshida K, Enomoto H, Yamamoto M, Kuroda T, Ito H, Yoshizaki K, Nakamura H. Hepatoma-derived growth factor stimulates cell growth after translocation to the nucleus by nuclear localization signals. J Biol Chem. 2002;277:10315-10322. [PubMed] [DOI] |
| 9. | Everett AD, Stoops T, McNamara CA. Nuclear targeting is required for hepatoma-derived growth factor-stimulated mitogenesis in vascular smooth muscle cells. J Biol Chem. 2001;276:37564-37568. [PubMed] [DOI] |
| 10. | Enomoto H, Yoshida K, Kishima Y, Kinoshita T, Yamamoto M, Everett AD, Miyajima A, Nakamura H. Hepatoma-derived growth factor is highly expressed in developing liver and promotes fetal hepatocyte proliferation. Hepatology. 2002;36:1519-1527. [PubMed] |
| 11. | Enomoto H, Nakamura H, Liu W, Yoshida K, Okuda Y, Imanishi H, Saito M, Shimomura S, Hada T, Nishiguchi S. Hepatoma-derived growth factor is induced in liver regeneration. Hepatol Res. 2009;39:988-997. [PubMed] [DOI] |
| 12. | Ren H, Chu Z, Mao L. Antibodies targeting hepatoma-derived growth factor as a novel strategy in treating lung cancer. Mol Cancer Ther. 2009; May 12. [Epub ahead of print]. [PubMed] |
| 13. | Yamamoto S, Tomita Y, Hoshida Y, Morii E, Yasuda T, Doki Y, Aozasa K, Uyama H, Nakamura H, Monden M. Expression level of hepatoma-derived growth factor correlates with tumor recurrence of esophageal carcinoma. Ann Surg Oncol. 2007;14:2141-2149. [PubMed] [DOI] |
| 14. | Mao J, Xu Z, Fang Y, Wang H, Xu J, Ye J, Zheng S, Zhu Y. Hepatoma-derived growth factor involved in the carcinogenesis of gastric epithelial cells through promotion of cell proliferation by Erk1/2 activation. Cancer Sci. 2008;99:2120-2127. [PubMed] [DOI] |
| 16. | Tsang TY, Tang WY, Tsang WP, Co NN, Kong SK, Kwok TT. Downregulation of hepatoma-derived growth factor activates the Bad-mediated apoptotic pathway in human cancer cells. Apoptosis. 2008;13:1135-1147. [PubMed] [DOI] |
| 17. | Tsang TY, Tang WY, Tsang WP, Co NN, Kong SK, Kwok TT. Mechanistic study on growth suppression and apoptosis induction by targeting hepatoma-derived growth factor in human hepatocellular carcinoma HepG2 cells. Cell Physiol Biochem. 2009;24:253-262. [PubMed] [DOI] |
| 18. | Yamamoto T, Nakamura H, Liu W, Cao K, Yoshikawa S, Enomoto H, Iwata Y, Koh N, Saito M, Imanishi H. Involvement of hepatoma-derived growth factor in the growth inhibition of hepatocellular carcinoma cells by vitamin K(2). J Gastroenterol. 2009;44:228-235. [PubMed] [DOI] |
| 19. | Clermont F, Gonzalez NS, Communi D, Franken S, Dumont JE, Robaye B. HDGF is dephosphorylated during the early steps of endothelial cell apoptosis in a caspase-dependent way. J Cell Biochem. 2008;104:1161-1171. [PubMed] [DOI] |
| 20. | Enomoto H, Nakamura H, Komatsu-Kanatani N, Liu Y, Yoshida K, Okuda Y, Yamamoto T, Liu WD, Nishiguchi S. Partial blockage of hepatocyte maturation in hepatoma-derived growth factor transgenic mice. World J Hepatol. 2009;1:98-102. [DOI] |
| 21. | Chang KC, Tai MH, Lin JW, Wang CC, Huang CC, Hung CH, Chen CH, Lu SN, Lee CM, Changchien CS. Hepatoma- derived growth factor is a novel prognostic factor for gastrointestinal stromal tumors. Int J Cancer. 2007;121:1059-1065. [PubMed] [DOI] |
| 22. | Yoshida K, Nakamura H, Okuda Y, Enomoto H, Kishima Y, Uyama H, Ito H, Hirasawa T, Inagaki S, Kawase I. Expression of hepatoma-derived growth factor in hepatocarcinogenesis. J Gastroenterol Hepatol. 2003;18:1293-1301. [PubMed] [DOI] |
| 23. | Hu TH, Lin JW, Chen HH, Liu LF, Chuah SK, Tai MH. The expression and prognostic role of hepatoma-derived growth factor in colorectal stromal tumors. Dis Colon Rectum. 2009;52:319-326. [PubMed] |
| 24. | Abouzied MM, El-Tahir HM, Prenner L, Häberlein H, Gieselmann V, Franken S. Hepatoma-derived growth factor. Significance of amino acid residues 81-100 in cell surface interaction and proliferative activity. J Biol Chem. 2005;280:10945-10954. [PubMed] [DOI] |
| 25. | Yoshida K, Tomita Y, Okuda Y, Yamamoto S, Enomoto H, Uyama H, Ito H, Hoshida Y, Aozasa K, Nagano H. Hepatoma-derived growth factor is a novel prognostic factor for hepatocellular carcinoma. Ann Surg Oncol. 2006;13:159-167. [PubMed] [DOI] |