修回日期: 2010-07-05
接受日期: 2010-07-12
在线出版日期: 2010-08-18
目的: 探讨FAF1 mRNA在胃癌组织中的表达水平及其临床意义以及与幽门螺杆菌(Helicobacter pylori, H.pylori)感染的相关性.
方法: 应用实时荧光定量逆转录聚合酶链反应(RT-PCR)技术对40例胃癌患者及相应正常胃黏膜组织中的FAF1 mRNA进行定量检测, 以β-actin为内参照. H.pylori采用HE染色、甲苯胺蓝染色和Warthin-Starry银染法进行检测.
结果: 胃癌组织中FAF1 mRNA的表达明显低于相应正常胃黏膜组织(0.27±0.12 vs 0.48±0.08, P<0.05). 高、中分化的胃癌组织FAF1 mRNA表达值明显高于低、未分化的胃癌组织(0.39±0.06 vs 0.19±0.06, t = 9.966, P<0.01). 有远处转移的胃癌组织FAF1 mRNA表达值低于无远处转移的胃癌组织(0.25±0.11 vs 0.34±0.14, t = -2.753, P<0.01), 而FAF1 mRNA表达水平在浸润深度、有无淋巴结转移、肿瘤大小及临床分期不同的胃癌组织中无显著性差异. FAF1 mRNA表达量在H.pylori阳性胃癌组织中明显低于H.pylori阴性(0.18±0.06 vs 0.29±0.12, P<0.05). FAF1表达量在H.pylori阳性正常胃黏膜组织中与H.pylori阴性比较无显著差异(0.49±0.08 vs 0.47±0.11, t = 0.6515, P>0.05).
结论: FAF1基因的表达异常可能与胃癌的发生发展有关, H.pylori感染可能通过下调FAF1基因的表达而发挥致癌作用.
引文著录: 刘爱群, 葛莲英, 罗小玲, 罗元, 林思彤. FAF1 mRNA在胃癌组织中的表达及其与幽门螺杆菌感染的相关性. 世界华人消化杂志 2010; 18(23): 2422-2426
Revised: July 5, 2010
Accepted: July 12, 2010
Published online: August 18, 2010
AIM: To investigate the expression of Fas-associated factor 1 (FAF1) mRNA and to analyze its relationship with Helicobacter pylori (H.pylori) infection in gastric cancer.
METHODS: Real-time fluorescent quantitative reverse transcription-polymerase chain reaction (RT-PCR) was used to detect the expression of FAF1 mRNA in 40 gastric cancer specimens and matched normal gastric mucosa tissue specimens. The β-actin gene was used as a reference for normalization of FAF1 expression level. H.pylori infection was detected by HE Staining, toluidine blue staining and Warthin-Starry silver staining.
RESULTS: The expression level of FAF1 mRNA was significantly lower in gastric cancer than in corresponding normal gastric mucosa tissue (0.27 ± 0.12 vs 0.48 ± 0.08, P < 0.05). The expression level of FAF1 mRNA in well-differentiated cancer tissue was higher than that in poorly differentiated cancer tissue (0.39 ± 0.06 vs 0.19 ± 0.06, t = 9.966, P < 0.01). The expression level of FAF1 mRNA was significantly lower in gastric cancer with distant metastasis than in that without distant metastasis (0.25 ± 0.11 vs 0.34 ± 0.14, t = 2.753, P < 0.01). The expression of FAF1 mRNA showed no obvious relationship with tumor size, infiltration degree, stage, and lymph node metastasis in gastric cancer. The expression level of FAF1 in H.pylori-positive patients was lower than that in H.pylori-negative patients (0.18 ± 0.06 vs 0.29 ± 0.12, P < 0.05), whereas FAF1 expression had no significant correlation with H.pylori infection in normal gastric mucosa tissue (0.49 ± 0.08 vs 0.47 ± 0.11, t = 0.6515, P > 0.05).
CONCLUSION: Abnormal expression of the FAF1 gene may be related to the carcinogenesis and development of gastric cancer, and the expression level of FAF1 gene can be down-regulated by H.pylori infection during gastric carcinogenesis.
- Citation: Liu AQ, Ge LY, Luo XL, Luo Y, Lin ST. Relationship between FAF1 mRNA expression and Helicobacter pylori infection in gastric cancer. Shijie Huaren Xiaohua Zazhi 2010; 18(23): 2422-2426
- URL: https://www.wjgnet.com/1009-3079/full/v18/i23/2422.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i23.2422
近来研究表明, 肿瘤不仅是增殖和分化异常的疾病, 也是细胞凋亡异常的疾病, 细胞凋亡状态及其调控基因的异常, 参与肿瘤的发生、发展[1]. Fas相关因子1(Fas-associated factor 1, FAF1)是新近发现的一种能够增强Fas诱导凋亡作用的蛋白, 且在胃癌组织中有特异性低表达[2]. 幽门螺杆菌(Helicobacter pylori, H.pylori)感染与胃癌的发生关系密切, 被WHO确认为第Ⅰ类致癌因子. 然而, 其致癌的确切机制至今还不是很清楚. 关于FAF1在H.pylori感染所致胃癌变过程中的表达改变及机制, 国内外尚未见相关报道. 本研究采用实时荧光定量RT-PCR技术检测在胃癌组织及相对正常胃黏膜组织中FAF1 mRNA表达水平, 探讨FAF1基因与胃癌发生、发展的关系, 并同时进行H.pylori感染检测, 进一步了解胃癌发生发展的分子机制.
收集2005-06/2006-04广西医科大学附属肿瘤医院及广西壮族自治区人民医院胃癌根治性手术切除并有完整检查资料的胃癌标本40例. 其中男29例, 女11例, 年龄34-78(中位年龄55)岁, 所有病例术前均未进行放疗和化疗或免疫治疗. 胃癌组织取自原发灶中央非坏死部分, 正常胃黏膜组织取自距离肿瘤原发灶≥5 cm处, 所有病例均经病理检查证实. 胃癌组织标本经液氮浸泡5 min, 后放入-80 ℃冰箱低温保存. 后经10%中性甲醛溶液固定, 石蜡包埋, 然后制备4 μm厚连续切片. H.pylori感染分别用HE染色、美蓝染色、Warthin-Starry(W-S)银染3种方法检测, 其中3种方法中两种及以上者为H.pylori阳性, 标本取胃窦区正常黏膜, 若胃窦为肿瘤组织, 则取周围经病理检查证实的正常胃黏膜检测. 引物采用Primer 5软件设计, FAF1上游引物: 5'-cttgctgaatcagggctctc-3', FAF1下游引物:5'-tccaccccaaattctgtagc-3', 扩增片段长度为164 bp, 内参β-actin上游引物: 5'-accgagcgcggctacagc-3', β-actin下游引物: 5'-ctcattgccaatggtgat-3', 扩增长度为180 bp, 所有引物均由上海生工生物技术有限公司合成. 定量PCR试剂盒为美国QIAGENE公司产品.
取0.05-0.1 g胃组织采用TRIzol法提取总RNA. 将上述提取的完整的总RNA按试剂说明书操作逆转录合成cDNA. 取上述逆转录反应产物cDNA 2 μL, 加2×Quanti Tect SYBR Green PCR buffer 12.5 μL, 10 μmol/L上下游引物各0.75 μL, RNase-free Water 9 μL(25 μL反应总体积)进行定量PCR. 反应条件: 94 ℃ 5 min预变性, 94 ℃ 45 s, 55 ℃ 45 s, 72 ℃ 60 s, 35个循环, 72 ℃ 10 min末延伸. 55 ℃采集光源, β-actin作为内参照, 每份样本均根据β-actin的拷贝数进行校正. 结果的计算: ΔΔCt = (样品Ct均值-内参照Ct均值)-(对照样品Ct均值-对照内参照Ct均值), 然后取2-ΔΔct即代表被检样品初始FAF1 mRNA的含量.
统计学处理 采用SPSS15.0软件进行统计学分析. FAF1 mRNA的相对含量以mean±SD表示. 统计学方法采用单因素方差分析及t检验, 方差不齐用t'检验, 以P<0.05为差异有统计学意义.
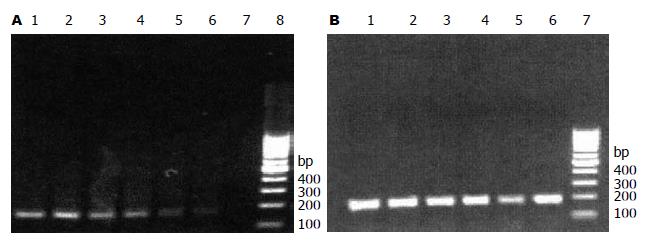
胃癌组织和相对正常胃黏膜组织中均检测到FAF1及β-actin基因的表达(图1, 2). 胃癌组织及正常胃黏膜组织中FAF1 mRNA的含量分别为0.27±0.12、0.48±0.08, 两组间相比差异有显著性(P<0.05).
高中分化的胃癌组织、低未分化的胃癌组织中FAF1 mRNA含量分别为0.39±0.06、0.19±0.06, 两组间相比差异有显著性(t = 9.966, P<0.01); 有远处转移的胃癌组织、无远处转移的胃癌组织中FAF1 mRNA含量分别为0.19±0.07、0.29±0.12, 两组间相比差异有显著性(t = -2.753, P<0.01), 而FAF1 mRNA表达水平在浸润深度、有无淋巴结转移、肿瘤大小及临床分期不同的胃癌组织中无显著性差异(表1).
| 临床参数 | n | FAF1 mRNA | t值 | P值 |
| 浸润深度 | 1.090 | 0.283 | ||
| 浆膜内 | 7 | 0.30±0.12 | ||
| 浆膜及浆膜外 33 | 0.25±0.11 | |||
| 临床分期 | 1.568 | 0.125 | ||
| Ⅰ、Ⅱ | 8 | 0.32±0.12 | ||
| Ⅲ、Ⅳ | 32 | 0.25±0.11 | ||
| 肿瘤直径(cm) | 0.100 | 0.921 | ||
| ≥5 | 18 | 0.26±0.11 | ||
| <5 | 22 | 0.26±0.12 | ||
| 淋巴结转移 | 1.266 | 0.213 | ||
| 有 | 3 | 0.34±0.14 | ||
| 无 | 37 | 0.25±0.11 | ||
| 远处转移 | -2.753 | 0.009 | ||
| 有 | 12 | 0.19±0.07 | ||
| 无 | 28 | 0.29±0.12 | ||
| 分化程度 | 9.966 | 0.000 | ||
| 高、中分化 | 14 | 0.39±0.06 | ||
| 低、未分化 | 26 | 0.19±0.06 | ||
40例患者中H.pylori感染率为(21/40, 52.50%). H.pylori常位于胃黏膜腺体隐窝处, 聚集存在, 镜下呈淡蓝色、棕黑色、淡紫色短棒状(图3). 在H.pylori阳性和H.pylori阴性胃癌中, FAF1 mRNA含量分别为0.18±0.06和0.29±0.12, H.pylori阳性者明显低于H.pylori阴性, 二者之间有显著性差异(t = 3.6084, P<0.05). 在H.pylori阳性和H.pylori阴性正常胃黏膜组织中, FAF1含量分别为0.49±0.08和0.47±0.11, 二者之间无显著差异(t = 0.6515, P>0.05).
FAF1是新近发现的Fas死亡信号结合体的成员之一, 其N-末端区域能与Fas特异性的结合, 他是能够增强Fas介导细胞凋亡的蛋白分子[3-6], 他编码的一种蛋白牵涉肿瘤细胞的存活和人类一些肿瘤的发病[7]. 甚至在缺乏任何外来死亡信号的情况下, FAF1过表达也会启动细胞凋亡[8]. 除了与Fas相互作用之外, FAF1也是蛋白激酶CK2的调节亚单位的成员之一[2], 二者相互结合成复合物,当受到DNA损伤刺激时其诱导凋亡作用显著增加[9]. 目前对FAF1与癌症的关系的研究还很少. 更令人感兴趣的是, Bjørling-Poulsen等[2]在对各种不同组织来源的肿瘤用Western blot检测中发现, FAF1只在胃癌组织中特异低表达尤其是在含印戒细胞的胃癌组织中. 这提示FAF1可作为胃癌比较特异的诊断指标. 因此研究胃癌组织中的FAF1的表达水平的改变可望为胃癌的基因治疗提供一个新的靶基因. 本研究采用比较敏感的荧光实时定量PCR法检测了40例患者胃癌和正常胃黏膜组织中FAF1 mRNA的水平, 并进一步分析他们的表达与临床指标的关系. 结果表明, FAF1 mRNA在癌组织中的表达水平明显低于正常组织, 并与肿瘤的分化程度、有无远处转移等临床病程特征有着明显的关联: 高中分化胃癌患者的FAF1 mRNA表达值显著高于低、未分化患者; 无远处转移的高于有远处转移, 这说明FAF1与胃癌细胞的分化及生存预后具有重要的关系, 他可能作为一个抑癌基因参与胃癌的发生发展过程.
H.pylori是人类胃癌的Ⅰ类致癌原, 在胃癌的发生发展中起重要致病作用, 但其致病的确切机制不清. H.pylori在胃内的寄居部位与胃癌的好发部位一致, 这些结论也显示了两者的相关性. 临床流行病学资料显示: 在H.pylori感染的高风险人群中进行根治性治疗能明显降低胃癌的危险率[10,11]. 一般认为H.pylori感染是胃癌发生发展进程中的首要推动因子. H.pylori感染后, 增加了胃黏膜的损伤程度和敏感性, 使细胞具备了向恶性方向转化的条件. 一些学者应用cDNA array分析了H.pylori诱导的胃上皮细胞基因表达谱的变化, 表明在H.pylori的刺激下, 胃癌细胞株有21个基因上调和17个基因下调. 对基因表达变化的进一步研究, 将有助于了解宿主细胞的抵抗策略和适应性变化的根本机制, 从而为干预有关环节, 减轻宿主细胞对H.pylori的易感性提供新的思路[12]. 胃癌的发生是多阶段、多基因调控的进展性过程. H.pylori感染不仅能够诱导胃黏膜上皮细胞的增殖, 同时诱导其凋亡, 凋亡的增加进一步引起胃上皮细胞代偿性过度增殖, 当细胞增殖速率超过凋亡时, 细胞凋亡被抑制, 使异常细胞被清除的能力降低, 而且处于过度增殖状态的细胞更易受到致癌物质的损伤, 从而增加了DNA畸变的危险, 最终可能导致胃癌的发生[13,14]. 本研究实验结果为40例胃癌标本中, H.pylori感染率达到52.50%, 比国内外一些文献报道低[15,16], 可能与本研究样本例数较少有关. 本研究在检测过程中发现H.pylori感染存在于胃黏膜表面黏液中、细胞表面、胃小凹、腺腔以及癌旁组织中, 而癌组织内少见H.pylori, 其可能原因是胃癌组织中的微环境不适合H.pylori生长, 或者是胃癌组织释放了某种破坏因子使局部H.pylori破坏崩解所致, 这与文献报道较为一致[17]. H.pylori感染导致胃癌的途径有很多种[18-20], 尚有待我们的进一步研究, 而对H.pylori感染与胃癌中特异性低表达基因的研究将具有重要的意义.
在40例胃癌标本中H.pylori感染阳性组与阴性组相比, 前者FAF1阳性表达率明显低于后者(P<0.05), 而在相应的正常胃黏膜组织中表达无明显差异. 表明H.pylori感染通过调控FAF1基因的表达使其明显下调, 从而使癌细胞凋亡减少, 细胞生存期延长, 细胞数量增加并进一步促进细胞增殖, 从而影响细胞凋亡与增殖的平衡, 使胃癌细胞获得恶性转化的潜能与特征, 促进了胃癌的发生发展, 在一定程度上两者呈负相关. 同时在本研究中我们发现了这样一个可能, 即FAF1在胃癌中的减少表达或许是逃避凋亡的另外一种途径. 随着分子生物学的发展, 应用一些基因的敲除或敲入技术, 沉默癌基因和H.pylori或激活抑癌基因, 相信会成为治疗胃癌的一个有效手段.
胃癌的发生是多阶段、多基因调控的进展性过程. H.pylori感染不仅能够诱导胃黏膜上皮细胞的增殖, 同时诱导其凋亡, 凋亡的增加进一步引起胃上皮细胞代偿性过度增殖, 当细胞增殖速率超过凋亡时, 细胞凋亡被抑制, 使异常细胞被清除的能力降低, 而且处于过度增殖状态的细胞更易受到致癌物质的损伤, 从而增加了DNA畸变的危险, 最终可能导致胃癌的发生.
关玉盘, 教授, 首都医科大学附属北京朝阳医院消化科
Bjørling-Poulsen等在对各种不同组织来源的肿瘤用Western blot检测中发现, FAF1只在胃癌组织中特异低表达, 尤其是在含印戒细胞的胃癌组织中.
国内外尚未见有关FAF1在H.pylori感染所致胃癌变过程中的表达及机制的报道,而本研究采用比较敏感的荧光实时定量PCR法检测了40例患者胃癌和正常胃黏膜组织中FAF1 mRNA的水平, 并进一步分析他们的表达与临床指标的关系.
本文选题新颖, 设计可靠, 结论明确, 具有一定的科学性、可读性和临床科研价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Thompson CB. Apoptosis in the pathogenesis and treatment of disease. Science. 1995;267:1456-1462. [PubMed] [DOI] |
| 2. | Bjørling-Poulsen M, Seitz G, Guerra B, Issinger OG. The pro-apoptotic FAS-associated factor 1 is specifically reduced in human gastric carcinomas. Int J Oncol. 2003;23:1015-1023. [PubMed] |
| 3. | Chu K, Niu X, Williams LT. A Fas-associated protein factor, FAF1, potentiates Fas-mediated apoptosis. Proc Natl Acad Sci U S A. 1995;92:11894-11898. [PubMed] [DOI] |
| 4. | Ryu SW, Lee SJ, Park MY, Jun JI, Jung YK, Kim E. Fas-associated factor 1, FAF1, is a member of Fas death-inducing signaling complex. J Biol Chem. 2003;278:24003-24010. [PubMed] [DOI] |
| 5. | De Zio D, Ferraro E, D'Amelio M, Simoni V, Bordi M, Soroldoni D, Berghella L, Meyer BI, Cecconi F. Faf1 is expressed during neurodevelopment and is involved in Apaf1-dependent caspase-3 activation in proneural cells. Cell Mol Life Sci. 2008;65:1780-1790. [PubMed] [DOI] |
| 6. | Adham IM, Khulan J, Held T, Schmidt B, Meyer BI, Meinhardt A, Engel W. Fas-associated factor (FAF1) is required for the early cleavage-stages of mouse embryo. Mol Hum Reprod. 2008;14:207-213. [PubMed] [DOI] |
| 7. | Altomare DA, Menges CW, Pei J, Zhang L, Skele-Stump KL, Carbone M, Kane AB, Testa JR. Activated TNF-alpha/NF- kappaB signaling via down-regulation of Fas-associated factor 1 in asbestos-induced mesotheliomas from Arf knockout mice. Proc Natl Acad Sci U S A. 2009;106:3420-3425. [PubMed] [DOI] |
| 8. | Park MY, Ryu SW, Kim KD, Lim JS, Lee ZW, Kim E. Fas-associated factor-1 mediates chemotherapeutic-induced apoptosis via death effector filament formation. Int J Cancer. 2005;115:412-418. [PubMed] [DOI] |
| 9. | Guerra B, Boldyreff B, Issinger OG. FAS-associated factor 1 interacts with protein kinase CK2 in vivo upon apoptosis induction. Int J Oncol. 2001;19:1117-1126. [PubMed] |
| 10. | Cheung TK, Xia HH, Wong BC. Helicobacter pylori eradication for gastric cancer prevention. J Gastroenterol. 2007;42 Suppl 17:10-15. [PubMed] [DOI] |
| 11. | Fukase K, Kato M, Kikuchi S, Inoue K, Uemura N, Okamoto S, Terao S, Amagai K, Hayashi S, Asaka M. Effect of eradication of Helicobacter pylori on incidence of metachronous gastric carcinoma after endoscopic resection of early gastric cancer: an open-label, randomised controlled trial. Lancet. 2008;372:392-397. [PubMed] [DOI] |
| 12. | 刘 文中. 幽门螺旋杆菌研究进展. 第1版. 上海: 上海科学技术文献出版社 2001; 41-42. |
| 13. | Peter S, Beglinger C. Helicobacter pylori and gastric cancer: the causal relationship. Digestion. 2007;75:25-35. [PubMed] [DOI] |
| 14. | Li WQ, Zhang L, Ma JL, Zhang Y, Li JY, Pan KF, You WC. Association between genetic polymorphisms of DNA base excision repair genes and evolution of precancerous gastric lesions in a Chinese population. Carcinogenesis. 2009;30:500-505. [PubMed] [DOI] |
| 16. | Motta CR, Cunha MP, Queiroz DM, Cruz FW, Guerra EJ, Mota RM, Braga LL. Gastric precancerous lesions and Helicobacter pylori infection in relatives of gastric cancer patients from Northeastern Brazil. Digestion. 2008;78:3-8. [PubMed] [DOI] |
| 18. | Ladeira MS, Bueno RC, Dos Santos BF, Pinto CL, Prado RP, Silveira MG, Rodrigues MA, Bartchewsky W Jr, Pedrazzoli J Jr, Ribeiro ML, Salvadori DM. Relationship among oxidative DNA damage, gastric mucosal density and the relevance of cagA, vacA and iceA genotypes of Helicobacter pylori. Dig Dis Sci. 2008;53:248-255. [PubMed] [DOI] |
| 19. | Kobayashi M, Lee H, Nakayama J, Fukuda M. Roles of gastric mucin-type O-glycans in the pathogenesis of Helicobacter pylori infection. Glycobiology. 2009;19:453-461. [PubMed] [DOI] |
| 20. | Forman D, Pisani P. Gastric cancer in Japan--honing treatment, seeking causes. N Engl J Med. 2008;359:448-451. [PubMed] [DOI] |