修回日期: 2010-07-05
接受日期: 2010-07-08
在线出版日期: 2010-08-08
目的: 探讨胃肠道恶性肿瘤患者外周血人类斯钙素基因表达及其与肿瘤微转移的关系.
方法: 采用RT-PCR方法检测胃肠道恶性肿瘤患者40例, 消化系炎症性疾病患者10例和正常健康捐赠者10例的外周血, 以及患者6例(胃癌2例、大肠癌4例), 同时于术中取肿瘤组织及正常肠道组织的hSTC-1 mRNA.
结果: 在胃肠道恶性肿瘤患者40例中, 外周血hSTC-1 mRNA的表达的阳性率为60%(24/40例), 肿瘤组织6例均为阳性, 癌旁正常组织仅1例为阳性, 其余健康成人10例及消化系炎症性疾病患者10例均为阴性.
结论: 在胃肠道肿瘤患者的外周血中检测hSTC-1 mRNA的表达是判定肿瘤早期微转移的一种较好的方法, 他可以作为肿瘤转移和复发以及疗效观察的客观指标之一.
引文著录: 张海蓉, 郝卫刚, 段丽平. 胃肠道肿瘤患者外周血人类斯钙素基因的检测及其意义. 世界华人消化杂志 2010; 18(22): 2387-2391
Revised: July 5, 2010
Accepted: July 8, 2010
Published online: August 8, 2010
AIM: To detect the expression of stanniocalcin 1 mRNA (STC1) in peripheral blood of patients with gastrointestinal cancer and to analyze its relationship with tumor micrometastasis.
METHODS: RT-PCR was performed to detect the expression of STC1 mRNA in peripheral blood samples obtained from 40 patients with gastrointestinal cancer, 10 patients with gastrointestinal inflammatory disease and 10 healthy blood donors, and in tumor tissue and tumor-adjacent normal intestinal tissue samples taken from 2 patients with gastric cancer and 6 patients with colorectal cancer.
RESULTS: The positive rate of STC1 mRNA expression was 60% (24/40) in peripheral blood from patients with gastrointestinal cancer, 100% (6/6) in tumor tissue and 16.7% (1/6) in tumor-adjacent normal intestinal tissue from patients with gastric cancer or colorectal cancer. STC1 mRNA expression was undetectable in peripheral blood from patients with gastrointestinal inflammatory disease or healthy blood donors.
CONCLUSION: Detection of STC1 mRNA expression in peripheral blood can be used to predict early micrometastasis and therefore represents an objective indicator for evaluation of tumor metastasis and recurrence and therapeutic efficacy in patients with gastrointestinal cancer.
- Citation: Zhang HR, Hao WG, Duan LP. Clinical significance of detection of stanniocalcin 1 expression in peripheral blood of patients with gastrointestinal cancer. Shijie Huaren Xiaohua Zazhi 2010; 18(22): 2387-2391
- URL: https://www.wjgnet.com/1009-3079/full/v18/i22/2387.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i22.2387
斯钙素(stanniocalcin, STC)是一种首先在硬骨鱼类中发现, 并已被充分阐明的糖蛋白激素. 近年来在人和哺乳动物中发现也存在类似的蛋白. STC1以旁分泌和自分泌的方式参与机体的多种生理功能, 他不但可以通过肾脏和肠道系统来调节钙和磷酸盐的代谢, 而且在促进脑神经元的终末分化[1], 防止因大脑局部缺血造成脑神经元损害[2], 调节免疫细胞功能[3], 以及影响骨骼和肌肉的结构和功能[1]等方面也有重要作用. 近年来越来越多的研究表明STC的表达在人类肿瘤的发生发展过程中起着十分重要的作用, 但有关STC1与消化系肿瘤发生的报道较少. 本研究对2009-02/2009-04昆明医学院第一附属医院肿瘤治疗中心和胃肠外科住院的恶性肿瘤患者40例, 采用RT-PCR检测不同病理分期的患者的外周血和部分组织中STC1 mRNA表达的水平, 研究STC1在临床患者中的检测能否提高胃肠道肿瘤的诊断率, 并研究其与消化系恶性肿瘤微转移的关系.
收集2009-02/2009-04昆明医学院第一附属医院肿瘤治疗中心和胃肠外科经病理科确诊的胃癌、大肠癌住院患者40例, 其中胃癌10例, 大肠癌30例, 年龄36-82(平均59.6)岁, 取术前外周血, 6例患者(胃癌2例、大肠癌4例)同时于术中取肿瘤组织及正常肠道组织, 以及10例胃肠道炎症疾病和10例正常健康捐赠者的外周血, 并收集相关临床资料. 本试验将患者性别、年龄、细胞分化、浸润程度、临床分期、有无淋巴结转移和远处转移进行分类列表探讨基因表达规律. 根据年龄分为≥60岁、<60岁2组; 根据性别分为男性、女性2组; 根据病理肿瘤分化程度分为高-中分化和低分化2组, 以及根据淋巴结及远处转移的有无对两组进行讨论. TRIzol为美国Invitrogen公司产品, cDNA第一链合成试剂盒由北京天根生物技术公司提供, PCR扩增试剂为美国Promega公司产品, PCR仪为德国Eppendorf公司产品, 琼脂糖凝胶电泳及Doc-1000型凝胶成像设备为美国Bio-rad生产. 引物合成由北京三博志远生物科技有限公司完成.
1.2.1 样本处理与RNA的提取: 抽取患者外周静脉血3 mL, 采集后血样本于4 ℃下保存时间不超过2 h, 以3 500 r/min, 离心10 min, 将上层血浆吸出, 加入与吸出血浆相等体积的灭菌生理盐水, 混匀. 将6 mL淋巴细胞分离液加入灭菌的10 mL离心管中. 将血细胞悬液缓慢加入淋巴细胞分离液液面上, 以1 500 r/min, 离心20 min, 收集界面上的白细胞层, 放入灭菌的1.5 mL离心管中, 以10 000 r/min, 离心5 min, 吸掉上清. 加入1 mL TRIzol反复抽吸混匀保存于-80 ℃超低温冰箱. 在胃肠道肿瘤患者手术切除肿瘤组织离体后马上取材, 采用一次性无菌手套及高压消毒处理过的手术切片, 切除癌组织及正常组织各100 mg, 两种组织切除过程中, 分别采用各自的手术刀片, 先取远癌切端正常组织(术后病理证实切缘无癌细胞者, 所取组织入选), 再取癌组织, 切除癌组织时注意尽量不要接触癌组织. 所取组织即刻放入-80 ℃超低温冰箱保存. 组织解冻后, 取一小块组织, 约100 mg放于研钵中, 加入1 mL TRIzol, 迅速研磨, 尽量将组织磨碎, 室温静置5 min后, 在低温高速离心机中10 000 r/min, 离心10 min, 吸取上清液转移至新的离心管中. 以上血液及组织提取物均加入0.2 mL氯仿, 充分振荡. 12 000 r/min离心10 min. 将上层清液转入一新的1.5 mL离心管, 加入等体积异丙醇, 轻柔颠倒混匀十几次, 室温放置20 min. 12 000 r/min离心10 min. 弃上清. 沉淀用1 mL冰的无水乙醇洗1次, 12 000 r/min离心5 min. 弃上清. 室温干燥, 用灭菌的DEPC水50 μL溶解沉淀. 取3 μL RNA, 1.5%琼脂糖凝胶进行电泳, 在紫外投射灯上观察以鉴定提取的总RNA的完整性. 总RNA完整, 进行下续试验.
1.2.2 逆转录: 在冰浴的无核酸酶的离心管中加入如下反应混合物: RNA: 10 μL, Oligo(dT)15: 2 μL, dNTP: 2 μL, 70 ℃加热5 min, 冰上骤冷2 min, 简短离心收集反应液后加入以下组分: 5×First-Strand Buffer: 4 μL, MDTT: 1 μL, RNasin: 0.5 μL, TIANScript M-MLV(200 U): 1 μL, 42 ℃加热50 min, 95 ℃加热5 min终止反应, 以RNase-free ddH2O将反应体系稀释总体积至50 μL.
1.2.3 RT-PCR: 扩增体系: cDNA: 1 μL, 上下引物(10 μm)各2 μL, 10×反应缓冲液: 2 μL, dNTP(2.5 mmol/L): 2 μL, Taq DNA聚合酶0.5 μL, 加灭菌去离子双蒸水15 μL至总体积25 μL. hSTC-1引物、内参照β-actin序列见表1. 循环参数如下: β-actin: 94 ℃预变性5 min, 94 ℃变性30 s, 58 ℃退火30 s, 72 ℃延伸1 min, 28个循环, 72 ℃延伸10 min. hSTC-1: 94 ℃预变性5 min, 94℃变性30 s, 62 ℃退火30 s, 72 ℃延伸1 min, 28个循环, 72 ℃延伸10 min.
| 名称 | 引物序列 | 长度(bp) | |
| hSTC-1 | 上游 | 5'-CACACCCACGAGCTGACTTC-3' | 139 |
| 下游 | 5'-TCTCCCTGGTTATGCACTCTCA-3' | ||
| β-actin | 上游 | 5'-CCCTGGACTTCGAGCAAGAGAT-3' | 530 |
| 下游 | 5'-GTTTTCTGCGCAAGTTAGG-3' | ||
1.2.4 RT-PCR产物鉴定: 扩增产物加样于1.5%琼脂糖凝胶进行电泳, 紫外光凝胶成像系统扫描. 以肉眼明确判定139 bp处有亮带为阳性标准.
统计学处理 采用SPSS软件分析各组数据, 以P<0.05为显著性差异.
可见18S和28S两条主带, 28S:18S = 2:1, 提取的总RNA完整, 没有降解(图1).
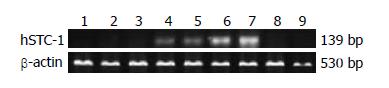
在40例胃肠道恶性肿瘤患者中, hSTC-1 mRNA的表达的阳性率为60%(24/40例), 6例肿瘤组织均为阳性, 癌旁正常组织仅1例为阳性, 其余10例健康成人及10例消化系炎症性疾病患者均为阴性(图2). 胃肠道恶性肿瘤外周血hSTC-1 mRNA表达与临床病理资料之间的相关性分析见表2.
| 临床资料 | 胃癌 | 大肠癌 | 合计 | |||
| n | 阳性n(%) | n | 阳性n(%) | n | 阳性n(%) | |
| 性别 | ||||||
| 男 | 6 | 2(33.3) | 17 | 11(64.7) | 23 | 13(56.5) |
| 女 | 4 | 3(75.0) | 13 | 8(61.5) | 17 | 11(64.7) |
| 年龄(岁) | ||||||
| ≥60 | 5 | 4(80.0) | 21 | 15(71.4) | 26 | 19(73.1)a |
| <60 | 5 | 1(20.0) | 9 | 4(44.4) | 14 | 5(35.7) |
| 分化程度 | ||||||
| 中高 | 2 | 0(0.00) | 22 | 14(58.3) | 24 | 14(58.3) |
| 低 | 8 | 5(62.5) | 8 | 5(62.5) | 16 | 10(62.5) |
| 浸润深度 | ||||||
| T1-T2 | 3 | 1(33.3) | 6 | 3(50.0) | 9 | 4(44.4) |
| T3-T4 | 7 | 4(57.1) | 24 | 16(66.7) | 31 | 20(64.5) |
| 淋巴结转移 | ||||||
| 有 | 5 | 3(60.0) | 14 | 11(78.6) | 19 | 14(73.7)a |
| 无 | 5 | 2(40.0) | 16 | 8(50.0) | 21 | 10(47.6) |
| 远处转移 | ||||||
| 有 | 1 | 0(0.00) | 7 | 5(71.4) | 8 | 5(62.5) |
| 无 | 9 | 5(55.6) | 23 | 14(60.9) | 32 | 19(59.3) |
| TNM分期 | ||||||
| 0-Ⅱ | 5 | 2(40.0) | 16 | 8(50.0) | 21 | 10(47.6)a |
| Ⅲ-Ⅳ | 5 | 3(60.0) | 14 | 11(78.6) | 19 | 14(73.7) |
| 合计 | 10 | 5(50.0) | 30 | 19(63.3) | 40 | 24(60.0) |
1995年Wanger等[4]首先发现在人类组织中存在STC, 随后Chang等[5]克隆出人类编码STC的cDNA, 并在1998年通过原位分子杂交和双色荧光原位分子杂交技术发现hSTC-1基因定位于染色体的8p11.2-p21带上, 且由4个外显子组成. 目前认为hSTC-1主要存在于肾、十二指肠、脑、子宫、前列腺、卵巢等组织中, 以旁分泌和自分泌方式分泌, 在外周血循环中不存在, De Niu等[6]推测可能是血液中存在特殊的清除机制, 使得在人体外周血循环中没有发现hSTC-1的存在. 随着对hSTC-1研究的不断深入, 越来越多的研究表明hSTC-1的表达与人类癌症的发展过程相关, 有学者认为hSTC-1调节Ca2+/Pi浓度可能是肿瘤细胞增殖[7]、侵袭和转移必要的传导信号, 有诱导肿瘤细胞适应低氧环境以维持能量代谢的稳定[8,9], 调节内皮细胞功能, 促进新生血管的成熟[10]等作用. hSTC-1 mRNA在多种肿瘤组织内普遍的高表达, 且在非血液系统源性肿瘤人群的骨髓和外周血中不表达, 使得hSTC-1 mRNA可能成为一个新的肿瘤标志物[11].
非血液系统的恶性肿瘤在发展过程中, 具有转移潜能的肿瘤细胞在术前或术时已脱离原发灶, 以非常少的数量播散并存活于淋巴结、骨髓、血液或远处器官中, 常无任何临床表现, 普通检测手段亦不能发现, 称为肿瘤微转移. 肿瘤细胞在外周血中的微转移是肿瘤复发和转移的重要起始步骤. 近年来随着分子生物学技术的发展, 用RT-PCR方法检测肿瘤特异性mRNA的表达已被证明是检查外周血、骨髓、淋巴结中循环细胞的敏感方法, PCR方法可以在107单核细胞中检测出1-10个肿瘤细胞, 这已被证明是检查外周血、骨髓、淋巴结中循环细胞的敏感方法.
目前, 病理学检查仍然是确诊肿瘤最重要的方法, 而临床中常用的一些血清学方法如蛋白质类、糖脂类和酶类肿瘤标志物的检测不同程度地存在敏感性和/或特异性不足的问题, 并且这些血清学的检测方法对肿瘤有无转移无法做出判断, 临床上通常以临床表现和影像学检查作为诊断肿瘤有无转移的依据, 这与肿瘤的微转移必然存在一定的时间差, 其间包括肿瘤细胞进入血液循环、局部种植、生长等过程, 早期发现肿瘤微转移将为指导临床治疗、监测疗效、判断肿瘤预后提供重要参考资料. 因此, 探索一种早期检查肿瘤微转移的方法具有一定的临床意义.
本研究收集40例消化系恶性肿瘤患者术前以及10例消化系炎症性疾病患者和10例正常健康捐赠者的外周血, 其中6例患者同时于术中取肿瘤组织及正常肠道组织, 采用RT-PCR方法检测hSTC-1 mRNA的表达. 结果6例肿瘤组织均为阳性, 癌旁正常组织仅1例为阳性, 考虑在肿瘤的发生过程中代谢的改变要先于组织学的变化, 其余10例健康成人及10例消化系炎症性疾病患者均为阴性.
在胃肠道肿瘤患者中, hSTC-1 mRNA的表达的阳性率为60%(24/40例), 与所收集的消化系炎症性疾病和健康成人的表达有显著的差异(均P<0.01), 在一定程度上说明肿瘤患者外周血中hSTC-1 mRNA的表达对诊断恶性肿瘤性疾病具有较高的敏感性和特异性. 进一步结合患者的临床资料发现, hSTC-1 mRNA的表达在年龄≥60岁、低分化、浸润较深、有转移的胃癌和大肠癌患者中年龄<60岁、中高分化、浸润较浅、无转移的患者, 两组之间并没有显著的差异. 这与国内外相关报道不相一致[12], 考虑与样本量、病理组织取材范围、对肿瘤有无转移的判定所选择的影像学检查的敏感性有差异所致. 但综合胃癌和肠癌患者外周血hSTC-1 mRNA的表达发现, 在年龄≥60岁、有淋巴结转移和TNM分期Ⅲ-Ⅳ期的胃癌肠癌患者中高于在年龄<60岁、无淋巴结转移和TNM分期0-Ⅱ期的患者, 两组间有统计学差异(均P<0.05). 在胃肠道肿瘤患者的外周血中检测hSTC-1 mRNA的表达以判定肿瘤早期的微转移不失为一种较好的方法, 他可以作为肿瘤转移和复发以及疗效观察的客观指标之一.
斯钙素(STC-1)是一种存在于硬骨鱼, 继而在人和哺乳动物中发现的糖蛋白激素, 他主要的生理作用是抑制Ca2+的吸收和促进磷酸盐的重吸收. 近年来发现hSTC-l mRNA在多种肿瘤组织内普遍高表达, 越来越多的研究表明STC的表达在人类肿瘤的发生发展过程中起着重要的作用.
王晓艳, 副教授, 湖南长沙中南大学湘雅三医院消化内科
本研究采用RT-PCR方法检测胃癌、大肠癌患者外周血中hSTC-l mRNA水平及相应肿瘤组织中hSTCl的表达状况, 同时分析hSTC-l mRNA表达水平与临床病理特征的关系. 明确胃肠道肿瘤患者外周血中hSTC-1 mRNA的表达及其诊断价值, 以鉴定其是否为胃癌及肠癌的肿瘤标志物.
肿瘤患者外周血中hSTC-1 mRNA的表达对诊断恶性肿瘤性疾病具有较高的敏感性和特异性, hSTC-1 mRNA可能成为一个新的肿瘤标志物, 与肿瘤微转移有关.
在肿瘤患者的外周血中检测hSTC-1 mRNA的表达以判定肿瘤早期的微转移为一种较好的方法, 可能成为肿瘤转移和复发以及疗效观察的客观指标之一.
本文内容新颖, 设计科学, 对胃癌的早期发现治疗具有一定的意义.
编辑: 曹丽鸥 电编:何基才
| 1. | Filvaroff EH, Guillet S, Zlot C, Bao M, Ingle G, Steinmetz H, Hoeffel J, Bunting S, Ross J, Carano RA. Stanniocalcin 1 alters muscle and bone structure and function in transgenic mice. Endocrinology. 2002;143:3681-3690. [PubMed] [DOI] |
| 2. | Westberg JA, Serlachius M, Lankila P, Penkowa M, Hidalgo J, Andersson LC. Hypoxic preconditioning induces neuroprotective stanniocalcin-1 in brain via IL-6 signaling. Stroke. 2007;38:1025-1030. [PubMed] [DOI] |
| 3. | Kanellis J, Bick R, Garcia G, Truong L, Tsao CC, Etemadmoghadam D, Poindexter B, Feng L, Johnson RJ, Sheikh-Hamad D. Stanniocalcin-1, an inhibitor of macrophage chemotaxis and chemokinesis. Am J Physiol Renal Physiol. 2004;286:F356-F362. [PubMed] [DOI] |
| 4. | Wagner GF, Guiraudon CC, Milliken C, Copp DH. Immunological and biological evidence for a stanniocalcin-like hormone in human kidney. Proc Natl Acad Sci U S A. 1995;92:1871-1875. [PubMed] [DOI] |
| 5. | Chang AC, Janosi J, Hulsbeek M, de Jong D, Jeffrey KJ, Noble JR, Reddel RR. A novel human cDNA highly homologous to the fish hormone stanniocalcin. Mol Cell Endocrinol. 1995;112:241-247. [PubMed] [DOI] |
| 6. | De Niu P, Radman DP, Jaworski EM, Deol H, Gentz R, Su J, Olsen HS, Wagner GF. Development of a human stanniocalcin radioimmunoassay: serum and tissue hormone levels and pharmacokinetics in the rat. Mol Cell Endocrinol. 2000;162:131-144. [PubMed] [DOI] |
| 7. | Law AY, Lai KP, Lui WC, Wan HT, Wong CK. Histone deacetylase inhibitor-induced cellular apoptosis involves stanniocalcin-1 activation. Exp Cell Res. 2008;314:2975-2984. [PubMed] [DOI] |
| 8. | Chen C, Jamaluddin MS, Yan S, Sheikh-Hamad D, Yao Q. Human stanniocalcin-1 blocks TNF-alpha-induced monolayer permeability in human coronary artery endothelial cells. Arterioscler Thromb Vasc Biol. 2008;28:906-912. [PubMed] [DOI] |
| 9. | Lal A, Peters H, St Croix B, Haroon ZA, Dewhirst MW, Strausberg RL, Kaanders JH, van der Kogel AJ, Riggins GJ. Transcriptional response to hypoxia in human tumors. J Natl Cancer Inst. 2001;93:1337-1343. [PubMed] [DOI] |
| 10. | Yeung HY, Lai KP, Chan HY, Mak NK, Wagner GF, Wong CK. Hypoxia-inducible factor-1-mediated activation of stanniocalcin-1 in human cancer cells. Endocrinology. 2005;146:4951-4960. [PubMed] [DOI] |
| 11. | Fujiwara Y, Sugita Y, Nakamori S, Miyamoto A, Shiozaki K, Nagano H, Sakon M, Monden M. Assessment of Stanniocalcin-1 mRNA as a molecular marker for micrometastases of various human cancers. Int J Oncol. 2000;16:799-804. [PubMed] |