修回日期: 2010-07-03
接受日期: 2010-07-12
在线出版日期: 2010-08-08
目的: 探讨肿瘤微环境中趋化因子CXCL8及其受体CXCR1在结肠癌组织的表达及其临床应用价值.
方法: 选取上海交通大学附属瑞金医院结肠癌患者106例, 记录患者年龄、性别、病理分化程度、肿瘤大小、浸润深度、Duke分期等, 采用免疫组织化学SP法检测CXCL8及其受体CXCR1在结肠癌及其癌旁组织中表达情况, 并分析其表达与临床特征的关系.
结果: 结肠癌组织中CXCL8染色阳性86例, 占71.7%, CXCR1染色阳性78例, 占67.0%, 而癌旁正常结肠黏膜组织中CXCL8及其受体CXCR1染色阳性率分别为19.8%, 16.0%, 两组相比差异具有统计学意义(P<0.05); 进一步分析其表达与临床应用价值. 结果显示, 结肠癌组织中CXCL8/CXCR1表达与性别、年龄、肿瘤分化程度均无明显相关性, 而与结肠癌肿瘤大小、浸润深度、淋巴转移、Duke分期均呈显著正相关(r = 0.271, P = 0.005).
结论: 趋化因子CXCL8/CXCR1生物轴可能在结肠癌侵袭、转移中起一定作用, 进一步为结肠癌免疫治疗提供了新的理论依据.
引文著录: 缪海江, 齐晓光. 趋化因子CXCL8/CXCR1生物轴与结肠癌转移的关系. 世界华人消化杂志 2010; 18(22): 2379-2383
Revised: July 3, 2010
Accepted: July 12, 2010
Published online: August 8, 2010
AIM: To investigate the expression of CXCL8 and CXCR1 in colonic mucosa of patients with colon cancer and to analyze their relationship with the metastasis of colon cancer.
METHODS: A total of 106 patients with colon cancer were included in this study. Immunohistochemistry was used to detect the expression of CXCL8 and CXCR1 in colon cancer specimens taken from these patients. The correlation of CXCL8 and CXCR1 expression with clinicopathological data for these patients, including age, sex, tumor size, lymph node metastasis and Duke stage, were analyzed.
RESULTS: The positive rates of CXCL8 and CXCR1 expression were 71.7% (86/106) and 67.0% (78/106) in colon cancer, respectively. A significant correlation was noted between CXCL8/CXCR1 expression and tumor size, lymph node metastasis, and Duke stages (all P < 0.05) though no correlation was found between CXCL8/CXCR1 expression and age, sex and pathological differentiation.
CONCLUSION: CXCL8/CXCR1 may be involved in the progression and metastasis of colon cancer and therefore can be used as new diagnostic markers for colon cancer and novel targets for therapeutic intervention of the disease.
- Citation: Miao HJ, Qi XG. Role of CXCL8/CXCR1 in the metastasis of human colon cancer. Shijie Huaren Xiaohua Zazhi 2010; 18(22): 2379-2383
- URL: https://www.wjgnet.com/1009-3079/full/v18/i22/2379.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i22.2379
结肠癌是消化系常见恶性肿瘤, 占胃肠道肿瘤的第3位. 近年来虽然其化疗、靶向、手术等治疗方法不断改进, 但患者总体预后并无明显改善, 总体5年生存率仍不足50%, 大约40%的患者在5年内出现腹腔复发和肝转移, 而且其发病率逐年上升[1], 寻找更为有效的干预方法及探究预测转移机制是解决问题的关键所在. 同其他肿瘤一样, 结肠癌是一个复杂的混合体, 除癌细胞外还有炎症细胞、免疫细胞、内皮细胞、成纤维细胞、外皮细胞等, 这些基质细胞构成了肿瘤细胞的微环境, 通过分子信号通路为肿瘤提供生长所需的物质. 最近大量研究表明, 肿瘤微环境中的多种间质细胞对肿瘤细胞的生长和转移具有多方面的影响, 而在此过程中趋化因子及其受体则发挥着至关重要的作用. 而一旦发生转移, 大多预后不良[2]. 因此, 深入探索肿瘤侵袭和转移的关键分子生物学特征和分子调节靶点, 建立行之有效的肿瘤转移分子干预方法和应用技术, 是当前肿瘤研究中亟待阐明和解决的重大基础和临床问题. 本研究采用结肠癌及其癌旁组织标本, 研究CXCL8/CXCR1生物轴的表达情况及其与结肠癌转移的关系, 探讨反映结肠癌发生、发展和转移的敏感指标, 为结肠癌的早期诊断及治疗、病程监控提供一定的客观依据.
选取上海交通大学附属瑞金医院2008-01/2009-12经手术切除的结肠癌标本106例, 男54例, 女52例, 平均年龄56(27-85)岁. 根据WHO标准, 病理组织学分级: 高分化20例, 中分化57例, 低分化29例. 45例有淋巴结转移, 61例无淋巴结转移. CXCL8抗体(sc-57269, Santa Curz, 1:50); CXCR1抗体(MAB330, R&D Systems Inc, 1:200); 免疫组织化学试剂盒购自福州迈新生物技术开发有限公司.
1.2.1 免疫组织化学法: 采用SP法, 检测结肠癌及其癌旁组织中CXCL8、CXCR1表达, 具体操作步骤严格按照试剂盒说明书进行.
1.2.2 结果判定: 根据染色程度和染色细胞百分比进行评分. 染色程度: 基本不着色为0级, 着色呈淡黄色为1级, 着色呈黄色为2级, 着色呈棕褐色为3级. 染色阳性细胞百分比: 着色阳性细胞占计数细胞百分比≤5%为0级, 6%-25%为1级, 26%-50%为2级, ≥51%为3级. 将胞质染色程度分级与染色细胞百分比分级相乘, 乘积≥4者为表达阳性, 0-3为表达阴性.
统计学处理 采用SPSS11.0软件包, 其中率的比较采用χ2检验, 相关分析采用Spearman等级相关检验, P<0.05为有统计学意义.
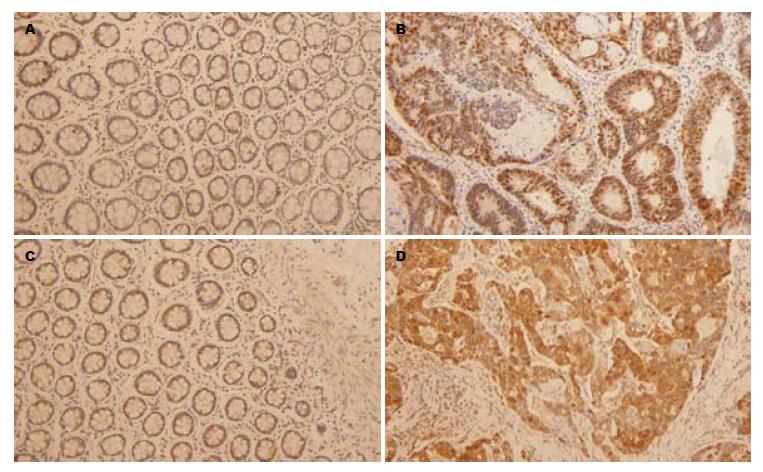
CXCL8在结肠癌组织中明显高表达, 其对应癌旁组织中表达较低, 进一步统计分析显示, 结肠癌及其癌旁组织中表达阳性率分别为71.7%、28.3%, 且差异具有统计学意义(χ2 = 57.49, P = 0.000); CXCR1在结肠癌及其癌旁组织中表达阳性率分别为67.0%、33.0%, 统计分析显示具有显著性差异(χ2 = 56.65, P = 0.000, 表1); CXCL8及其受体CXCR1在结肠癌及其癌旁的表达见图1.
| CXCL8表达 | CXCR1表达 | |||||||
| 阳性(n) | 阴性(n) | χ2值 | P值 | 阳性(n) | 阴性(n) | χ2值 | P值 | |
| 结肠癌组织 | 76 | 30 | 212 | 0.000 | 71 | 35 | 212 | 0.000 |
| 结肠癌旁组织 | 21 | 85 | 17 | 89 | ||||
结肠癌组织中CXCL8及其受体CXCR1表达与性别、年龄、肿瘤分化程度均无明显相关性, 而随着结肠癌进展, 如肿瘤大小、浸润深度、淋巴转移、Duke分期等, 其阳性表达率亦逐渐提高, 统计分析显示差异具有统计学意义(P<0.05), 提示CXCL8及其受体CXCR1与结肠癌转移密切相关(表2, 3).
| n | CXCL8表达 | % | P值 | ||
| 阳性 | 阴性 | ||||
| 年龄(岁) | |||||
| ≥50 | 89 | 58 | 31 | 65.2 | 0.158 |
| <50 | 17 | 8 | 9 | 47.1 | |
| 性别 | |||||
| 男 | 55 | 37 | 18 | 67.3 | 0.294 |
| 女 | 51 | 39 | 12 | 76.5 | |
| 病理分级 | |||||
| Ⅰ | 20 | 15 | 5 | 75.0 | |
| Ⅱ | 57 | 31 | 26 | 54.4 | 0.179 |
| Ⅲ | 29 | 20 | 9 | 69.0 | |
| 肿瘤大小(cm) | |||||
| ≥5 | 47 | 29 | 18 | 61.7 | 0.041 |
| <5 | 59 | 47 | 12 | 79.7 | |
| 浸润深度 | |||||
| T1-T2 | 76 | 49 | 27 | 64.5 | 0.009 |
| T3-T4 | 30 | 27 | 3 | 90.0 | |
| 淋巴转移 | |||||
| 有 | 45 | 37 | 8 | 82.2 | 0.039 |
| 无 | 61 | 39 | 22 | 63.9 | |
| Duke分期 | |||||
| A/B | 49 | 28 | 21 | 57.1 | 0.002 |
| C/D | 57 | 48 | 9 | 84.2 | |
| n | CXCR1表达 | % | P值 | ||
| 阳性 | 阴性 | ||||
| 年龄(岁) | |||||
| ≥50 | 89 | 61 | 28 | 68.5 | 0.435 |
| <50 | 17 | 10 | 7 | 58.8 | |
| 性别 | |||||
| 男 | 55 | 39 | 16 | 70.9 | 0.372 |
| 女 | 51 | 32 | 19 | 62.7 | |
| 病理分级 | |||||
| Ⅰ | 20 | 14 | 6 | 70.0 | |
| Ⅱ | 57 | 37 | 20 | 64.9 | 0.885 |
| Ⅲ | 29 | 20 | 9 | 69.0 | |
| 肿瘤大小(cm) | |||||
| ≥5 | 47 | 30 | 17 | 63.8 | 0.538 |
| <5 | 59 | 41 | 18 | 69.5 | |
| 浸润深度 | |||||
| T1-T2 | 76 | 45 | 32 | 58.4 | 0.015 |
| T3-T4 | 30 | 25 | 5 | 83.3 | |
| 淋巴转移 | |||||
| 有 | 45 | 36 | 9 | 80.0 | 0.014 |
| 无 | 61 | 35 | 26 | 57.4 | |
| Duke分期 | |||||
| A/B | 49 | 24 | 25 | 49.0 | 0.000 |
| C/D | 57 | 47 | 10 | 82.5 | |
趋化因子的主要作用是趋化细胞的迁移, 细胞沿着趋化因子浓度增加的信号向趋化因子源处的迁徙. 早期研究主要集中其在抗炎症等反应中的作用, 最近研究发现, 趋化因子作为肿瘤微环境中关键信号分子, 在肿瘤的侵袭及转移等方面起重要作用. 而肿瘤侵袭、转移不仅是临床手术治疗中的难点, 而且往往是导致患者死亡的主要原因. 肿瘤微环境中趋化因子CXCL8/CXCR1是否参与结肠癌发生、发展, 是本研究探讨的问题之一.
CXCL8是1986年Yoshimura等[3]首先发现的一种强有力的中性粒细胞趋化因子和活化因子, 以往研究发现, 其主要生物作用为趋化并激活中性粒细胞, 促进中性粒细胞的溶酶体活性和吞噬作用[4]. 最近研究显示[5], CXCL8除具有免疫调节作用外, 还能够影响肿瘤的微环境调节和调节肿瘤血管形成. 本研究采用结肠癌及其癌旁组织对照研究, 结果显示, 与对应的癌旁组织相比, CXCL8在结肠癌中表达阳性率明显较高, 且进一步研究发现, 虽然CXCL8表达水平与结肠癌患者的年龄、性别及病理分级等无关(P>0.05), 但CXCL8表达水平与肿瘤大小、浸润深度、淋巴转移及TNM分期等密切相关(均P<0.05), 提示CXCL8能促进结肠癌细胞的增殖和转移; Li等[6]分析比较不同侵袭潜能的结肠癌细胞株, 结果表明, CXCL8及其受体CXCR1表达与结肠癌细胞株侵袭能力呈正相关, 亦提示CXCL8/CXCR1参与了结肠癌增殖、转移等恶性转化过程. Doll等[7]在细胞水平研究证实, CXCL8在结肠癌细胞中高表达与转移、侵袭能力的关系, 该研究同时指出, 其导致结肠癌转移机制可能与上调EGFR有关. 以上研究均提示, CXCL8在结肠癌中高表达, 且其表达水平与结肠癌转移等生物学特性密切相关, 与我们在组织水平的研究结果一致; 另外在其他肿瘤, 比如: 卵巢肿瘤[8]、前列腺癌[9]、胃癌[10]等的研究中均发现肿瘤组织的血管形成与CXCL8表达的升高有关, 亦提示CXCL8的表达与肿瘤细胞侵袭、转移能力密切相关.
以上结果显示, CXCL8在结肠癌的增殖和转移起重要作用, 那么其具体机制如何? 为此, 本研究进一步深入探讨CXCL8在结肠癌转移中的下游靶点, 研究结果发现, 作为CXCL8重要受体之一的CXCR1亦在结肠癌中明显高表达, 且CXCR1表达水平与肿瘤大小、浸润深度、TNM分期等呈正相关. 其可能机制为, CXCL8参与了对循环肿瘤细胞的选择过程[11], CXCL8的外分泌特征导致瘤细胞CXCR1的表达升高, 在循环瘤细胞转变为转移性瘤细胞、转移性瘤细胞的定位和增殖有重要作用, 进而参与结肠癌的发生、发展. Bates等[12]亦研究发现, 在结肠癌上皮-间质转化和转移过程中, 化学趋化因子受体CXCRl, 而不是CXCR-2伴随增加, 同时该研究通过抗体抑制试验证实, CXCL8和CXCR1在结肠癌细胞化学趋化和转移中起重要作用, 同样提示, CXCL8及其受体CXCR1在结肠癌转移中的潜在作用, 与我们在组织中研究结果一致. 以上结果提示, CXCL8/CXCR1生物轴可能在结肠癌转移中起关键作用, 有望成为结肠癌的治疗新的靶点.
总之, 本试验中研究CXCL8/CXCR1生物轴与结肠癌转移关系, 不仅有助于发现肿瘤微环境、炎症与结肠癌发生的新关联, 而且为CXCL8/CXCR1在结肠癌治疗作为重要靶点提供新的理论依据, 为结肠癌免疫治疗等开辟了新的途径, 寻找治疗结肠癌更有效的治疗方法.
肿瘤微环境为当前肿瘤学研究的新兴研究领域之一, 而肿瘤微环境中细胞因子在肿瘤的发生、发展中起着至关重要的作用, 本研究正是基于此出发点, 研究细胞因子等在结肠癌发病机制中的作用, 具有重要的临床潜在应用价值.
杨柏霖, 副主任医师, 南京中医药大学附属医院结直肠外科
Yoshimura等首先发现的一种强有力的中性粒细胞趋化因子和活化因子CXCL8, 以往研究发现, 其主要生物作用为趋化并激活中性粒细胞, 促进中性粒细胞的溶酶体活性和吞噬作用. 最近研究显示, CXCL8除具有免疫调节作用外, 还能够影响肿瘤的微环境调节和调节肿瘤血管形成.
本研究结果与先前的研究结果基本一致, 即CXCL8/CXCR1生物轴与结肠癌肿瘤大小、浸润深度、淋巴转移、Duke分期等均呈显著正相关, 提示CXCL8/CXCR1生物轴在结肠癌转移中起着至关重要的作用. 检测他们的表达情况, 有助于临床分期诊断及治疗方案的选择.
本文选题新颖, 研究设计较为科学, 结果可信.
编辑: 曹丽鸥 电编:何基才
| 1. | Terzić J, Grivennikov S, Karin E, Karin M. Inflammation and colon cancer. Gastroenterology. 2010;138:2101-2114.e5. [PubMed] |
| 2. | Tanaka T, Bai Z, Srinoulprasert Y, Yang BG, Hayasaka H, Miyasaka M. Chemokines in tumor progression and metastasis. Cancer Sci. 2005;96:317-322. [PubMed] [DOI] |
| 3. | Yoshimura T, Matsushima K, Oppenheim JJ, Leonard EJ. Neutrophil chemotactic factor produced by lipopolysaccharide (LPS)-stimulated human blood mononuclear leukocytes: partial characterization and separation from interleukin 1 (IL 1). 1987. J Immunol. 2005;175:5569-5574. [PubMed] |
| 4. | Huber AR, Kunkel SL, Todd RF 3rd, Weiss SJ. Regulation of transendothelial neutrophil migration by endogenous interleukin-8. Science. 1991;254:99-102. [PubMed] [DOI] |
| 5. | Belperio JA, Keane MP, Arenberg DA, Addison CL, Ehlert JE, Burdick MD, Strieter RM. CXC chemokines in angiogenesis. J Leukoc Biol. 2000;68:1-8. [PubMed] |
| 6. | Li A, Varney ML, Singh RK. Expression of interleukin 8 and its receptors in human colon carcinoma cells with different metastatic potentials. Clin Cancer Res. 2001;7:3298-3304. [PubMed] |
| 7. | Doll D, Keller L, Maak M, Boulesteix AL, Siewert JR, Holzmann B, Janssen KP. Differential expression of the chemokines GRO-2, GRO-3, and interleukin-8 in colon cancer and their impact on metastatic disease and survival. Int J Colorectal Dis. 2010;25:573-581. [PubMed] [DOI] |
| 8. | Kassim SK, El-Salahy EM, Fayed ST, Helal SA, Helal T, Azzam Eel-D, Khalifa A. Vascular endothelial growth factor and interleukin-8 are associated with poor prognosis in epithelial ovarian cancer patients. Clin Biochem. 2004;37:363-369. [PubMed] [DOI] |
| 9. | Kim SJ, Uehara H, Karashima T, Mccarty M, Shih N, Fidler IJ. Expression of interleukin-8 correlates with angiogenesis, tumorigenicity, and metastasis of human prostate cancer cells implanted orthotopically in nude mice. Neoplasia. 2001;3:33-42. [PubMed] [DOI] |
| 10. | Kitadai Y, Takahashi Y, Haruma K, Naka K, Sumii K, Yokozaki H, Yasui W, Mukaida N, Ohmoto Y, Kajiyama G. Transfection of interleukin-8 increases angiogenesis and tumorigenesis of human gastric carcinoma cells in nude mice. Br J Cancer. 1999;81:647-653. [PubMed] [DOI] |
| 11. | Kunkel M, Reichert TE, Benz P, Lehr HA, Jeong JH, Wieand S, Bartenstein P, Wagner W, Whiteside TL. Overexpression of Glut-1 and increased glucose metabolism in tumors are associated with a poor prognosis in patients with oral squamous cell carcinoma. Cancer. 2003;97:1015-1024. [PubMed] [DOI] |
| 12. | Bates RC, DeLeo MJ 3rd, Mercurio AM. The epithelial-mesenchymal transition of colon carcinoma involves expression of IL-8 and CXCR-1-mediated chemotaxis. Exp Cell Res. 2004;299:315-324. [PubMed] [DOI] |