修回日期: 2010-06-30
接受日期: 2010-07-05
在线出版日期: 2010-08-08
目的: 检测原发性小肠恶性肿瘤中硫氧还蛋白-1(TRX-1)和转录活化因子-3(STAT-3)的表达和临床病理特征, 并探讨二者之间的相关性.
方法: 用免疫组织化学法分别检测原发性小肠恶性肿瘤58例和癌旁正常小肠黏膜20例中TRX-1和STAT-3的表达. 用半定量方法对免疫组织化学染色做评分, 结合临床和病理数据进行分析.
结果: TRX-1和STAT-3在原发性小肠恶性肿瘤中过度表达. 他们较癌旁正常组织的表达显著增高. 二者表达与正常组织有统计学的差异, 且与病理分化不同有关(P<0.05或0.01). 他们在中低分化肿瘤比高分化者表达增强; 也同淋巴结转移和TNM分级密切相关(P<0.05或0.01). TRX-1和STAT-3在原发性小肠恶性肿瘤中的表达呈正相关(r = 0.881, P<0.01).
结论: Trx-1和STAT-3在原发性小肠恶性肿瘤组织中的过度表达并与其发生发展有关, 二者单独或共同相互作用, 可能参与了小肠恶性肿瘤恶化的调控.
引文著录: 牛桂军, 陈卓琳, 李西融, 唐澄海. TRX-1和STAT-3在原发性小肠恶性肿瘤中的表达及意义. 世界华人消化杂志 2010; 18(22): 2327-2332
Revised: June 30, 2010
Accepted: July 5, 2010
Published online: August 8, 2010
AIM: To detect the expression of thioredoxin-1 (TRX-1) and signal transducer and activator of transcription 3 (STAT-3) and to analyze their relation to clinicopathological features in primary malignant tumors of the small intestine.
METHODS: The expression of TRX-1 and STAT-3 in primary malignant tumors of the small intestine and matched tumor-adjacent normal tissue was detected by immunohistochemistry. The relationship between TRX-1 and STAT-3 expression and clinicopathological features in primary malignant tumors of the small intestine was then analyzed.
RESULTS: Overexpression of TRX-1 and STAT-3 was detected in primary malignant tumors of the small intestine. The positive rates of TRX-1 and STAT-3 expression were significantly higher in tumor tissue than in tumor-adjacent normal tissue (both P < 0.01). The intensity of TRX-1 and STAT-3 expression was significantly higher in moderately and poorly differentiated tumor tissue than in well differentiated tumor tissue (P < 0.05 or 0.01). Increased expression of TRX-1 and STAT-3 is significantly correlated with lymph node metastasis and TNM stage (P < 0.05 or 0.01). There is a positive correlation between the expression of TRX-1 and STAT-3 in malignant tumors of the small intestine (r = 0.881, P < 0.01).
CONCLUSION: TRX-1 and STAT-3 are overexpressed in primary malignant tumors of the small intestine, indicating that high expression of TRX-1 and STAT-3 may be involved in the genesis, development and progression of the disease.
- Citation: Niu GJ, Chen ZL, Li XR, Tang CH. Significance of TRX-1 and STAT-3 expression in primary malignant tumors of the small intestine. Shijie Huaren Xiaohua Zazhi 2010; 18(22): 2327-2332
- URL: https://www.wjgnet.com/1009-3079/full/v18/i22/2327.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i22.2327
小肠原发性恶性肿瘤是消化系少见肿瘤, 对其发生发展机制研究甚少, 多基因突变, 多阶段演进参与了其进展[1]. 硫氧还蛋白-1(thioredoxin-1, TRX-1)作为组织细胞氧化应激的重要的小分子蛋白, 其过度激活导致细胞的异常增殖和凋亡障碍, 促进正常细胞发生恶性转化, 与许多肿瘤性疾病有密切关系[2]. 转录活化因子-3(signal transducer and activator of transcription 3, STAT-3)是信号转导和转录激活因子家族(STAT)的重要成员, 是许多致癌途径的焦点. 他通过对关键蛋白的调节失控促进癌肿进展[3]. 二者已成为许多恶性肿瘤研究的热点. 研究显示TRX-1在许多肿瘤中高表达, 但不是在所有肿瘤中都如此[2], 在小肠恶性肿瘤和演变中的表达和作用尚不清楚. Arnér等[2]和牛桂军等[4,5]报道TRX-1和STAT-3分别参与了多种炎症性疾病和肿瘤性疾病, 国外已有二者单独在结直肠癌方面的研究报道[6,7]. 在肠道恶性肿瘤的研究中, 国内仅见STAT-3在大肠癌的研究, 但缺乏二者在小肠恶性肿瘤方面研究的报道. 我们用免疫组织化学法检测原发性小肠恶性肿瘤中TRX-1和STAT-3的表达, 分析他们与临床病理特征的关系, 并探讨二者之间的相关性, 为深入进行小肠恶性肿瘤的研究提供有力依据.
收集广西壮族自治区南溪山医院、柳州市人民医院、桂林市181医院和桂林市第五人民医院外科2004-01/2009-10手术切除, 病理证实的原发性小肠恶性肿瘤58例(术前均未行放疗或化疗), 其中腺癌36例. 男34例, 女24例; 年龄19-83(中位年龄55)岁, <50岁17例, ≥50岁41例; 恶性肿瘤位置分布: 十二指肠恶性肿瘤28例, 空肠14例, 回肠16例; 肿瘤大小<5 cm 26例, ≥5 cm 32例. 按组织学分化程度分为: 高分化23例, 中分化10例, 低分化25例(其中间叶来源恶性肿瘤只分分化较好和差, 分别划入分化较好和分化较差组). 腺癌36例, 其中高分化腺癌12例, 中分化腺癌10例, 低分化腺癌14例. 临床和病理上证实有淋巴结转移23例, 无淋巴结转移35例. 腺癌按AJCC的TNM分期[8]: Ⅰ期: 癌肿未穿出肌层, 无淋巴结转移; Ⅱ期: 癌肿已穿出深肌层, 侵入浆膜层、浆膜外或直肠周围组织, 但无淋巴结转移; Ⅲ期: 癌肿已发生淋巴结转移(包括早期大肠癌伴淋巴结转移的病例); Ⅳ期: 癌肿已发生远隔器官的转移(肝、肺等). 间叶来源按TGM分期[9]: 分化较好和差两期, 前者归入Ⅰ-Ⅱ期, 后者归入Ⅲ-Ⅳ期. 小肠恶性淋巴瘤(本组6例均为B淋巴细胞性非霍奇金淋巴瘤)按Musshoff[10,11]胃肠道淋巴瘤改良分期法分四期. 全部病例中Ⅰ、Ⅱ期26例, Ⅲ、Ⅳ期32例. 另外, 切取距肿瘤边缘大于10 cm的远癌正常肠黏膜组织作为对照. 免疫组织化学所用试剂Thioredoxin 1一抗: 单克隆抗体, 浓缩型. STAT3一抗: 小鼠抗STAT3单克隆抗体, 浓缩型, 美国NeoMarkers公司产品. 即用型第二代免疫组织化学广谱试剂盒SuperPicTure(Mouse/Rabbit KIT, Zymed分装, 编号: 87-8963)购自天津津脉生物技术公司. DAB显色试剂盒(DAB-0031)等购自福州迈新生物技术公司.
1.2.1 免疫组织化学染色: 采用Super PicTure法(一步法). 免疫组织化学所用试剂Thioredoxin 1 一抗工作浓度为1:200. STAT3一抗工作浓度为1:100.
1.2.2 对照设置: 分别以一抗试剂说明书建议的人乳腺癌组织的石蜡切片为阳性对照片; 阴性对照片所用组织同阳性对照片, 在染色过程中用PBS代替一抗, 其余步骤同上述.
1.2.3 结果判断及半定量分析: 参考相关文献[12]采用下述方法对免疫组织化学染色结果进行半定量分析, 结果判定: 以细胞质或细胞核中出现黄色颗粒为阳性. 采用单盲法观片, 每张切片均随机观察5个高倍视野(×400), 每个视野中200个细胞被记数, 计算平均阳性率, 阳性细胞数≥10%为(+). 在每张切片的上、下、左、右、中各选取一个400倍视野, 分别观察每个视野中阳性细胞的染色强度以及该强度细胞占视野中所有肠细胞的百分率, 记录各视野得分, 计算各切片综合得分. 判断标准和综合得分的计算步骤如下: 首先根据阳性细胞染色强度分为3级: Ⅰ级(1分): 弱阳性, 细胞着色为浅黄色; Ⅱ级(2分): 中度阳性, 细胞着色为棕黄色; Ⅲ级(3分): 强阳性, 细胞着色为棕褐色. 其次, 观察每个视野中阳性细胞占该视野总细胞的百分率, 以>5%作为阳性判断标准并分级: Ⅰ级(1分): 6%-25%; Ⅱ级(2分): 26%-50%; Ⅲ级(3分): 51%-75%; Ⅳ级(4分): >75%. 一个视野的免疫组织化学染色综合得分等于该视野中的各种染色强度得分与该强度阳性细胞的百分率得分的乘积之和; 该切片的免疫组织化学染色得分等于5个视野的免疫组织化学染色综合得分的平均分. 免疫组织化学评分, 得分<3为阴性, ≥3为阳性[13]. 所有切片由病理研究人员单盲独立阅片、计分后取均值.
统计学处理 试验资料以Excel建立数据库文件, 用SPSS15.0统计软件对资料进行统计分析: 率的比较采用χ2检验; 免疫组织化学评分用mean±SD表示, 两组均数比较用t检验, 多组均数比较采用方差分析, 多样本均数的两两比较用LSD检验; TRX-1和STAT-3免疫组织化学评分的相关性采用Spearman等级相关分析, TRX-1和STAT-3阳性表达结果, 用计数资料列联表的相关分析, 以P<0.05为差异有统计学意义.
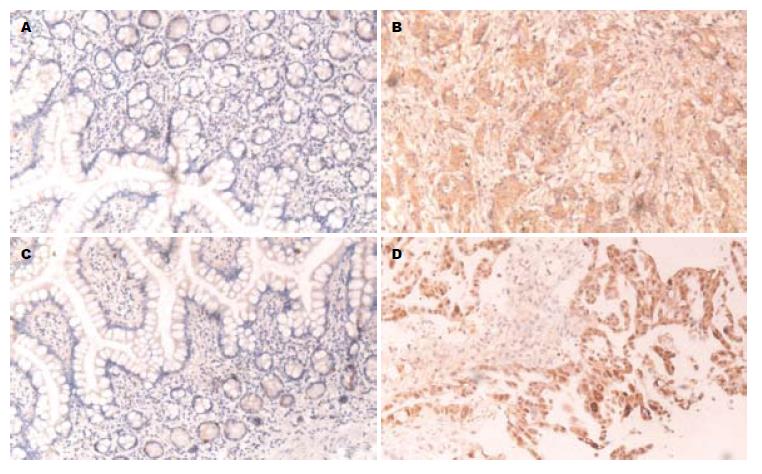
TRX-1和STAT-3在正常对照肠黏膜可有弱表达, 主要位于绒毛黏膜腔表面的上皮细胞, 均定位于细胞质和胞核. TRX-1在小肠恶性肿瘤的阳性率为70.7%, 正常小肠黏膜组织阳性率30.0%, 两组差异有统计学意义(P<0.01, 表1, 图1A, B); STAT-3在小肠恶性肿瘤的阳性率为65.5%, 正常小肠黏膜组织阳性率25.0%, 两组差异有统计学意义(P<0.01, 表1, 图1C, D).
| 组织类型 | n | TRX-1 | STAT-3 | ||
| 阳性n(%) | 免疫组织化学评分 | 阳性n(%) | 免疫组织化学评分 | ||
| 正常 | 20 | 6(30.0) | 1.27±1.01 | 5(25.0) | 1.29±1.16 |
| 恶性肿瘤 | 58 | 41(70.7) | 4.27±2.13 | 38(65.5) | 3.72±1.95 |
| χ2或t值1 | 10.282 | 5.804 | 9.870 | 5.198 | |
| P值 | <0.0001 | <0.001 | <0.0001 | <0.001 | |
TRX-1和STAT-3在小肠恶性肿瘤高、中、低分化组织间差异有统计学意义(P<0.05或0.01), 组织分化程度越低, TRX-1和STAT-3的表达越强; 同样的, 在上皮来源的小肠腺癌组织中也有上述特征(表2, 图1B, 1D). 其表达在有淋巴结转移的表达较强, 反之弱(均P<0.05); TNM分期越高, 表达越强, 反之弱(P<0.05或0.01). 而他们的表达与患者性别、年龄、肿瘤大小、部位均无关(P>0.05, 表2).
| 临床参数 | n | TRX-1 | STAT-3 | |||||
| 阳性n(%)评分 | 免疫组织化学 | 阳性n(%) | 免疫组织化学评分 | |||||
| 性别 | ||||||||
| 男 | 34 | 25(73.5) | 4.32±2.23 | 22(64.7) | 3.81±2.07 | |||
| 女 | 24 | 16(66.7) | 4.25±2.01 | 16(66.7) | 3.58±1.79 | |||
| χ2或t值2 | 0.320 | 0.245 | 0.024 | 0.437 | ||||
| P值 | 0.572 | 0.807 | 0.877 | 0.804 | ||||
| 年龄(岁) | ||||||||
| ≥50 | 41 | 30(73.2) | 4.58±2.24 | 27(65.9) | 3.87±2.16 | |||
| <50 | 17 | 11(64.7) | 3.57±1.64 | 11(64.7) | 3.29±1.26 | |||
| χ2或t值2 | 0.416 | 1.754 | 0.007 | 1.316 | ||||
| P值 | 0.519 | 0.085 | 0.933 | 0.194 | ||||
| 肿瘤大小(cm) | ||||||||
| ≥5 | 32 | 23(71.2) | 4.23±2.09 | 22(68.8) | 3.70±1.90 | |||
| <5 | 26 | 18(69.2) | 4.34±2.20 | 16(61.5) | 3.76±2.04 | |||
| χ2或t值2 | 0.048 | 0.159 | 0.330 | 0.074 | ||||
| P值 | 0.826 | 0.874 | 0.566 | 0.941 | ||||
| 肿瘤部位 | ||||||||
| 十二指肠 | 28 | 22(78.6) | 4.74±2.36 | 20(71.4) | 4.24±2.16 | |||
| 空肠 | 14 | 11(78.6) | 4.24±1.76 | 9(64.3) | 3.41±1.41 | |||
| 回肠 | 16 | 8(50.0) | 3.45±1.79 | 9(56.3) | 3.08±1.81 | |||
| χ2或F值2 | 4.565 | 1.942 | 1.051 | 2.112 | ||||
| P值 | 0.102 | 0.153 | 0.591 | 0.131 | ||||
| 总分化程度 | ||||||||
| 高分化 | 23 | 12(52.2) | 2.84±0.93 | 10(43.5) | 2.48±0.78 | |||
| 中分化 | 10 | 8(80.0) | 4.44±1.28 | 8(80.0) | 3.84±1.04 | |||
| 低分化 | 25 | 21(84.1) | 5.51±2.39 | 20(80.0) | 4.80±2.30 | |||
| χ2或F值2 | 6.362 | 13.790 | 8.194 | 11.643 | ||||
| P值 | 0.042 | <0.001 | 0.017 | <0.001 | ||||
| 上皮来源 | ||||||||
| 高分化 | 12 | 6(50.0) | 2.87±0.88 | 5(41.7) | 2.47±0.84 | |||
| 中分化 | 10 | 8(80.0) | 4.44±1.29 | 8(80.0) | 84.00±1.04 | |||
| 低分化 | 14 | 13(92.9) | 6.91±1.91 | 13(92.86) | 6.11±2.05 | |||
| χ2或F值2 | 6.514 | 25.265 | 8.858 | 20.090 | ||||
| P值 | 0.038 | <0.001 | 0.012 | <0.001 | ||||
| 总淋巴结转移 | ||||||||
| 阴性 | 35 | 19(54.3) | 3.79±1.99 | 17(48.6) | 3.41±1.85 | |||
| 阳性 | 23 | 19(82.6) | 4.99±2.17 | 19(82.6) | 4.63±1.96 | |||
| χ2或t值2 | 4.928 | 2.173 | 8.194 | 2.130 | ||||
| P值 | 0.0263 | 0.034 | 0.017 | 0.036 | ||||
| TNM分期 | ||||||||
| Ⅰ、Ⅱ | 26 | 13(50.0) | 3.33±1.88 | 11(42.3) | 2.97±1.70 | |||
| Ⅲ、Ⅳ | 32 | 28(87.5) | 5.03±2.03 | 27(84.4) | 4.33±1.94 | |||
| χ2或t值2 | 9.736 | 3.260 | 11.236 | 2.790 | ||||
| P值 | 0.002 | 0.002 | 0.0101 | 0.007 | ||||
原发性小肠恶性肿瘤临床少见, 病理类型却呈明显多样性, 对其发病机制了解甚为有限, 有必要进行深入研究. 肿瘤的发生发展是多基因参与的复杂过程, 包括癌基因的异常激活和基因调控异常, 小肠恶性肿瘤的演变进展也不例外.
TRX-1是小分子氧化还原蛋白家族的一个重要成员, 位于细胞质和细胞核中, 包含108个氨基酸残基. 他具有抗氧化特性, 还能促进细胞生长、抑制凋亡并调节许多基本的炎症过程. 许多癌细胞有高水平表达, 他抑制凋亡、刺激细胞增殖和血管发生, 增加转录因子活性, 诱导血管生成和远处转移. 肿瘤中TRX-1水平的升高与肿瘤过度增长及降低患者生存率有关. TRX-1表达水平与细胞增殖呈显著正相关, 与凋亡呈显著负相关[14-16]. TRX-1增加肿瘤细胞生长, 其机制可能涉及到其增强氧化还原敏感转录因子, 如NF-κB、P53、AP-1. TRX-1抑制凋亡可能由对前凋亡蛋白如ASK-1和肿瘤抑制子蛋白PTEN的抑制所致[2,6].
本研究显示, TRX-1主要定位于细胞质和部分胞核, 在许多原发性小肠恶性肿瘤标本中, 较癌旁正常组织表达增强; 我们证实了该癌蛋白在小肠恶性肿瘤中表达上调. TRX-1在小肠恶性肿瘤高、中、低分化组织间差异有统计学意义, 组织分化程度越低, 二者表达越强; 与癌组织分化程度密切相关, 其在各种程度分化中的表达趋势同Raffel等[6]在结直肠癌中的报道一致, 即TRX-1高表达大都集中在低中分化和恶性程度高的组织中, 且随恶性程度增高和分化下降而增高. 有淋巴结转移强, 反之弱; TNM分期越高, 表达越强, 这都提示TRX-1高表达与小肠恶性肿瘤的发生发展和恶性进展有密切关系.
STAT是一类DNA结合蛋白, 由750-850个氨基酸组成. STAT-3是该家族的重要成员, 是胞质的转录因子, 也是细胞因子和生长因子信号途径的介导子. STAT-3广泛表达于不同类型的细胞和组织中, STAT-3参与细胞生长、分化、增生、恶性转化及凋亡抑制等生理功能的调控[5,17,18]. STAT-3是个与生长和肿瘤转化调控密切关联的关键信号分子. 其活化已在许多来源的肿瘤细胞株和大量人类的恶性肿瘤中观察到.
本研究也显示STAT-3在原发性小肠恶性肿瘤中, 其表达水平高于癌旁正常组织, 并与组织分化程度相关, 分化越低表达越高. 提示其在肿瘤进展中的促进作用. 我们发现STAT-3定位于细胞质和胞核, 在小肠恶性肿瘤的阳性表达率明显高于正常小肠黏膜组织阳性表达率. Kusaba等[7]检测了108例人结直肠腺癌组织中p-STAT3的表达, 结果显示57.4%的组织高表达, 其表达与肿瘤分化、淋巴结转移、Dukes分期及术后的预后有关, 提示p-STAT3蛋白的高表达与结直肠腺癌的进展及预后密切相关, 同我们在小肠恶性肿瘤中的试验结论基本一致. STAT-3通过诱导靶基因Survivin、Bcl-xL的表达, 促使肿瘤细胞增殖和淋巴结转移. 在癌肿中STAT-3活化或过表达, 而肿瘤抑制蛋白STAT-1表达下调, 他们是基因重要调节器, 二者的失衡显著影响肠组织的内环境稳态, 从而导致肿瘤发生[19].
研究表明TRX-1和STAT-3二者均可在癌细胞中增加缺氧诱导因子(hypoxia-inducible factor 1, HIF-1)蛋白表达; 二者的过表达导致增加血管内皮生长因子(vascular endothelial growth factor, VEGF)合成并提高肿瘤血管生成[20,21]; 并且二者都可与p38丝裂原活化蛋白激酶(mitogen-activated protein kinases, MAPKs)信号传导产生关联, 进而影响肿瘤的进展[22]. TRX-1也可通过影响肿瘤细胞中活性氧簇的含量, 而与STAT-3发生关联, 促进肿瘤的增殖和抗凋亡[23]. 我们联合检测TRX-1和STAT-3, 二者表达强度随着小肠恶性肿瘤组织分化程度降低而逐渐增强; 有淋巴结转移强, 反之弱, 说明小肠恶性肿瘤的发生、发展与二者有关. 但他们的表达与患者性别、年龄、肿瘤大小、部位均无关. TRX-1和STAT-3的表达呈正相关, 说明TRX-1和STAT-3作为公认的癌蛋白, 与结直肠癌等癌肿组织表达上调一样, 在小肠恶性肿瘤中表达也增强, 也说明他们的表达程度影响肿瘤的恶性程度, 可在一定程度上预示小肠恶性肿瘤的预后. 同黄东胜等[24]对二者在肝细胞肝癌中的研究相似.
总之, TRX-1和STAT-3在小肠恶性肿瘤组织中的过度表达并与其发生发展有关, 二者单独或共同相互作用, 可能参与了小肠恶性肿瘤恶化的调控. 鉴于原发性小肠恶性肿瘤少见, 且病理类型的多样性, 二者在小肠间质等非上皮来源的其他恶性肿瘤的恶变过程中的作用还需进一步扩大样本深入研究. 我们仅从组织学角度研究二者在不同分化程度小肠恶性肿瘤的表达和有关病理参数的关系, 以及二者的相关性. 二者在小肠恶性肿瘤演变进展中深层次调控机制和作用有待在基因水平及分子生物学角度做进一步更深入研究.
衷心感谢柳州市人民医院消化内科李运泽主任、桂林181医院病理科万友华主任、桂林市第五人民医院病理科袁莲香主任在提供标本和临床资料上的大力支持; 感谢广西医科大学肿瘤医院肿瘤实验室欧超主管技师实验上的帮助.
TRX-1和STAT-3是癌蛋白家族的新成员, 在肿瘤组织中异常高表达并与肿瘤的浸润、转移和预后密切相关. 但二者在原发性小肠恶性肿瘤中的表达和病理关系尚未见报道.
房静远, 教授, 上海交通大学医学院附属仁济医院消化内科
小肠原发性恶性肿瘤少见, 对其发生发展的机制所知甚少, 其在基因调控和分子生物学水平上的作用机制, 有待进一步研究. 寻找一条正确的途径预测小肠恶性肿瘤的发生发展并控制其浸润与转移, 已经成为亟待解决的问题.
TRX-1和STAT-3分别参与了多种炎症性疾病和肿瘤性疾病的发生, 国外已有二者之一单因素在结直肠癌方面的研究报道. 在肠道恶性肿瘤的研究中, 国内仅见STAT-3在大肠癌的研究, 但缺乏二者在小肠恶性肿瘤方面研究的报道.
本文首次在原发性小肠恶性肿瘤组织中研究TRX-1和STAT-3的表达及其与临床病理的关系和意义.
TRX-1和STAT-3在原发性小肠恶性肿瘤的发生发展中起重要作用, 本研究有助于对原发性小肠恶性肿瘤生长、浸润和转移机制等发病机制的阐明, 并为肿瘤的诊治提供更充分的理论依据. 联合检测可望作为判断该病恶性程度和预后的指标.
本文探讨了原发性小肠恶性肿瘤中TRX-1和STAT-3的表达情况和临床病理特征, 结果和讨论部分比较客观, 有一定潜在的应用价值.
编辑: 李军亮 电编:何基才
| 2. | Arnér ES, Holmgren A. The thioredoxin system in cancer. Semin Cancer Biol. 2006;16:420-426. [PubMed] [DOI] |
| 3. | Haura EB, Turkson J, Jove R. Mechanisms of disease: Insights into the emerging role of signal transducers and activators of transcription in cancer. Nat Clin Pract Oncol. 2005;2:315-324. [PubMed] [DOI] |
| 4. | 牛 桂军, 唐 国都, 梁 志海, 钟 卫一, 黄 文福. 硫氧还蛋白-1在实验性急性坏死性胰腺炎大鼠肺表达及褪黑素干预的影响. 世界华人消化杂志. 2010;18:550-556. [DOI] |
| 6. | Raffel J, Bhattacharyya AK, Gallegos A, Cui H, Einspahr JG, Alberts DS, Powis G. Increased expression of thioredoxin-1 in human colorectal cancer is associated with decreased patient survival. J Lab Clin Med. 2003;142:46-51. [PubMed] [DOI] |
| 7. | Kusaba T, Nakayama T, Yamazumi K, Yakata Y, Yoshizaki A, Inoue K, Nagayasu T, Sekine I. Activation of STAT3 is a marker of poor prognosis in human colorectal cancer. Oncol Rep. 2006;15:1445-1451. [PubMed] |
| 8. | 金 懋林. 消化道恶性肿瘤化学治疗. 第1版. 北京: 北京大学医学出版社 2008; 291-296. |
| 9. | Ng EH, Pollock RE, Munsell MF, Atkinson EN, Romsdahl MM. Prognostic factors influencing survival in gastrointestinal leiomyosarcomas. Implications for surgical management and staging. Ann Surg. 1992;215:68-77. [PubMed] [DOI] |
| 11. | Turowski GA, Basson MD. Primary malignant lymphoma of the intestine. Am J Surg. 1995;169:433-441. [PubMed] [DOI] |
| 12. | Lu CD, Altieri DC, Tanigawa N. Expression of a novel antiapoptosis gene, survivin, correlated with tumor cell apoptosis and p53 accumulation in gastric carcinomas. Cancer Res. 1998;58:1808-1812. [PubMed] |
| 14. | Mukherjee A, Martin SG. The thioredoxin system: a key target in tumour and endothelial cells. Br J Radiol. 2008;81 Spec No 1:S57-S68. [PubMed] [DOI] |
| 15. | Sun Y, Rigas B. The thioredoxin system mediates redox-induced cell death in human colon cancer cells: implications for the mechanism of action of anticancer agents. Cancer Res. 2008;68:8269-8277. [PubMed] [DOI] |
| 16. | Noike T, Miwa S, Soeda J, Kobayashi A, Miyagawa S. Increased expression of thioredoxin-1, vascular endothelial growth factor, and redox factor-1 is associated with poor prognosis in patients with liver metastasis from colorectal cancer. Hum Pathol. 2008;39:201-208. [PubMed] [DOI] |
| 17. | Kim DJ, Chan KS, Sano S, Digiovanni J. Signal transducer and activator of transcription 3 (Stat3) in epithelial carcinogenesis. Mol Carcinog. 2007;46:725-731. [PubMed] [DOI] |
| 18. | Lim CP, Cao X. Structure, function, and regulation of STAT proteins. Mol Biosyst. 2006;2:536-550. [PubMed] [DOI] |
| 19. | Klampfer L. The role of signal transducers and activators of transcription in colon cancer. Front Biosci. 2008;13:2888-2899. [PubMed] [DOI] |
| 20. | Welsh SJ, Bellamy WT, Briehl MM, Powis G. The redox protein thioredoxin-1 (Trx-1) increases hypoxia-inducible factor 1alpha protein expression: Trx-1 overexpression results in increased vascular endothelial growth factor production and enhanced tumor angiogenesis. Cancer Res. 2002;62:5089-5095. [PubMed] |
| 21. | Jung JE, Lee HG, Cho IH, Chung DH, Yoon SH, Yang YM, Lee JW, Choi S, Park JW, Ye SK. STAT3 is a potential modulator of HIF-1-mediated VEGF expression in human renal carcinoma cells. FASEB J. 2005;19:1296-1298. [PubMed] |
| 23. | Dixit D, Sharma V, Ghosh S, Koul N, Mishra PK, Sen E. Manumycin inhibits STAT3, telomerase activity, and growth of glioma cells by elevating intracellular reactive oxygen species generation. Free Radic Biol Med. 2009;47:364-374. [PubMed] [DOI] |