修回日期: 2010-06-10
接受日期: 2010-06-22
在线出版日期: 2010-08-08
目的: 探讨CXC类趋化因子受体4(CXC chemokine receptor 4, CXCR4)与基质金属蛋白酶-2(matrix metalloproteinase, MMP-2)在食管癌中的表达及其与淋巴结转移的关系.
方法: 用免疫组织化学法检测食管癌85例, 正常食管黏膜组织20例中CXCR4、MMP-2的表达以及与淋巴结转移的关系, 同时分析食管鳞癌中CXCR4与MMP-2的相关性.
结果: 食管鳞癌组织85例中CXCR4阳性率76.5%, 正常食管黏膜20例中阳性率25%, 差异有显著性意义(P<0.05). 淋巴结转移组的癌组织CXCR4阳性率90%, 未有淋巴结转移组的癌组织CXCR4阳性率57.1%, 差异有统计学意义(P<0.05). 食管鳞癌组织85例中MMP-2阳性率70.6%, 正常食管黏膜20例中阳性率25%, 差异有显著性意义(P<0.05). 淋巴结转移组的癌组织MMP-2阳性率92%, 未有淋巴结转移组的癌组织MMP-2阳性率40%, 差异有统计学意义(P<0.05). CXCR4和MMP-2蛋白在食管鳞癌中的表达具有相关性(r = 0.439).
结论: CXCR4和MMP-2在食管癌中的表达明显升高, 与食管癌患者的淋巴结转移密切相关. CXCR4和MMP-2蛋白在食管鳞癌中的表达具有相关性.
引文著录: 杜雅冰, 樊青霞. CXCR4、MMP-2在食管鳞癌中的表达及其与淋巴结转移的关系. 世界华人消化杂志 2010; 18(22): 2322-2326
Revised: June 10, 2010
Accepted: June 22, 2010
Published online: August 8, 2010
AIM: To investigate the expression of CXC chemokine receptor 4 (CXCR4) and matrix metalloproteinase (MMP-2) and to analyze their relationship with lymph node metastasis in esophageal squamous cell carcinoma.
METHODS: The expression of CXCR4 and MMP-2 in 85 esophageal squamous cell carcinoma specimens and 20 normal esophageal tissue specimens was assessed by immunohistochemistry. The relationship between CXCR4 and MMP-2 expression and lymph node metastasis was then analyzed.
RESULTS: The positive rates of CXCR4 and MMP-2 expression in cancer tissue were significantly higher than those in normal esophageal tissue (76.5% vs 25% and 70.6% vs 20%, both P < 0.05). The positive rates of CXCR4 and MMP2 were higher in esophageal squamous cell carcinoma patients with lymph node metastasis than in those without lymph node metastasis (90% vs 57.1% and 92% vs 40%, both P < 0.05). There is a positive correlation between CXCR4 and MMP-2 expression in esophageal squamous cell carcinoma (r = 0.439).
CONCLUSION: CXCR4 and MMP-2 are up-regulated in esophageal squamous cell carcinoma. Up-regulated expression of CXCR4 and MMP-2 may be associated with lymph node metastasis in esophageal squamous cell carcinoma.
- Citation: Du YB, Fan QX. Relationship between CXCR4 and MMP-2 expression and lymph node metastasis in esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2010; 18(22): 2322-2326
- URL: https://www.wjgnet.com/1009-3079/full/v18/i22/2322.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i22.2322
食管癌在我国是一种发病率较高, 生存率较低的肿瘤. 食管癌的淋巴结转移以及肿瘤局部外侵使手术不能完全切除是食管肿瘤治疗失败的重要原因. 食管癌的发生、发展涉及多个基因、分子水平的异常, 食管癌变是由多个基因参与, 多种因素共同作用的结果. 近年来, CXC类趋化因子受体4(CXC chemokine receptor 4, CXCR4)与基质金属蛋白酶-2(matrix metalloproteinase, MMP-2)在食管癌发生发展、浸润、远处转移中的作用受到广泛的关注. 肿瘤转移的机制尚不明确, 他是一个复杂的、非随机的多步骤过程, 涉及肿瘤细胞迁移、黏附、侵袭、生长、新血管生成、特异性转移器官的归巢和逃避免疫几个关键步骤. 有些恶性肿瘤可以倾向性特异性的转移到某些远处的器官组织中, CXCR4的特异性的高表达可能是其中一个重要步骤. MMP-2降解细胞外基质, 介导了肿瘤的侵袭和转移. 为了解CXCR4及MMP-2在食管癌淋巴结转移中的作用, 我们用免疫组织化学的方法检测CXCR4及MMP-2在食管癌组织中的表达, 并观察CXCR4和MMP-2的表达与食管癌淋巴结转移的关系.
选取2008-10/12在安阳市人民医院胸外科行根治性开胸手术的85例胸段食管鳞形细胞癌病例, 所有病例术前均无化疗、放疗及免疫治疗史. 标本离体后0.5 h内迅速取材, 每例标本均在无坏死癌灶及远离病灶的正常食管黏膜处取材, 经中性缓冲甲醛液固定, 石蜡包埋连续切片, 免疫组织化学染色, 光镜筛选. 全部病例病理组织学证实85例食管癌均为鳞状细胞癌. 食管癌TNM分期参照美国癌症联合委员会标准. 组织判断标准如下, 正常食管黏膜: 食管癌手术切除标本中, 距癌灶边缘3 cm以上, 常规病理切片证实为正常的食管黏膜; 食管鳞状细胞癌组织: 食管癌手术切除标本中, 取无坏死的癌组织, 经常规病理切片证实为食管鳞状细胞癌. 85例病例中, 男55例, 女30例; 年龄35-82(中位年龄58)岁; 患者均为首次发病, 术前均未接受放化疗, 同时取20例正常食管黏膜组织做对照检查. 病理组织学证实85例食管癌均为鳞状细胞癌, 其中Ⅰ+Ⅱ期共30例, Ⅲ+Ⅳ期共55例; 淋巴结转移50例, 淋巴结未转移35例. CXCR4一抗, MMP-2一抗购自北京中杉金桥生物技术有限公司, SP试剂盒购自上海生工生物工程技术服务有限公司.
采用SP法. 将石蜡标本以5 μm厚切片, 烤干, 于二甲苯液中脱蜡, 梯度酒精脱水, 3%的H2O2溶液室温下孵育15 min, PBS冲洗3次, 柠檬酸盐抗原修复液以微波炉法进行抗原修复, PBS冲洗3次, 5 min/次. 正常血清封闭20 min, 与一抗37 ℃孵育2 h, 稀释度为1:100, PBS冲洗3次, 5 min/次. 最后用新鲜配置的DAB溶液显色, 自来水冲洗, 苏木素复染, 盐酸乙醇分化, 然后梯度脱水, 中性胶封片(PBS液代替一抗作为阴性对照). CXCR4和MMP-2染色结果评估参考文献报道[1,2]及预试验结果采用综合评分法, 根据染色强度及着色面积进行判断. 细胞染色强度分为4级: 无着色为0级计0分, 浅黄色为1级计1分, 棕黄色为2级计2分, 棕褐色为3级计3分. 在400倍光镜下随机观察5个不同的视野, 根据阳性细胞占总细胞数的百分率分为5个等级: <5%为0级; 5%-25%为1级; 26%-50%为2级; 51%-75%为3级; >75%为4级, 分别取相应分值0、1、2、3、4分. 用细胞数得分和强度得分的乘积作为判断表达结果, 若积分≤1为阴性, >1为阳性. 所有病理切片由两位不了解患者病情及研究内容的病理科医生共同判断.
统计学处理 采用SPSS13.0统计分析软件, 两样本率的比较采用四格表资料的χ2检验; 多样本率的比较采用行列表资料的χ2检验; 计量资料采用t检验及方差分析; 相关性检验用Spearman相关分析. 以P<0.05为差异有显著性意义的检验标准.
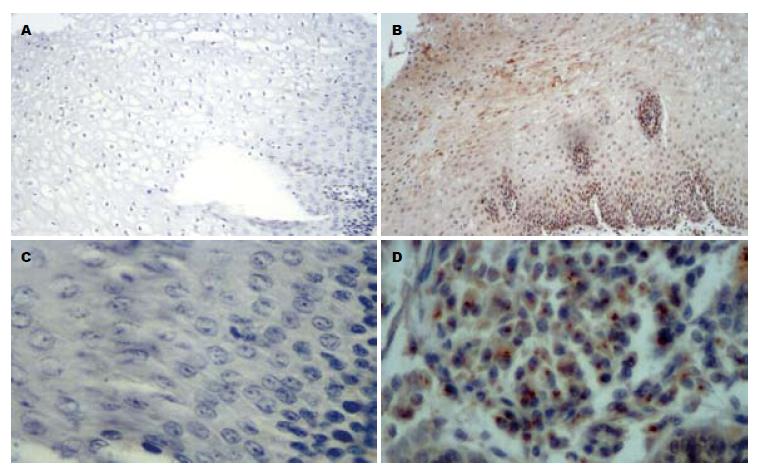
CXCR4阳性染色表现为细胞质内呈棕黄色颗粒, 85例食管鳞癌组织中CXCR4阳性表达率为76.5%. MMP-2阳性染色表现为细胞质内呈棕黄色颗粒, 85例食管鳞癌组织中MMP-2阳性表达率为70.6%(图1, 表1).
| 组织 | n | CXCR4 n(%) | 参数值 | MMP-2 n(%) | 参数值 | ||
| + | - | + | - | ||||
| 癌组织 | 85 | 65(76.5) | 20(23.5) | χ2 = 19.301 | 60(70.6) | 25(29.4) | χ2 = 11.424 |
| 正常组织 | 20 | 5(25.0) | 15(75.0) | P = 0.000 | 6(30.0) | 14(70.0) | P = 0.001 |
CXCR4与MMP-2在有淋巴结转移组阳性表达率(90%, 92%)明显高于无淋巴结转移组(57.1%, 40%), 各组间差异有显著性(χ2 = 12.353, 26.815; 均P<0.05). 随着食管癌临床分期的增加, CXCR4与MMP-2的阳性率表达率有所升高, 统计学结果显示CXCR4与MMP-2阳性表达率在Ⅰ+Ⅱ(53.3%, 50%)与Ⅲ+Ⅳ(89.1%, 81.8%)组间差异有显著性(χ2 = 13.794, 9.466; 均P<0.05, 表2).
| 组织 | n | CXCR4 n(%) | 参数值 | MMP-2 n(%) | 参数值 | ||
| + | - | + | - | ||||
| 性别 | |||||||
| 男 | 55 | 40(72.7) | 15(27.3) | χ2 = 1.214 | 38(69.1) | 17(30.9) | χ2 = 1.168 |
| 女 | 30 | 25(83.3) | 5(16.7) | P = 0.271 | 22(73.3) | 8(26.7) | P = 0.682 |
| 年龄(岁) | |||||||
| ≤60 | 45 | 36(80.0) | 9(20.0) | χ2 = 0.662 | 35(77.8) | 10(22.2) | χ2 = 2.381 |
| >60 | 40 | 29(72.5) | 11(27.5) | P = 0.416 | 25(62.5) | 15(37.5) | P = 1.123 |
| TNM分期 | |||||||
| Ⅰ+Ⅱ | 30 | 16(53.3) | 14(46.7) | χ2 = 13.794 | 15(50.0) | 15(50.0) | χ2 = 9.466 |
| Ⅲ+Ⅳ | 55 | 49(89.1) | 6(10.9) | P = 0.0002 | 45(81.8) | 10(18.2) | P = 0.002 |
| 淋巴结 | |||||||
| 转移组 | 50 | 45(90.0) | 5(10.0) | χ2 = 12.353 | 46(92.0) | 4(8.0) | χ2 = 26.815 |
| 未转移组 | 35 | 20(57.1) | 15(42.9) | P = 0.0004 | 14(40.0) | 21(60.0) | P = 0.000 |
趋化因子是一类具有化学趋化作用的细胞因子, 根据其N端前两个半胱氨酸(Cys)的数目及排列方式不同可分为CC、CXC、C和CX3C4个家族, 相应的受体分别为CCR、CXCR、CR和CX3CR. CXCR4是趋化性细胞因子基质衍生因子SDF-1的专属受体[3]. 最初CXCR4引起人们的关注是由于其在HIV感染中的重要作用[4]. 但是最近的研究发现其在众多肿瘤呈高表达, 据报道至少有23种肿瘤细胞表达CXCR4[5,6], 而且CXCR4与CXCL12结合后可以引起细胞的迁移. Kato等[7]通过检测79例侵袭性乳腺导管癌组织中CXCR4的表达发现, CXCR4表达阳性与患者淋巴结转移相关. 一项关于结直肠癌的研究表明, CXCR4高表达与肿瘤的复发、肝脏转移相关, 并且相应患者生存率也较低[8]. 另外, 在卵巢癌、黑素瘤、前列腺癌、神经母细胞瘤等其他肿瘤的研究中也得到了相似的结果[9], 但是关于CXCR4在食管鳞癌中的表达及与肿瘤生物特性的研究较少, 而且其研究结果有许多矛盾之处, 到目前为止, 关于趋化因子与肿瘤的恶性程度的关系还没有定论. 我们将收集到的85例食管鳞癌标本进行免疫组织化学染色分析, 比较了正常食管黏膜与癌组织CXCR4的表达程度, 结果显示癌组织中CXCR4表达程度明显高于正常食管黏膜(P<0.05). 这个结果与其他恶性肿瘤的结果一致, 表明CXCR4在食管癌中也存在高表达现象. 在食管癌淋巴结阳性组CXCR4的表达率明显高于淋巴结阴性组(P<0.05), 这提示CXCR4的高表达与食管癌淋巴结转移密切相关. 在TNM分期中, Ⅲ+Ⅳ组CXCR4表达率明显高于Ⅰ+Ⅱ组(P<0.05), 提示CXCR4表达促进了食管癌的侵袭和转移. 经统计学检验, CXCR4的表达与食管癌患者的性别和年龄不相关.
MMP是降解细胞外基质的最重要的一组蛋白酶, MMP-2是其中的一种, 参与了消化系肿瘤的发生、发展及侵袭和转移的过程. MMP-2可降解细胞外基质和血管基膜的主要成分Ⅳ型胶原, 使肿瘤细胞易于脱离癌细胞巢, 进出血管从而促进肿瘤的侵袭、转移. Parsons等[10]对胃肠道恶性肿瘤组织中MMP-2表达的研究发现, MMP-2的表达与淋巴结的转移和肿瘤的分期呈正相关. 我们将收集到的85例食管鳞癌标本进行免疫组织化学染色分析, 比较了正常食管黏膜与癌组织MMP-2的表达程度, 结果显示癌组织中MMP-2表达程度明显高于正常食管黏膜(P<0.05). 这个结果与其他恶性肿瘤的结果一致, 表明MMP-2在食管癌中也存在高表达现象. 在食管癌淋巴结阳性组MMP-2的表达率明显高于淋巴结阴性组(P<0.05), 这提示MMP-2的高表达与食管癌淋巴结转移密切相关. 在TNM分期中, Ⅲ+Ⅳ组MMP-2表达率明显高于Ⅰ+Ⅱ组(P<0.05), 提示MMP-2表达促进了食管癌的侵袭和转移. 经统计学检验, MMP-2的表达与食管癌患者的性别和年龄不相关. 本次试验说明MMP-2的高表达可能与食管癌的进展有关, 是食管癌具有较强侵袭, 转移潜能和患者预后差的重要标志.
在恶性肿瘤中, 趋化因子及其受体结合可诱导蛋白水解酶的释放, 通过对细胞外基质和基膜的降解, 增强瘤细胞的侵袭能力. 有报道CXCR4活化后肿瘤细胞分泌更多的MMP、一氧化氮和血管生成因子(如VEGF)[11,12]. 本试验结果表明, 食管癌组织中CXCR4的表达与MMP-2的表达呈明显的正相关(r = 0.439), 说明CXCR4可能通过上调食管癌组织中MMP-2的表达, 共同参与食管癌的发展过程, 但其相关性及详细作用机制还需进一步研究.
食管癌在我国是一种发病率较高, 生存率较低的肿瘤. 食管癌的发生、发展涉及多个基因、分子水平的异常, 食管癌变是由多个基因参与, 多种因素共同作用的结果.
姜春萌, 教授, 大连医科大学附属第二医院消化科
了解高胃泌素血症与H.pylori感染在胃癌的发生、发展过程中的协同作用机制, 明确H.pylori感染诱发胃癌的机制, 是目前研究的热点.
本试验结果表明, 食管癌组织中CXCR4的表达与MMP-2的表达呈明显的正相关(r = 0.439), 说明CXCR4可能通过上调食管癌组织中MMP-2的表达, 共同参与食管癌的发展过程.
本研究设计基本合理, 方法选择适当, 结果可信, 但创新性一般.
编辑: 李军亮 电编:何基才
| 1. | Falleni M, Pellegrini C, Marchetti A, Oprandi B, Buttitta F, Barassi F, Santambrogio L, Coggi G, Bosari S. Survivin gene expression in early-stage non-small cell lung cancer. J Pathol. 2003;200:620-626. [PubMed] [DOI] |
| 3. | Rossi D, Zlotnik A. The biology of chemokines and their receptors. Annu Rev Immunol. 2000;18:217-242. [PubMed] [DOI] |
| 4. | Jones J, Marian D, Weich E, Engl T, Wedel S, Relja B, Jonas D, Blaheta RA. CXCR4 chemokine receptor engagement modifies integrin dependent adhesion of renal carcinoma cells. Exp Cell Res. 2007;313:4051-4065. [PubMed] [DOI] |
| 5. | Wang B, Love TM, Call ME, Doench JG, Novina CD. Recapitulation of short RNA-directed translational gene silencing in vitro. Mol Cell. 2006;22:553-560. [PubMed] [DOI] |
| 6. | Smith MC, Luker KE, Garbow JR, Prior JL, Jackson E, Piwnica-Worms D, Luker GD. CXCR4 regulates growth of both primary and metastatic breast cancer. Cancer Res. 2004;64:8604-8612. [PubMed] [DOI] |
| 7. | Kato M, Kitayama J, Kazama S, Nagawa H. Expression pattern of CXC chemokine receptor-4 is correlated with lymph node metastasis in human invasive ductal carcinoma. Breast Cancer Res. 2003;5:R144-R150. [PubMed] [DOI] |
| 8. | Kim J, Takeuchi H, Lam ST, Turner RR, Wang HJ, Kuo C, Foshag L, Bilchik AJ, Hoon DS. Chemokine receptor CXCR4 expression in colorectal cancer patients increases the risk for recurrence and for poor survival. J Clin Oncol. 2005;23:2744-2753. [PubMed] [DOI] |
| 9. | Burger JA, Kipps TJ. CXCR4: a key receptor in the crosstalk between tumor cells and their microenvironment. Blood. 2006;107:1761-1767. [PubMed] [DOI] |
| 10. | Parsons SL, Watson SA, Collins HM, Griffin NR, Clarke PA, Steele RJ. Gelatinase (MMP-2 and -9) expression in gastrointestinal malignancy. Br J Cancer. 1998;78:1495-1502. [PubMed] |
| 11. | Gürlek A, Karavitaki N, Ansorge O, Wass JA. What are the markers of aggressiveness in prolactinomas? Changes in cell biology, extracellular matrix components, angiogenesis and genetics. Eur J Endocrinol. 2007;156:143-153. [PubMed] [DOI] |
| 12. | Leelawat K, Leelawat S, Narong S, Hongeng S. Roles of the MEK1/2 and AKT pathways in CXCL12/CXCR4 induced cholangiocarcinoma cell invasion. World J Gastroenterol. 2007;13:1561-1568. [PubMed] |