修回日期: 2010-06-28
接受日期: 2010-07-05
在线出版日期: 2010-08-08
目的: 分析核转录因子-κB(NF-κB)表达及活化干预对肝癌细胞HepG2增殖的影响.
方法: 培养HepG2肝癌细胞并给予抗人肿瘤坏死因子(TNF)-α单克隆抗体, 以流式细胞术和Annexin V-FITC/PI双色标记法分别检测细胞周期时相和细胞凋亡的变化; 以酶联免疫吸附法(ELISA)定量分析肝癌组织及用药前后细胞培养液中TNF-α和核蛋白NF-κB的变化.
结果: 人肝癌的癌灶组织中NF-κB表达, 较癌旁组织明显增强(P<0.01); HepG2细胞培养给予抗TNF-α单克隆抗体(5 mg/L)后, 肝癌细胞凋亡率明显高于对照(21.45%±4.07% vs 5.63%±0.93%, q = 10.07, P<0.01); G0/G1明显高于对照(66.23%±1.29% vs 59.00%±1.02%, q = 10.98, P<0.01), 而S期细胞比例无明显改变; 用药后细胞株NF-κB水平明显低于对照(59.00 ng/mg±1.02 ng/mg核蛋白 vs 73.88 ng/mg±7.41 ng/mg核蛋白, q = 18.92, P<0.01), 与培养液中明显降低的TNF-α水平呈显著正相关(r = 0.89, P<0.01), 抑制效应呈浓度依赖性, 高浓度时作用最明显(P<0.01).
结论: 以TNF-α抗体干预NF-κB信号通路活化, 可使肝癌细胞凋亡增加, 细胞周期阻滞在G0/G1期, 肝癌细胞增殖明显抑制.
引文著录: 邵苏吉, 姚登福, 沈俊俊, 吴玮, 姚宁华. 肝癌组织NF-κB表达及活化干预对肝癌细胞增殖的影响. 世界华人消化杂志 2010; 18(22): 2296-2301
Revised: June 28, 2010
Accepted: July 5, 2010
Published online: August 8, 2010
AIM: To investigate the impact of intervention of nuclear factor-κB (NF-κB) activation with tumor necrosis factor-α (TNF-α) monoclonal antibody (TNF-α mab) on the proliferation of human hepatocellular carcinoma (HCC) HepG2 cells.
METHODS: HepG2 cells were cultured in vitro and incubated with TNF-α mab. The changes in cell cycle and apoptosis were detected by flow cytometry (FCM) and annexin-V/PI double staining assay, respectively. The expression of NF-κB and TNF-α in human liver cancer, tumor-adjacent liver tissue, and HepG2 cells were quantitatively analyzed by enzyme-linked immunosorbent assay (ELISA).
RESULTS: The expression level of NF-κB in human HCC was higher than that in tumor-adjacent liver tissue (P < 0.01). The percentage of apoptotic cells in HepG2 cells treated with TNF-α mab (5 mg/L) was higher than that in untreated HepG2 cells (21.45% ± 4.07% vs 5.63% ± 0.93%, q = 10.07, P < 0.01). The percentage of cells in G0/G1 phase was significantly higher in HepG2 cells treated with TNF-α mab than in untreated HepG2 cells (q = 10.98, P < 0.01) though no significant difference was noted in the percentage of cells in S phase between the two groups of cells. The level of NF-κB in HepG2 cells treated with TNF-α mab was lower than that in untreated HepG2 cells [59.00 ng/mg ± 1.02 ng/mg nuclear protein (NP) vs 73.88 ng/mg ± 7.41 ng/mg NP, q = 18.92, P < 0.01]. Increased NF-κB level is correlated with decreased TNF-α level in HepG2 cells treated with TNF-α mab (r = 0.89, P < 0.01). The inhibitory effect of TNF-α mab on TNF-α level is dose-dependent (P < 0.01).
CONCLUSION: Intervention of NF-κB activation by TNF-α mab inhibits the proliferation of HepG2 cells by inducing apoptosis and blocking the cells in G0/G1 phase.
- Citation: Shao SJ, Yao DF, Shen JJ, Wu W, Yao NH. Intervention of NF-κB activation inhibits the growth of human hepatocellular carcinoma HepG2 cells. Shijie Huaren Xiaohua Zazhi 2010; 18(22): 2296-2301
- URL: https://www.wjgnet.com/1009-3079/full/v18/i22/2296.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i22.2296
肝细胞癌(hepatocellular carcinoma, HCC)是在病毒、化学致癌物等多种因素的影响下, 因癌基因或癌相关基因激活、抗癌基因失活或胚胎期某些酶基因重新复活等诸多因素引起的肝细胞生长失控而致癌变, 期间经历了启动、促进、演变的多阶段发病过程, 并与基因调控和表达等密切相关[1-3]. 核转录因子-κB(nuclear factor-κB, NF-κB)是具有多向性调节作用的转录因子, 参与细胞增殖与凋亡的调节, 并且能直接影响细胞周期或DNA复制. 激活的NF-κB在炎症相关性HCC的发生发展中高表达, 在肝细胞慢性炎症和癌变之间起桥梁作用[4-6]. 肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)是一种致炎性细胞因子, 在慢性肝炎、HCC发生时TNF-α表达明显升高, 炎症性介质TNF-α如何参与肝细胞癌变, 其机制有待探讨[6-8]. 我们对人肝癌及癌旁组织中的NF-κB进行定量分析, 并在体外培养HepG2细胞株, 给予不同浓度抗TNF-α单克隆抗体, 动态观察细胞凋亡和周期时相变化、NF-κB和TNF-α变化, 以探讨经抗TNF-α干预NF-κB活化通路对HepG2细胞增殖的影响.
人HepG2肝癌细胞株, 由南京凯基生物科技发展有限公司提供. LEAFTM Purified anti-human TNF-α单克隆抗体(BioLegend, 美国)购自达科为生物技术有限公司; RPMI 1640及胎牛血清购于Hyclone公司; 0.25%胰蛋白酶溶液、青霉素-链霉素溶液(100×)、L-谷氨酰胺溶液(100×)、磷酸盐缓冲液、二甲基亚砜、Annexin-V-FITC凋亡检测试剂盒、碘化丙啶、RNaseA及Triton X-100、细胞核蛋白与细胞质蛋白抽提试剂盒、BCA蛋白浓度测定试剂盒均购自碧云天生物技术有限公司; 人NF-κB ELISA试剂盒(Cusabio, 美国)购自武汉华美生物技术有限公司; 人TNF-α ELISA检测试剂盒(ADL, 美国)购自上海生物工程技术有限公司.
1.2.1 人肝癌组织与总RNA制备: 收集2009-03/2009-12手术后新鲜肝癌组织标本, 按自身配对原则, 留取癌和癌旁组织共30份, 每份约200 mg, 经病理学检查均为原发性肝癌, 肝组织置于-85 ℃冰箱保存备用. 取肝组织50 mg置于无RNA酶匀浆器中, 加入TRIzol RNA抽提试剂(Gibco公司)1.0 mL匀浆, 氯仿, 异丙醇, 乙醇等制备总RNA, 于60 ℃, 10 min. 在UV2201型紫外分光光度计上测定A260和A280值, 比率为1.8-2.0.
1.2.2 肝匀浆制备和核蛋白提取: 在分析天平上称取肝组织50 mg, 剪成非常细小的组织碎片置于经高压灭菌的匀浆器中, 再按细胞核蛋白与细胞质蛋白抽提试剂盒的使用说明进行操作, 方法主要为: 加入适当量的组织匀浆液, 冰浴中充分匀浆, 经离心后移去上清, 再加入含有PMSF的细胞质蛋白抽提试剂A, 震荡和冰浴后加入试剂B, 再次震荡, 冰浴, 离心后移去上清, 此时加入含有PMSF的核蛋白提取试剂, 经反复震荡冰浴共30 min后, 离心吸取上清(即核蛋白), 置于-85 ℃冰箱保存备用. 以上抽提蛋白的所有步骤均在冰上或4 ℃进行.
1.2.3 细胞培养及分组: HepG2肝癌细胞常规复苏后, 以完全培养液(含100 mL/L胎牛血清、100 kU/L青霉素、100 mg/L链霉素及1% L-谷氨酰胺的RPMI 1640培养液, 简称完培)在37 ℃, 50 mL/L CO2及100%湿度的条件下培养. 适时传代, 取对数生长期的细胞进行实验. 将细胞分为单抗组和对照组, 每组设3个复孔. 抗人TNF-α单克隆抗体, 稀释成5、0.5、0.05 mg/L 3个浓度, 对照组不加任何药物. 48 h后收集细胞备用.
1.2.4 细胞周期时相的变化: 取对数生长期细胞, 调整细胞密度为105/mL, 以每孔2×105细胞接种于6孔培养板, 常规培养24 h后弃去培养基, 加入无血清的RPMI 1640培养24 h使细胞周期同步化, 然后换用添加药物的完全培养基2 mL进行培养. 48 h后以0.25%胰蛋白酶消化收集细胞, 离心1 000 r/min×5 min, 弃上清液, PBS洗涤细胞2次. 以预冷(-20 ℃)的700 mL/L乙醇2 mL固定(4 ℃, 72 h). 离心1 000 r/min×5 min, 除去固定液, PBS洗涤细胞2次. 在细胞沉淀中加入1 mL碘化丙啶(propidium iodide, PI)混合染液(柠檬酸三钠0.25 g, Triton X-100 0.75 g, PI 0.025 g, 核糖核酸酶0.005 g, 双蒸水250 mL), 4 ℃避光放置30 h. 过300目细胞筛网, 以488 nm波长为激发光上机检测, Macguit软件分析细胞周期分布.
1.2.5 细胞凋亡检测: 取对数生长期细胞, 调整细胞密度为105/mL, 以每孔5×104细胞接种于24孔培养板, 常规培养24 h后弃去培养基, 换用添加了药物的完培0.5 mL继续培养, 48 h后吸出各孔培养液至离心管, PBS洗涤细胞2次, 以0.25%胰蛋白酶消化收集细胞于对应的离心管内, 离心1 000 r/min×5 min, 弃上清, PBS洗涤细胞2次, 弃上清. 加入195 μL Annexin V-FITC结合液(1×)轻轻重悬细胞, 再加入5 μL Annexin V-FITC, 轻轻混匀, 室温(20 ℃-25 ℃)避光孵育10 min. 离心1 000 r/min×5 min, 弃上清, 加入190 μL Annexin V-FITC结合液(1×)轻轻重悬细胞. 加入10 μL PI染色液, 轻轻混匀, 冰浴避光放置. 使用流式细胞仪进行检测分析.
1.2.6 细胞收集: 取对数生长期的细胞, 调整细胞密度为105/mL, 以每孔2×105细胞接种于6孔培养板, 常规培养24 h时后弃去培养基, 换用添加了药物的完培2 mL进行培养. 48 h后吸出各孔内的培养液, -80 ℃保存备用. 细胞以PBS清洗2次, 用细胞刮子收集细胞于离心管内, 1 000 r/min×5 min. 弃上清液, 留下细胞沉淀. 按照细胞核蛋白与浆蛋白抽提试剂盒说明书提取细胞核蛋白, 以BCA法测定核蛋白的浓度.
1.2.7 NF-κB定量分析: NF-κB活性测定按TransAM(Active Motif提供)的具体说明进行. 其方法: 每孔加结合缓冲液30 μL和10 μL细胞核蛋白提取液, 并加细胞裂解液(cell lysis buffer, CLB)20 μL. 阳性对照孔中加2.5 μg Jurkat核提取物并稀释到20 μL CLB中, 空白孔中只加20 μL CLB液体. 标准孔中依次加20 μL重组蛋白质P50或P65, 封板后置于震荡培养箱中室温孵育1 h. 每孔以洗涤液200 μL洗3次. 然后加入100 μL稀释的NF-κB抗体, 封板后置室温孵育1 h, 再以洗涤液200 μL洗3次. 每孔加100 μL HRP结合的抗体, 封板后置室温震荡1 h, 以洗涤液200 μL洗4次. 每孔加100 μL显色剂, 室温置2-10 min, 每孔加终止液100 μL, 测定A450nm值, 根据标准曲线计算出蛋白浓度.
1.2.8 TNF-α浓度测定: 取出浆蛋白提取液中总浆蛋白浓度以BCA法测定, 临用前试剂A和B以50:1配制成适量BCA工作液. 取蛋白标准品10 μL用9 g/L生理盐水稀释到100 μL. 将标准品按0, 1, 2, 4, 8, 12, 16和20 μL加到96孔板的标准品孔中, 除最后1孔外其余加标准品稀释液补足至20 μL. 根据样品浓度的高低, 加适当体积样品到样品孔中, 加标准品稀释液到20 μL, 各孔加入200 μL BCA工作液, 37 ℃放置30 min, 在酶标分析仪上578 nm处测定其A值, 按标准曲线计算蛋白浓度. 肝组织匀浆及血清中TNF-α水平测定严格按操作说明书进行.
统计学处理 数据以mean±SD表示, 多个样本均数间的比较先进行方差齐性检验, 方差相等时采用t检验或者方差分析, 用Stata7.0统计软件处理数据, 以P<0.05表示差别有统计学意义.
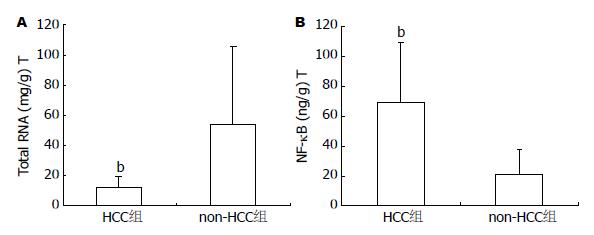
肝癌组织中核酸代谢旺盛, 人HCC组织总RNA表达水平(比浓度: 每毫克湿质量肝组织中总RNA微克数)明显低于自身的癌周(non-HCC)组织(P<0.01, 图1A), 因癌灶组织中存在更多的坏死组织所致; 而癌周组织中NF-κB表达水平, 以湿质量肝组织的比浓度计算, 癌组与癌旁组NF-κB表达差异明显, 癌组NF-κB比浓度大约是癌旁组的3倍(P<0.01, 图1B); 如以肝微克RNA计算NF-κB比浓度, 癌组织NF-κB表达水平则十分显著地高于癌周组织(P<0.01).
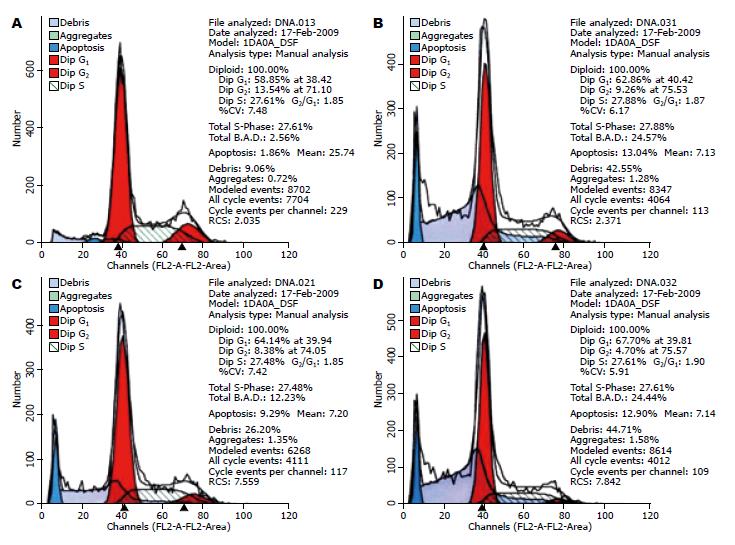
经不同浓度TNF-α单抗(0.05、0.5、5 mg/L)作用后, HepG2细胞周期时相发生了改变(表1, 图2). 单抗组G0/G1期细胞比例明显高于对照组, 且呈现剂量依赖性. 随着单抗浓度增加, G0/G1期比例升高, 以5 mg/L时最高(P<0.01), 而S期比率无明显改变(P>0.05). 经0.05、0.5和5 mg/L TNF-α单抗作用后, 在DNA组方图(图2)可见明显的凋亡峰出现, 且随TNF-α单抗浓度的增加, HepG2细胞的凋亡比率也随之逐渐增高.
TNF-α单抗作用后, HepG2细胞凋亡率明显增加, 呈现剂量依赖性(表2). 随着单抗浓度增加, 凋亡细胞比例明显上升, 5 mg/L时达到最高(P<0.01), 但中、低浓度组凋亡率未见统计学意义(P>0.05).
| 浓度(mg/L) | 早期凋亡率(%) | q值 | P值 |
| 对照组 | 5.63±0.93 | ||
| 0.05 | 8.93±2.49 | 2.10 | >0.05 |
| 0.5 | 10.27±2.44 | 2.96 | >0.05 |
| 5 | 21.45±4.07b | 10.07 | <0.01 |
NF-κB是一种能与免疫球蛋白κ轻链基因的增强子κB序列特异性结合的蛋白质因子, 具有广泛生物学活性[9,10]. NF-κB能调节许多细胞因子、生长因子的转录, 参与细胞增殖与凋亡的调节, 且能直接作用于细胞周期或DNA复制, 导致肿瘤的发生发展. 除胚胎细胞外, 正常细胞中NF-κB表达很少, 且在κB抑制因子(inhibitor κB, IκB)作用下处于失活状态, 但在肿瘤细胞中NF-κB被激活. HCC发生发展具有多病因、多中心和多阶段的特征, 其病原学因素主要为HBV、HCV感染. 我国HCC患者中90%伴HBV感染, HBV或HCV的持续感染, 肝细胞长期慢性炎症导致肝硬化, 最终发展为肝癌[11,12]. 肝癌组织中核酸代谢旺盛, 肝炎病毒感染能刺激NF-κB表达并使其DNA结合能力增强, 胞内NF-κB异常与HCC发生发展密切相关.
正常肝细胞中NF-κB异二聚体在胞质内与IκB结合, 当他受到细胞因子、有丝分裂原、病毒等刺激剂激活后, IκB发生磷酸化并降解, NF-κB核定位信号暴露并转入核内与靶基因的κB基序结合, 增强其表达, NF-κB在细胞增殖和凋亡中扮演重要的角色. 在诱癌过程中随着肝细胞癌变的发生, NF-κB的水平越来越高, 在肝细胞变性组, 其总体趋势已明显高于正常对照组, 在肝细胞发生癌变时, 其活性达高峰[13,14], 提示HCC是NF-κB高表达肿瘤, NF-κB可参与肝细胞的癌变过程, 浓度的进行性增加可反映肝细胞的早期癌变, 可见NF-κB在肝癌发生发展中的重要作用[15,16].
HBV和HCV的慢性持续感染与肝癌发生关系极为密切, HBxAg主要通过ras-raf-map激酶通路激活NF-κB, 而HCV核心蛋白可能通过与TNF受体Ⅰ和LTβ受体结合后激活NF-κB, 抑制携带肝炎病毒的肝细胞的凋亡, 促进其增生[17,18]. 肝炎病毒利用各种通路激活NF-κB, 促使病毒复制, 细胞向恶性转变, 抑制癌细胞凋亡. 病毒感染的癌组织中NF-κB表达均高于正常肝组织, HBxAg阳性癌组织的胞质及胞核均有NF-κB表达, 而HBxAg阴性癌组织中, NF-κB仅见胞质; 若将PCDNA3-1-HBX转导至人HCC细胞株HCC-9204时, NF-κB可在癌细胞的胞核中出现, 说明HBxAg能激活NF-κB并使其转移至癌细胞核[19,20]. 本研究中人肝癌组织及癌旁组织中均能定量检测到NF-κB活性, 且癌组织明显高于癌旁组织, 可见肝癌细胞NF-κB增强表达与癌细胞生长密切相关.
TNF-α为非糖基化蛋白多肽, 主要是由巨噬细胞产生, 具有多种生理活性. 活化的NF-κB能抑制细胞的凋亡, 在肝脏发育过程中能保护胚胎肝细胞免受TNF-α等介导的凋亡. NF-κB活化与肝癌发生发展有关, TNF-α的转录受NF-κB调控, 且他又以自分泌或旁分泌方式作用于细胞, 诱导细胞凋亡同时也激活NF-κB, 促使细胞建立快速防御机制, 发挥抗凋亡作用[21,22]. 给予TNF-α单抗后, HepG2细胞培养液中可检出TNF-α, 其水平明显低于对照组, 浓度越高, 中和的效果越好; NF-κB水平在单抗组明显低于对照组, TNF-α与NF-κB水平呈正相关. 提示TNF-α单抗消耗培养液中TNF-α干预NF-κB活化, 抑制NF-κB进入细胞核内发挥转录作用.
NF-κB是多种抗凋亡基因表达的主要激活子, 而TNF-α所介导的NF-κB信号通路的活化是肝癌细胞抵抗凋亡、耐药的原因之一[23-25]. 给予TNF-α抗体, HepG2细胞凋亡明显增加, 并呈现剂量依赖性, TNF-α单抗可间接促进肝癌细胞的凋亡. 主要是通过抑制NF-κB活化, 影响TNF-α和NF-κB间正反馈调节机制, 减弱其抗凋亡效应而发挥作用. 恶性肿瘤发生发展与细胞周期的紊乱密切相关. NF-κB能直接作用于细胞周期或DNA复制, 通过促进cyclin D的表达促使细胞周期从G0/G1期向S期转化, 使细胞增殖失控从而参与肿瘤的发生发展. TNF-α抗体组G0/G1期比率明显高于对照组, 而S期无明显改变. 说明单抗抑制NF-κB活化, HepG2细胞分裂增殖受到抑制, 细胞周期阻滞在G0/G1期, 表明TNF-α单抗干预NF-κB活化可抑制癌细胞增殖. 本研究表明TNF-α单抗能明显抑制NF-κB信号通路的活化, 诱导癌细胞凋亡, 使细胞周期阻滞在G0/G1期, 其在肝癌的免疫治疗中具有良好的应用前景[26,27].
NF-κB活化与肝癌发生发展有关, TNF-α的转录受NF-κB调控, 且他又以自分泌或旁分泌方式作用于细胞, 诱导细胞凋亡同时也激活NF-κB, 促使细胞建立快速防御机制, 发挥抗凋亡作用.
郑鹏远, 教授, 郑州大学第二附属医院消化科
肿瘤坏死因子-α (TNF-α)是一种致炎性细胞因子, 在慢性肝炎、HCC发生时TNF-α表达明显升高, 炎症性介质TNF-α如何参与肝细胞癌变, 其机制有待探讨.
本研究对人肝癌及癌旁组织中的NF-κB进行定量分析, 并在体外培养HepG2细胞株, 给予不同浓度抗TNF-α单克隆抗体, 动态观察细胞凋亡和周期时相变化、NF-κB和TNF-α变化, 以探讨经抗TNF-α干预NF-κB活化通路对HepG2细胞增殖的影响.
在小鼠肝癌模型中采用TNF-α抗体干预, 可以阻断NF-κB活化, 促使异型肝细胞发生凋亡, 使肝细胞癌变进程受到抑制, 可见TNF-α抗体能用于炎症相关性肝癌的治疗.
本文立题明确, 方法较为先进, 具有一定的理论意义和潜在的临床价值.
编辑: 李军亮 电编:何基才
| 1. | Jain S, Singhal S, Lee P, Xu R. Molecular genetics of hepatocellular neoplasia. Am J Transl Res. 2010;2:105-118. [PubMed] |
| 2. | Fernández M, Semela D, Bruix J, Colle I, Pinzani M, Bosch J. Angiogenesis in liver disease. J Hepatol. 2009;50:604-620. [PubMed] [DOI] |
| 3. | Lee CF, Ling ZQ, Zhao T, Fang SH, Chang WC, Lee SC, Lee KR. Genomic-wide analysis of lymphatic metastasis-associated genes in human hepatocellular carcinoma. World J Gastroenterol. 2009;15:356-365. [PubMed] [DOI] |
| 4. | Cho HA, Park IS, Kim TW, Oh YK, Yang KS, Kim JS. Suppression of hepatitis B virus-derived human hepatocellular carcinoma by NF-kappaB-inducing kinase-specific siRNA using liver-targeting liposomes. Arch Pharm Res. 2009;32:1077-1086. [PubMed] [DOI] |
| 5. | Wang C, Lu Y, Chen Y, Feng Y, An L, Wang X, Su S, Bai W, Zhou L, Yang Y. Prognostic factors and recurrence of hepatitis B-related hepatocellular carcinoma after argon-helium cryoablation: a prospective study. Clin Exp Metastasis. 2009;26:839-848. [PubMed] [DOI] |
| 6. | Okamoto T, Sanda T, Asamitsu K. NF-kappa B signaling and carcinogenesis. Curr Pharm Des. 2007;13:447-462. [PubMed] [DOI] |
| 7. | Li H, Lin X. Positive and negative signaling components involved in TNFalpha-induced NF-kappaB activation. Cytokine. 2008;41:1-8. [PubMed] [DOI] |
| 8. | He Y, Zhang H, Yin J, Xie J, Tan X, Liu S, Zhang Q, Li C, Zhao J, Wang H. IkappaBalpha gene promoter polymorphisms are associated with hepatocarcinogenesis in patients infected with hepatitis B virus genotype C. Carcinogenesis. 2009;30:1916-1922. [PubMed] [DOI] |
| 9. | Vainer GW, Pikarsky E, Ben-Neriah Y. Contradictory functions of NF-kappaB in liver physiology and cancer. Cancer Lett. 2008;267:182-188. [PubMed] [DOI] |
| 10. | Berasain C, Castillo J, Perugorria MJ, Latasa MU, Prieto J, Avila MA. Inflammation and liver cancer: new molecular links. Ann N Y Acad Sci. 2009;1155:206-221. [PubMed] [DOI] |
| 11. | Amann T, Bataille F, Spruss T, Mühlbauer M, Gäbele E, Schölmerich J, Kiefer P, Bosserhoff AK, Hellerbrand C. Activated hepatic stellate cells promote tumorigenicity of hepatocellular carcinoma. Cancer Sci. 2009;100:646-653. [PubMed] [DOI] |
| 12. | Sakai T, Liu L, Teng X, Ishimaru N, Mukai-Sakai R, Tran NH, Kim SM, Sano N, Hayashi Y, Kaji R. Inflammatory disease and cancer with a decrease in Kupffer cell numbers in Nucling-knockout mice. Int J Cancer. 2010;126:1079-1094. [PubMed] |
| 13. | Wu W, Yao DF, Qiu LW, Sai WL, Shen JJ, Yu HB, Wu XH, Li YM, Wang YL, Gu WJ. Characteristics of hepatic nuclear- transcription factor-kappa B expression and quantitative analysis in rat hepatocarcinogenesis. Hepatobiliary Pancreat Dis Int. 2009;8:504-509. [PubMed] |
| 14. | Zhang X, Liu S, Hu T, Liu S, He Y, Sun S. Up-regulated microRNA-143 transcribed by nuclear factor kappa B enhances hepatocarcinoma metastasis by repressing fibronectin expression. Hepatology. 2009;50:490-499. [PubMed] [DOI] |
| 15. | Kim HR, Lee SH, Jung G. The hepatitis B viral X protein activates NF-kappaB signaling pathway through the up-regulation of TBK1. FEBS Lett. 2010;584:525-530. [PubMed] [DOI] |
| 16. | Yoneda K, Sugimoto K, Shiraki K, Tanaka J, Beppu T, Fuke H, Yamamoto N, Masuya M, Horie R, Uchida K. Dual topology of functional Toll-like receptor 3 expression in human hepatocellular carcinoma: differential signaling mechanisms of TLR3-induced NF-kappaB activation and apoptosis. Int J Oncol. 2008;33:929-936. [PubMed] |
| 17. | Feng YX, Zhao JS, Li JJ, Wang T, Cheng SQ, Yuan Y, Wang F, Wang XF, Xie D. Liver cancer: EphrinA2 promotes tumorigenicity through Rac1/Akt/NF-kappaB signaling pathway 120:. Hepatology. 2010;51:535-544. [PubMed] |
| 18. | Jiang R, Xia Y, Li J, Deng L, Zhao L, Shi J, Wang X, Sun B. High expression levels of IKKalpha and IKKbeta are necessary for the malignant properties of liver cancer. Int J Cancer. 2010;126:1263-1274. [PubMed] |
| 19. | Németh J, Stein I, Haag D, Riehl A, Longerich T, Horwitz E, Breuhahn K, Gebhardt C, Schirmacher P, Hahn M. S100A8 and S100A9 are novel nuclear factor kappa B target genes during malignant progression of murine and human liver carcinogenesis. Hepatology. 2009;50:1251-1262. [PubMed] [DOI] |
| 20. | Carlisi D, Lauricella M, D'Anneo A, Emanuele S, Angileri L, Di Fazio P, Santulli A, Vento R, Tesoriere G. The histone deacetylase inhibitor suberoylanilide hydroxamic acid sensitises human hepatocellular carcinoma cells to TRAIL-induced apoptosis by TRAIL-DISC activation. Eur J Cancer. 2009;45:2425-2438. [PubMed] [DOI] |
| 21. | Cheng KS, Tang HL, Chou FT, Chou JW, Hsu CH, Yu CJ, Kao ST, Li TC. Cytokine evaluation in liver cirrhosis and hepatocellular carcinoma. Hepatogastroenterology. 2009;56:1105-1110. [PubMed] |
| 22. | Kummee P, Tangkijvanich P, Poovorawan Y, Hirankarn N. Association of HLA-DRB1*13 and TNF-alpha gene polymorphisms with clearance of chronic hepatitis B infection and risk of hepatocellular carcinoma in Thai population. J Viral Hepat. 2007;14:841-848. [PubMed] |
| 23. | Auyeung KK, Law PC, Ko JK. Astragalus saponins induce apoptosis via an ERK-independent NF-kappaB signaling pathway in the human hepatocellular HepG2 cell line. Int J Mol Med. 2009;23:189-196. [PubMed] |
| 24. | Sun W, Zhong F, Zhi L, Zhou G, He F. Systematic -omics analysis of HBV-associated liver diseases. Cancer Lett. 2009;286:89-95. [PubMed] [DOI] |
| 25. | Wang F, Kaur S, Cavin LG, Arsura M. Nuclear-factor-kappaB (NF-kappaB) and radical oxygen species play contrary roles in transforming growth factor-beta1 (TGF-beta1)-induced apoptosis in hepatocellular carcinoma (HCC) cells. Biochem Biophys Res Commun. 2008;377:1107-1112. [PubMed] [DOI] |
| 26. | Calvisi DF, Pascale RM, Feo F. Dissection of signal transduction pathways as a tool for the development of targeted therapies of hepatocellular carcinoma. Rev Recent Clin Trials. 2007;2:217-236. [PubMed] [DOI] |
| 27. | Wu JM, Sheng H, Saxena R, Skill NJ, Bhat-Nakshatri P, Yu M, Nakshatri H, Maluccio MA. NF-kappaB inhibition in human hepatocellular carcinoma and its potential as adjunct to sorafenib based therapy. Cancer Lett. 2009;278:145-155. [PubMed] [DOI] |