修回日期: 2010-06-18
接受日期: 2010-06-28
在线出版日期: 2010-07-28
目的: 探讨TLR2和TLR4 mRNA表达与脂多糖(lipopolysaccharide, LPS)诱导的肠组织损伤之间的关系.
方法: 日龄10 d的Wistar幼鼠56只随机分为对照组(生理盐水1 mL/kg, ip, n = 8), 实验组(LPS, 5 mg/kg, ip, n = 48). 对照组于注射生理盐水后3 h, 实验组腹腔注射LPS后于不同时间点(3、6、12、24、48和72 h)取近回盲端回肠组织, HE染色观察病理改变; RT-PCR法检测肠组织TLR2、4 mRNA的表达.
结果: TLR2 mRNA在对照组呈现比较弱的表达, 在实验组给予LPS后3、6 h表达明显增强(4.068±0.86, 5.314±1.82 vs 1.390±0.04, 均P<0.01), 在72 h达高峰(10.401±1.73 vs 1.390±0.04, P<0.01). TLR4 mRNA在对照组表达较明显, 在实验组给予LPS后3 h表达量达到高峰(16.711±1.28 vs 9.907±0.33, P<0.01), 6、12 h有所下降, 24、48 h又复增强, 72 h明显下降(7.055±1.27 vs 9.907±0.33).
结论: TLR2、4 mRNA表达与LPS诱导的肠组织损伤关系密切.
引文著录: 荆科, 孙梅. TLR2和TLR4 mRNA表达与LPS诱导肠组织损伤的关系. 世界华人消化杂志 2010; 18(21): 2197-2201
Revised: June 18, 2010
Accepted: June 28, 2010
Published online: July 28, 2010
AIM: To determine the relationship between Toll-like receptors 2 and 4 (TLR2 and TLR4) mRNA expression and lipopolysaccharide (LPS)-induced intestinal injury in rats.
METHODS: Fifty-six Wistar rat pups aged 10 d were randomly divided into control group (normal saline 1 mL/kg, ip, n = 8) and LPS group (LPS 5 mg/kg, ip, n = 48). The rats in the control group were sacrificed 3 h after treatment, while those in the LPS group were sacrificed at 3, 6, 12, 24, 48 and 72 h after injection of LPS. The intestinal tissue was dissected for histopathologic analysis. The expression of TLR2 and 4 mRNAs in intestinal tissue was detected by RT-PCR.
RESULTS: The expression of TLR2 mRNA was weak in the intestine of rats in the control group, while TLR4 mRNA was highly expressed in the intestine of rats in the control group. The expression of TLR2 mRNA was markedly increased at 3 and 6 h (4.068 ± 0.86 and 5.314 ± 1.82 vs 1.390 ± 0.04, both P < 0.01) after intraperitoneal injection of LPS, peaking at 72 h (10.401 ± 1.73 vs 1.390 ± 0.04, P < 0.01). TLR4 mRNA expression was significantly increased at 3 h (16.711 ± 1.28 vs 9.907 ± 0.33, P < 0.01) after intraperitoneal LPS injection, but markedly decreased at 72 h (7.055 ± 1.27 vs 9.907 ± 0.33).
CONCLUSION: TLR2 and TLR4 mRNA expression is related with LPS-induced intestinal injury in rats.
- Citation: Jing K, Sun M. Relationship between TLR2 and TLR4 mRNA expression and LPS-induced intestinal injury in rats. Shijie Huaren Xiaohua Zazhi 2010; 18(21): 2197-2201
- URL: https://www.wjgnet.com/1009-3079/full/v18/i21/2197.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i21.2197
败血症是临床常见的危重疾病, 具有较高的发病率和死亡率. 细菌感染引起的内毒素血症可导致肠组织的损伤, 导致肠屏障功能损害, 引起肠道内细菌移位, 加重全身感染. 内毒素可引起肠组织合成和释放促炎因子增加, 如TNF-α, IL-1等, 引起肠组织损伤, 过多的促炎因子释放可引起全身炎症反应综合征, 导致多器官功能障碍综合征和多器官功能衰竭[1-3]. Toll样受体(Toll-like receptor, TLR)是近年发现的免疫受体, 具有跨膜信号转导功能, 他能识别侵入机体的病原体, 启动先天性免疫反应[4-7]. 正常情况下, 肠道寄生菌并不引起机体反应. 在内毒素血症时, 促炎因子的合成、增加释放与TLR的相互关系并不清楚. 本文通过对LPS诱导的肠道组织损伤时TLR表达的研究, 探讨TLR的表达与肠组织损伤的关系.
清洁级Wistar幼鼠56只, 日龄10 d, 雌雄不限, 体质量为15-25 g, 由中国医科大学附属二院医学实验动物中心提供,许可证号: SCXK(辽)2003-0009. 脂多糖(lipopolysaccharide, LPS, Escherichia coli O55: B5)购于Sigma公司. RT-PCR一步法试剂盒购于大连宝生物公司(日本TaKaRa公司), PCR引物根据Medline数据库自行设计, 由上海英骏生物公司合成.
1.2.1 分组和造模: 将56只幼鼠随机分为对照组(A组, n = 8)和实验组(n = 48). 对照组给予生理盐水(normal saline, NS)1 mL/kg, ip. 实验组给予LPS 5 mg/kg, ip. 实验组根据LPS ip后时间点, 分为3、6、12、24、48、72 h(B、C、D、E、F、G, 每组8只)6组. 对照组于注射后3 h, 实验组于相应时间点处死, 取距回盲端0.5-1 cm回肠组织, 分别于液氮速冻和40 g/L甲醛固定, 以待检测和分析.
1.2.2 观察肠组织病理改变: 取肠组织40 g/L甲醛固定, HE染色, 观察肠组织病理改变.
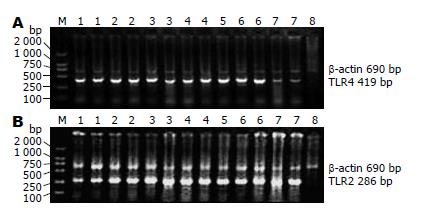
1.2.3 应用RT-PCR检测TLR2、4 mRNA的表达: (1)总RNA的提取: 按TRIzol总RNA提取试剂说明书进行操作; (2)反转录合成cDNA: 按以下条件进行反转录反应: 混匀后65 ℃ 1 min, 30 ℃ 5 min,于30 min内匀速升温至65 ℃ 30 min, 98 ℃ 5 min, 5 ℃ 5 min, 其产物即cDNA; (3) RT-PCR检测TLR2、4 mRNA表达: 取cDNA 3 μL(1 μg), 10×Buffer 2 μL, MgCl2 4 μL, 10 mmol/L dNTPs 2 μL, 引物100 ng, TagDNA多聚酶1 U. 总体系20 μL. 引物与循环条件见表1. 取PCR产物20 g/L琼脂糖凝胶电泳, 并测定积分吸光度.
| 引物名称 | 扩增片段(bp) | 循环条件 |
| TLR2 | 94 ℃ 3 min, 94 ℃ 40 s | |
| F: 5'-CGC TTC CTG AAC TTG TCC -3' | 286 | 51.5 ℃ 1 min,72 ℃ 1 min |
| R: 5'-GGT TGT CAC CTG CTT CCA -3' | 35个循环后, 72 ℃ 7 min | |
| TLR4 | 94 ℃ 3 min, 94 ℃ 40 s | |
| F: 5'-CCA GAG CCG TTG GTG TAT -3' | 419 | 53.5 ℃ 1min, 72 ℃ 1 min |
| R: 5'-GCC CTG TGA GGT CGT TGA -3' | 35个循环后, 72 ℃ 7 min | |
| β-actin | 94 ℃ 3 min, 94 ℃ 40 s | |
| F: 5'-CAC CCT GTG CTG CTC ACC GAG GCC -3' | 690 | 55 ℃ 1 min,72 ℃ 1.5 min |
| R: 5'-CCA CAC AGA TGA CTT GCG CTC AGG -3' | 35个循环后, 72 ℃ 7 min |
统计学处理 所有数据均以mean±SD表示, 采用SPSS13.0统计软件包, 进行方差分析, 组间比较采用LSD法检验, P<0.05为差异有显著性.
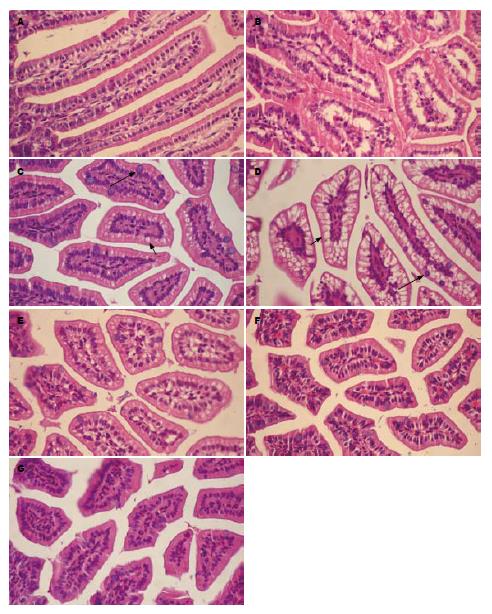
对照组肠绒毛完整, 上皮细胞排列整齐, 杯状细胞少见, 无明显异常改变(图1A). 实验组给予LPS后3 h肠组织可见明显异常, 绒毛间质可见有充血, 少许炎性细胞浸润, 水肿明显, 肠上皮细胞排列紊乱, 细胞水肿(图1B); 6 h见间质水肿吸收, 充血不明显, 杯状细胞增加(长黑色箭头所示), 上皮细胞仍水肿, 细胞呈透明样变(短黑色箭头所示, 图1C); 12 h上述变化更加明显, 细胞水肿加重, 杯状细胞增加(图1D); 24 h可见绒毛间质、上皮细胞水肿明显减轻, 杯状细胞仍较多(图1E); 48 h上述改变明显恢复, 间质充血明显, 上皮细胞密度增加, 有增生改变(图1F); 72 h恢复明显, 上皮细胞增生明显增多. 杯状细胞较多(图1G).
在对照组TLR2 mRNA表达较弱, TLR4 mRNA表达较明显. TLR2 mRNA在实验组各时间点表达明显高于对照组, 且差异非常显著(P<0.01); TLR2 mRNA表达逐渐增高, 于72 h达高峰. TLR4 mRNA表达在LPS ip 3 h即达到高峰, 显著高于对照组(P<0.01), 然后下降, 于12 h下降明显; 于24、48 h又复增高, 明显高于对照组, 差异非常显著(P<0.01); 于72 h明显下降, 且低于对照组, 差异显著(P<0.01, 表2, 图2).
肠道是人体聚集细菌最丰富的场所, 但正常情况下并不引起机体发生免疫反应, 而形成了免疫耐受, 这种免疫耐受对机体免遭病原体及其代谢产物的攻击是非常重要的. 其机制复杂多样. 但在感染时, 机体免疫功能出现了变化. 在病原体和代谢产物的作用下, 能导致多器官、多脏器受损, 而肠道是最易受损的器官之一. 肠道是机体最大的免疫器官. 在感染时, 由于肠道屏障功能受损, 肠道细菌移位, 引起远隔脏器的感染. 同时肠组织在病原体和代谢产物的刺激下可合成和释放大量的促炎因子和抑炎因子, 这是引起和加重全身炎症反应综合征的重要环节. 但这种机制仍不是十分清楚.
在本研究中, 通过对肠组织形态学变化的检测观察到, 在注射LPS后3、6 h肠组织出现水肿, 炎性细胞浸润, 出现玻璃样物质, 24 h后渐恢复, 这表明腹腔注射LPS后可诱导肠组织损伤.
TLR是跨膜蛋白, 能识别病原微生物及其细胞壁具有的特殊结构, 并能将信号传导到细胞内, 激活NF-κB, 促进炎症介质的释放[8,9], 导致肠组织的损伤. 正常情况下, 在肠道组织中, TLR表达较少, TLR2和TLR4在正常鼠消化道的表达是呈不同分布的. 有研究表明[10]TLR4 mRNA表达主要在胃和结肠的远端, 小肠远端有较弱的表达; 而TLR2主要表达在结肠的近端, 小肠远端有非常弱的表达. 我们观察到在回盲端的回肠TLR4 mRNA有弱的表达, TLR2 mRNA表达较弱, 与文献报道相一致. 我们在观察给予LPS不同时间点的肠组织病理变化的同时, 也观察了肠组织TLR2、4 mRNA的表达变化. 腹腔注射LPS后3、6 h, TLR2 mRNA表达明显上调, 72 h达到高峰; TLR4 mRNA 3 h达高峰, 72 h明显下降. TLR4 mRNA变化与肠损伤的病理变化较一致. 推测TLR4与肠组织的损伤密切相关, TLR4是介导LPS引起肠组织损伤的重要信号转导分子.
最近的许多研究支持在体内和体外TLR2、4是与LPS反应的主要调节因子[11-16]. 有研究表明[17,18]TLR2与TLR4在正常肠组织中的定位和表达的差别是与他们在肠道中的不同作用相关的. 而TLR4是作为LPS的受体起主要作用[12-14].
TLR2也被认为是LPS的信号转导分子, 但需要血清LBP的参与. 本研究表明肠组织损伤中TLR4可能起主要的作用. 但TLR2在LPS刺激后也有明显的上调表达, TLR2的作用有待进一步研究.
TLR是能识别病原微生物的免疫受体, 通过信号转导激发天然免疫反应, 导致组织损伤. 脂多糖是细菌产生的内毒素, 能引起内毒素血症, 导致多脏器损伤, 最常见的是肠组织损伤, 进一步可导致全身炎症反应综合征. 脂多糖引起的肠组织损伤是否与TLR表达相关尚不十分清楚.
陈秋生, 教授, 南京农业大学动物医学院基础医学系.
TLR是一种免疫受体, 可识别外源性微生物和其产生的毒素, 通过信号转导介导免疫反应. 在内毒素引起的肠损伤中, TLR是否起转导作用, TLR2、4哪一个起主导作用, 及在正常肠组织中的表达是目前研究的重点.
Ortega-Cava和Chow等研究发现了TLR2、4在肠道的不同部位, 其表达是不同的. Poltorak和Heine等研究认为TLR4是作为LPS的主要受体起主要作用.
本研究在观察正常肠组织和损伤肠组织的TLR表达时, 对给予LPS的不同时间点TLR的表达均进行了观察和比较, 并对各个时间点的病理变化进行了比较.
TLR受体是免疫识别受体, 具有识别外源性微生物和毒素的作用, 通过信号转导, 介导免疫反应, 导致组织损伤, 如何抑制TLR的信号转导是抑制炎症反应的重要环节, 为将来的治疗提供重要依据.
Toll样受体: 是能识别病原微生物的免疫受体, 是一种跨膜蛋白, 具有信号转导功能, 介导免疫反应.
本文选题新颖, 具有一定研究价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Deitch EA. The role of intestinal barrier failure and bacterial translocation in the development of systemic infection and multiple organ failure. Arch Surg. 1990;125:403-404. [PubMed] |
| 2. | Söderholm JD, Perdue MH. Stress and gastrointestinal tract. II. Stress and intestinal barrier function. Am J Physiol Gastrointest Liver Physiol. 2001;280:G7-G13. [PubMed] |
| 4. | Medzhitov R, Preston-Hurlburt P, Janeway CA Jr. A human homologue of the Drosophila Toll protein signals activation of adaptive immunity. Nature. 1997;388:394-397. [PubMed] [DOI] |
| 5. | Medzhitov R, Janeway C Jr. The Toll receptor family and microbial recognition. Trends Microbiol. 2000;8:452-456. [PubMed] [DOI] |
| 6. | Akira S, Takeda K. Toll-like receptor signalling. Nat Rev Immunol. 2004;4:499-511. [PubMed] [DOI] |
| 7. | Beutler B. Inferences, questions and possibilities in Toll-like receptor signalling. Nature. 2004;430:257-263. [PubMed] [DOI] |
| 8. | Beutler B, Poltorak A. Sepsis and evolution of the innate immune response. Crit Care Med. 2001;29:S2-S6; discussion S6-S7. [PubMed] |
| 9. | Zhang G, Ghosh S. Molecular mechanisms of NF-kappaB activation induced by bacterial lipopolysaccharide through Toll-like receptors. J Endotoxin Res. 2000;6:453-457. [PubMed] [DOI] |
| 10. | Ortega-Cava CF, Ishihara S, Rumi MA, Kawashima K, Ishimura N, Kazumori H, Udagawa J, Kadowaki Y, Kinoshita Y. Strategic compartmentalization of Toll-like receptor 4 in the mouse gut. J Immunol. 2003;170:3977-3985. [PubMed] |
| 11. | Chow JC, Young DW, Golenbock DT, Christ WJ, Gusovsky F. Toll-like receptor-4 mediates lipopolysaccharide-induced signal transduction. J Biol Chem. 1999;274:10689-10692. [PubMed] [DOI] |
| 12. | Poltorak A, He X, Smirnova I, Liu MY, Van Huffel C, Du X, Birdwell D, Alejos E, Silva M, Galanos C. Defective LPS signaling in C3H/HeJ and C57BL/10ScCr mice: mutations in Tlr4 gene. Science. 1998;282:2085-2088. [PubMed] [DOI] |
| 13. | Heine H, Kirschning CJ, Lien E, Monks BG, Rothe M, Golenbock DT. Cutting edge: cells that carry A null allele for toll-like receptor 2 are capable of responding to endotoxin. J Immunol. 1999;162:6971-6975. [PubMed] |
| 14. | Hoshino K, Takeuchi O, Kawai T, Sanjo H, Ogawa T, Takeda Y, Takeda K, Akira S. Cutting edge: Toll-like receptor 4 (TLR4)-deficient mice are hyporesponsive to lipopolysaccharide: evidence for TLR4 as the Lps gene product. J Immunol. 1999;162:3749-3752. [PubMed] |
| 15. | Yang RB, Mark MR, Gray A, Huang A, Xie MH, Zhang M, Goddard A, Wood WI, Gurney AL, Godowski PJ. Toll-like receptor-2 mediates lipopolysaccharide-induced cellular signalling. Nature. 1998;395:284-288. [PubMed] [DOI] |
| 16. | Qureshi ST, Larivière L, Leveque G, Clermont S, Moore KJ, Gros P, Malo D. Endotoxin-tolerant mice have mutations in Toll-like receptor 4 (Tlr4). J Exp Med. 1999;189:615-625. [PubMed] [DOI] |
| 17. | Hajjar AM, O'Mahony DS, Ozinsky A, Underhill DM, Aderem A, Klebanoff SJ, Wilson CB. Cutting edge: functional interactions between toll-like receptor (TLR) 2 and TLR1 or TLR6 in response to phenol-soluble modulin. J Immunol. 2001;166:15-19. [PubMed] |
| 18. | Ozinsky A, Underhill DM, Fontenot JD, Hajjar AM, Smith KD, Wilson CB, Schroeder L, Aderem A. The repertoire for pattern recognition of pathogens by the innate immune system is defined by cooperation between toll-like receptors. Proc Natl Acad Sci U S A. 2000;97:13766-13771. [PubMed] [DOI] |