修回日期: 2010-06-18
接受日期: 2010-06-28
在线出版日期: 2010-07-28
目的: 探讨胃泌素(gastrin, Gas)、生长抑素(somatostatin, SS)和P物质(substance P, SP)在海洛因依赖大鼠空肠的定位和表达.
方法: 成年SD大鼠66只, 按配对原则随机分为正常对照组, 盐水对照组和海洛因依赖组. 按体质量逐日递增海洛因药液剂量, 皮下注射. 建立海洛因依赖动物模型. 分别于10、17、24、31、38 d取空肠组织. 应用免疫组织化学SABC法及图像分析法观察空肠Gas-、SS-和SP-免疫反应(immunoreactive, IR)细胞的数量及IR强度变化.
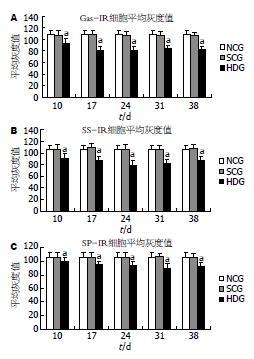
结果: 与正常对照组, 盐水对照组比较, 海洛因依赖组Gas-、SS-和SP-IR细胞的数量(细胞数/视野)明显增加(P<0.05), 其中Gas-、SS-IR细胞17 d, SP-IR细胞24 d增加最为显著(2.68±0.90 vs 1.84±0.47, 1.84±0.62; 2.56±0.65 vs 1.60±0.50, 1.60±0.50; 2.96±0.54 vs 1.76±0.44, 1.80±0.50, 均P<0.05). 图像分析显示Gas-, SS-和SP-IR细胞的平均灰度值低于正常及盐水对照组(P<0.05). 其中Gas-, SS-IR细胞24 d最低, SP-IR细胞31 d最低.
结论: 在海洛因依赖大鼠空肠中, Gas-、SS-和SP-IR细胞数量和表达量增加.
引文著录: 刘霞, 梁文妹. Gas、SS及SP在海洛因依赖大鼠空肠中的定位和表达. 世界华人消化杂志 2010; 18(21): 2192-2196
Revised: June 18, 2010
Accepted: June 28, 2010
Published online: July 28, 2010
AIM: To investigate the localization and expression of gastrin (Gas), somatostatin (SS) and substance P (SP) in the jejunum of heroin-dependent rats.
METHODS: Sixty-six adult Sprague-Dawley rats were randomly divided into three groups: normal control group (NCG), saline control group (SCG) and heroin dependence group (HDG). A rat model of heroin dependence was established by subcutaneous injection of heroin. Jejunum tissue was excised on days 10, 17, 24, 31 and 38 after heroin injection. Immunohistochemistry was performed to detect the expression and localization of Gas, SS and SP in jejunum tissue.
RESULTS: Compared with the NCG and SCG groups, the numbers of Gas-, SS- and SP-immunoreactive cells in the jejunum increased significantly in the HDG group (all P < 0.05), especially prominent on day 17 for Gas (2.68 ± 0.90 vs 1.84 ± 0.47 and 1.84 ± 0.62, P < 0.05) and SS staining (2.56 ± 0.65 vs 1.60 ± 0.50 and 1.60 ± 0.50, P < 0.05) and on day 24 for SP staining (2.96 ± 0.54 vs 1.76 ± 0.44 and 1.80 ± 0.50, both P < 0.05). The staining intensity of Gas, SS and SP in the jejunum was significantly lower in the HDG group than in the NCG and SCG groups (all P < 0.05).
CONCLUSION: The numbers of Gas-, SS- and SP-IR cells significantly increase in the jejunum of heroin-dependent rats.
- Citation: Liu X, Liang WM. Localization and expression of Gas, SS and SP in the jejunum of heroin-dependent rats. Shijie Huaren Xiaohua Zazhi 2010; 18(21): 2192-2196
- URL: https://www.wjgnet.com/1009-3079/full/v18/i21/2192.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i21.2192
胃肠道内阿片受体分布广泛[1]. 外源性阿片类物质可与内源性的阿片受体竞争结合, 导致胃肠道发生一系列病理改变. 海洛因依赖者胃肠道疾病如胃肠道溃疡、出血等患病率明显偏高, 胃肠道发生严重损害的同时伴有血浆β-内啡肽(Beta-endorphin, β-EP)、血管活性肠肽(vasoactive intestinal peptide, VIP)和胃动素水平改变[2,3]. 本实验通过建立海洛因依赖大鼠模型, 对胃泌素(gastrin, Gas)、生长抑素(somatostatin, SS)和P物质(substance P, SP)在海洛因依赖大鼠空肠的定位和表达进行研究, 探讨海洛因依赖对大鼠空肠内分泌功能的影响, 以及Gas、SS、SP在海洛因依赖期间对机体的可能调节作用.
成年SD大鼠66只, 体质量180-220 g, 由贵阳医学院动物中心提供. 海洛因: 纯度为61.48%, 由贵州省公安厅提供, 使用无菌注射用水稀释. 兔Gas、SS及SP抗血清(工作浓度为1:100)由北京中杉公司提供.
1.2.1 分组及造模: 按配对原则随机分为正常对照组6只, 盐水对照组和海洛因依赖组各30只. 制作动物模型[4]: 海洛因依赖组按体质量逐日递增皮下注射海洛因药液剂量, 首日剂量为3 mg/kg, 每天2次(上午8:00, 下午15:00), 每日递增3 mg/kg, 连续注射9 d至成瘾, 第9天剂量为27 mg/kg, 经注射纳洛酮翻转确定模型成立. 此后每日上午8:00皮下注射海洛因1次, 维持至取材, 剂量为27 mg/kg. 盐水对照组按体质量每日注射与实验组相当剂量的生理盐水. 正常对照组不予任何处理. 海洛因依赖组及盐水对照组分别于第10、17、24、31、38天取材, 每组每次处死6只, 雌雄各半. 正常对照组6只. Bouin液灌注固定后取空肠组织, Bouin液再固定, 常规石蜡包埋, 制成4 μm厚的连续切片.
1.2.2 免疫组织化学SABC法: 免疫组织化学单染法每例观察切片3张以上, 切片间隔56 μm. 主要步骤如下: 切片脱蜡入水; 10%甲醇-H2O2室温下10 min; 正常羊血清(1:50)封闭室温下20 min; 兔Gas、SS及SP抗血清4 ℃孵育过夜; 羊抗兔Ig-G 37 ℃孵育20 min; SABC复合物37 ℃孵育20 min; DAB-H2O2室温下显色, 水洗; 苏木精复染细胞核; 中性树胶封片. 对照: 以PBS代替Gas、SS和SP抗血清, 其余步骤相同.
1.2.3 图像分析: 随机选取第10、17、24、31、38天海洛因依赖组与盐水对照组切片, 每组每个时间点5张, 正常对照组切片5张, 于40倍物镜下, 每张切片选取5个视野, 分别计数每个视野内Gas-、SS-和SP-免疫反应(immunoreactive, IR)细胞的有核细胞数. 应用BioMias图像分析系统(四川大学提供)检测Gas-、SS-和SP-IR细胞的平均灰度值.
统计学处理 所得数据用SPSS11.5软件包进行统计学处理, P<0.05具有统计学意义.
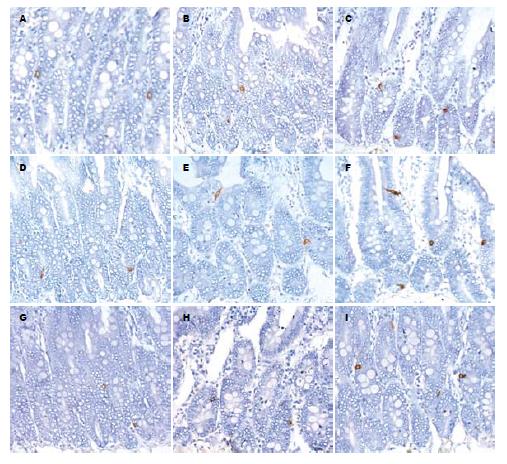
光镜下, 大鼠空肠Gas-IR细胞散在分布于小肠腺上皮或小肠绒毛上皮细胞之间, 免疫反应产物位于胞质内, 呈棕黄色细颗粒状, 细胞多呈卵圆形、锥体形、梭形或烧瓶状, 有时可见细胞的顶部伸达腺腔或肠腔(图1A-C). 与正常对照组比较, 盐水对照组各时间点Gas-IR细胞的分布、数量、形态及免疫染色强度均无明显变化(表1, 图1B). 海洛因依赖组大鼠空肠Gas-IR细胞的分布及形态与正常及盐水对照组大致相同, 但细胞数增多、细胞的免疫染色加深(表1, 图1C). 对Gas-IR细胞平均灰度值进行检测分析, 盐水对照组与正常对照组Gas-IR细胞的平均灰度值无明显差异(P>0.05), 盐水对照组各时间点之间Gas-IR细胞平均灰度值的差异也无统计学意义; 海洛因依赖组Gas-IR细胞的平均灰度值较正常和盐水对照组明显降低(P<0.05, 图2A).
光镜下, 大鼠空肠SS-IR细胞免疫反应产物呈棕黄色细颗粒状, 定位于胞质内. SS-IR细胞散在分布于小肠腺及绒毛上皮细胞之间, 细胞形态多样, 呈卵圆形、锥形, 梭形或不规则形, 有的细胞可见长突起伸达腺腔或肠腔(图1D-F). 海洛因依赖组大鼠空肠SS-IR细胞的分布及形态与正常对照组(图1D)和盐水对照组(图1E)大致相同但细胞数有所增多, 细胞的免疫染色强度增强, 且随依赖时间的延长而发生变化(图1F). 统计结果表明(表2、图2B), 海洛因依赖组SS-IR细胞数量较正常对照组及盐水对照组明显增加(P<0.05), 细胞的平均灰度值较正常对照组和盐水对照组显著降低(P<0.05). 正常对照组和盐水对照组SS-IR细胞的平均灰度值的差异无统计学意义(P>0.05), 盐水组各时间点之间SS-IR细胞的平均灰度值也无明显差别(P>0.05). 图像分析结果与同期形态学观察基本一致.
光镜下见正常对照组大鼠空肠SP-IR细胞主要分布于小肠腺及绒毛上皮细胞之间, 细胞形态多样, 免疫产物呈棕黄色或棕黑色, 定位于胞质内(图1G-I). 与正常对照组(图1G)比较, 盐水对照组SP-IR细胞(图1H)的分布、形态、数量及免疫染色强度均无明显变化, 盐水对照组内各时间点之间也无明显差异. 海洛因依赖组大鼠空肠SP-IR细胞分布未见异常, 但细胞的数量增加, 免疫染色有所加深(图1I). 图像分析表明(表3、图2C), 海洛因依赖组SP-IR细胞数量较正常对照组及盐水对照组明显增加(P<0.05), 细胞的平均灰度值较正常对照组和盐水对照组显著降低(P<0.05). 正常对照组和盐水对照组SP-IR细胞的平均灰度值的差异无统计学意义(P>0.05).
Gas由G细胞产生, 其主要功能是与壁细胞上的Gas受体结合从而引起胃酸的分泌. 此外, 还能调节胰腺分泌、摄食行为和维持能量平衡[5]. Gas是胃肠道的重要生长因子, 对胃黏膜壁细胞、肠嗜铬细胞、十二指肠和结肠上皮细胞均有营养作用[6]. 我们观察到海洛因依赖期间大鼠空肠Gas-IR细胞数量增加且细胞的免疫染色加深, 表明在此期间Gas的分泌功能增强, 与海洛因依赖大鼠十二指肠Gas-IR细胞的研究结果一致[7]. 我们推测, 在海洛因依赖期间, 大鼠空肠Gas的分泌增加, 可能与Gas能调节表皮生长因子在壁细胞的表达, 从而促进胃肠黏膜修复和细胞迁移有关[8].
SS由D细胞分泌产生, 可抑制许多细胞因子的释放[9]. 其作用表现在对胃肠道具有广泛的直接和间接调节作用[10]. Panteris等[11]报道, SS可通过调节胃肠免疫功能从而保护胃肠黏膜, 其对细胞的保护作用, 主要通过调节细胞因子和前列腺素的产生而实现. 高峻钰等[12]报道, 新合成的生长抑素衍生物能选择性地与μ阿片受体结合, 降低大鼠对吗啡的依赖性而其本身不产生躯体依赖性, 故SS有望成为生物源性的有效脱毒药物. 我们发现, 在海洛因依赖期间, 空肠的SS表达增多, 提示SS参与了对抗海洛因损伤的调节过程.
众所周知, SP在疼痛传导中扮演着重要角色[13]. 近年来发现SP在阿片依赖的过程中也发挥着重要的作用, 且其NK1受体是阿片类物质产生奖励机制所必需的[14]. 有报道SP是直接调控吗啡等阿片类药物镇痛功能和耐受性的关键分子, 动物实验证实剔除SP基因的小鼠对吗啡将不产生耐受作用[15]. 本实验结果提示外源性的阿片类物质对SP的分泌有影响.
我们还观察到, 海洛因依赖期间大鼠空肠Gas-、SS-和SP-IR细胞数量增加, 平均灰度值降低, 且变化幅度基本一致. 推测除了海洛因对胃肠道内分泌细胞的直接作用外, 还可能因为三者之间存在着相互调节的关系而导致激素水平的变化, 但确切的作用尚有待进一步研究.
胃肠道内阿片受体分布广泛. 外源性阿片类物质可与内源性的阿片受体竞争结合, 导致胃肠道发生一系列病理改变. 海洛因依赖者胃肠道疾病如胃肠道溃疡、出血等患病率明显偏高, 胃肠道发生严重损害的同时伴有血浆β-内啡肽(β-EP)、血管活性肠肽(VIP)和胃动素水平改变.
魏继福, 副研究员, 江苏省人民医院中心实验室.
Panteris等报道, SS可通过调节胃肠免疫功能从而保护胃肠黏膜, 其对细胞的保护作用, 主要通过调节细胞因子和前列腺素的产生而实现. 高峻钰等报道, 新合成的生长抑素衍生物能选择性地与μ阿片受体结合, 降低大鼠对吗啡的依赖性而其本身不产生躯体依赖性, 故SS有望成为生物源性有效脱毒药物.
本实验通过建立海洛因依赖大鼠模型, 对胃泌素(Gas)、生长抑素(SS)和P物质(SP)在海洛因依赖大鼠空肠的定位和表达进行研究, 探讨海洛因依赖对大鼠空肠内分泌功能的影响, 以及Gas、SS、SP在海洛因依赖期间对机体的可能调节作用.
本文选题较好, 有一定的科学意义.
编辑: 曹丽鸥 电编:吴鹏朕
| 1. | Holzer P. Opioid receptors in the gastrointestinal tract. Regul Pept. 2009;155:11-17. [PubMed] [DOI] |
| 2. | Panchal SJ, Müller-Schwefe P, Wurzelmann JI. Opioid-induced bowel dysfunction: prevalence, pathophysiology and burden. Int J Clin Pract. 2007;61:1181-1187. [PubMed] [DOI] |
| 5. | Baldwin GS, Patel O, Shulkes A. Evolution of gastrointestinal hormones: the cholecystokinin/gastrin family. Curr Opin Endocrinol Diabetes Obes. 2010;17:77-88. [PubMed] |
| 6. | Sinclair NF, Ai W, Raychowdhury R, Bi M, Wang TC, Koh TJ, McLaughlin JT. Gastrin regulates the heparin-binding epidermal-like growth factor promoter via a PKC/EGFR-dependent mechanism. Am J Physiol Gastrointest Liver Physiol. 2004;286:G992-G999. [PubMed] [DOI] |
| 8. | Yao YL, Xu B, Zhang WD, Song YG. Gastrin, somatostatin, and experimental disturbance of the gastrointestinal tract in rats. World J Gastroenterol. 2001;7:399-402. [PubMed] |
| 10. | Corleto VD. Somatostatin and the gastrointestinal tract. Curr Opin Endocrinol Diabetes Obes. 2010;17:63-68. [PubMed] |
| 11. | Panteris V, Karamanolis DG. The puzzle of somatostatin: action, receptors, analogues and therapy. Hepatogastroenterology. 2005;52:1771-1781. [PubMed] |
| 13. | Vachon P, Massé R, Gibbs BF. Substance P and neurotensin are up-regulated in the lumbar spinal cord of animals with neuropathic pain. Can J Vet Res. 2004;68:86-92. [PubMed] |