修回日期: 2009-11-30
接受日期: 2009-12-07
在线出版日期: 2010-01-18
目的: 总结1例胰腺双部位实性假乳头肿瘤(SPT)的临床病理特点, 探讨其可能起源.
方法: 手术行标准胰十二指肠切除术和胰体尾及脾切除术, 分析该病例SPT的临床病理特点, 并行多个抗体的免疫组织化学检查.
结果: 患者术后血糖5.5-8.9 mmol/L, 第5天开始恢复饮食, 未发生胰漏、胆漏及腹腔感染等并发症. 大体形态的囊实性比例不尽相同, 但镜下肿瘤细胞形态学一致, 均确诊为SPT, 对各个免疫表型的表达具有异质性, 其中VIM、S100、AAT、CyclinD1、PR及Nestin均呈阳性.
结论: SPT可能起源于胰腺干细胞及与其发育密切相关的胚胎神经嵴的神经前体细胞, 由干细胞发育过程中分化不成熟所致.
引文著录: 程东峰, 沈柏用, 韩宝三, 祝哲诚, 邓侠兴, 彭承宏. 胰腺双部位实性假乳头肿瘤1例. 世界华人消化杂志 2010; 18(2): 195-198
Revised: November 30, 2009
Accepted: December 7, 2009
Published online: January 18, 2010
AIM: To analyze the pathological characteristics and origin of bifocal solid pseudopapillary tumor (SPT) of the pancreas.
METHODS: The clinical data of a patient with bifocal SPT of the pancreas, who underwent pancreatoduodenectomy and distal pancreatectomy with splenectomy at our hospital, were retrospectively analyzed. The expression of multiple differentiation markers was detected by immunohistochemistry to evaluate the origin of the tumor.
RESULTS: The postoperative course was uneventful. The postoperative blood glucose levels ranged from 5.5 to 8.9 mmol/L. The patient restored food intake five days after operation. No postoperative complications occurred. Pathological examination showed different combination ratios of solid and cystic components between the tumors arising from both foci. However, the morphology of neoplastic cells was similar between them. Both of them were diagnosed as SPT of the pancreas. The SPT cells were highly positive for some differentiation markers such as vimentin (VIM), S100, alpha-1 antitrypsin (AAT), cyclin D1, PR, and nestin proteins.
CONCLUSION: Bifocal SPT of the pancreas shows heterogeneous differentiation. SPT may be originated from pancreatic embryonic stem cells and results from immature differentiation of pluripotential stem cells during pancreas genesis.
- Citation: Cheng DF, Shen BY, Han BS, Zhu ZC, Deng XX, Peng CH. Bifocal solid pseudopapillary tumor of the pancreas: a report of one case. Shijie Huaren Xiaohua Zazhi 2010; 18(2): 195-198
- URL: https://www.wjgnet.com/1009-3079/full/v18/i2/195.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i2.195
胰腺实性假乳头肿瘤(solid pseudopapillary tumor of pancreas, SPT)是一种少见的潜在低度恶性的胰腺肿瘤[1], 仅占全部胰腺外分泌肿瘤的0.2%-2.7%[2,3], 易被误诊误治[4], 随着近年来人们对该病有了更为清晰的认识和准确的诊断, 国内外文献报道较以前明显增多[5], 但尚未见同1病例胰腺双部位实性假乳头肿瘤的报道, 本文就1例罕见的胰腺双部位实性假乳头肿瘤的临床病例病理特点进行总结, 并探讨其可能起源.
因体检发现胰腺占位4 mo入院, 患者, 女, 无腹痛、腹胀、发热及皮肤巩膜黄染, 近期无明显体质量减轻. B超显示胰头钩突部内见一不均质混合性回声团块, 大小约57 mm×36 mm×55 mm, 形态呈不规则形, 边界不清, 内部回声分布不均, 可见一环状强回声, 胰腺尾部见一巨大混合性回声团块, 大小约99 mm×80 mm×76 mm, 形态呈不规则形, 边界不清, 内部回声分布不均, 其内可见片状高回声及极低回声; 肝右叶边缘见一稍高回声, 大小约11 mm×7 mm, 形态呈类圆形, 边界尚清, 内部回声不均匀, 未见血流信号. CT(001226600)示胰头钩突部、胰体尾圆形肿块, 8 cm×8 cm, 内见环形钙化, 分隔及结节, 增强后强化不明显, 肿块推压脾血管及左肾静脉; 肝右叶包膜下见小片状低密度灶, 增强后周边环形强化, 门脉期呈相对低密度. 入院诊断, 胰腺多发性混合性肿块: 胰腺实性假乳头肿瘤可能; 肝右叶结节性病灶. 2009-02-19行胰十二指肠切除+胰尾及脾脏切除术, 行"屋顶式切口", 术中见胰头4 cm×5 cm肿块, 胰尾7 cm×8 cm囊性占位, 与周围有粘连. 以ENDOGIA断胰体行胰尾肿块及脾切除术, 胰头钩突部肿瘤行标准胰十二指肠切除术; 右肝肿块局部切除. 标本送冰冻提示胰腺实性假乳头肿瘤, 右肝海绵状血管瘤.
手术行标准胰十二指肠切除术和胰体尾及脾切除术, 分析该病例SPT的临床病理特点, 将不同组织来源的抗体(如代表神经细胞及神经内分泌细胞来源的抗体NSE和SYN; 代表神经干细胞来源的抗体Nestin和VIM; 代表神经软组织来源的抗体; 代表间叶组织细胞来源的抗体VIM和AAT; 代表上皮细胞来源的抗体CK7等)对本例SPT进行免疫组织化学染色, 二抗用生物素化猪抗多兔免疫球蛋白(或生物素化兔抗单鼠免疫球蛋白)二抗, 实验过程中均通过"煮沸"进行抗原修复, 均设阴性对照组(即用PBS代替相应的一抗)和相应的阳性对照组, ABC法进行免疫组织化学实验.
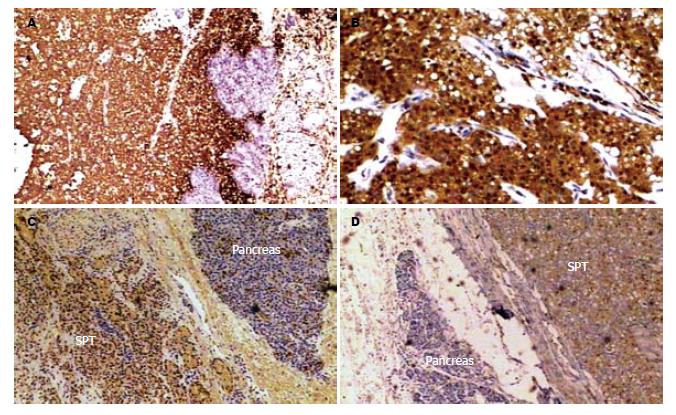
患者术后恢复顺利, 监测血糖5.5-8.9 mmol/L, 术后抗菌素使用3 d, 术后第3天体温即低于37.5 ℃, 术后第5天血白细胞及中性粒细胞均恢复正常, 术后5 d开始恢复饮食, 术后8 d拔除引流管, 术后2 wk痊愈出院, 术后未发生胰漏、胆漏和腹腔感染等并发症. 本例胰腺双部位肿瘤大体形态的囊实性比例不尽相同, 但镜下肿瘤细胞形态学还是一致的, 石蜡病理报告"胰头、胰尾"均确诊为SPT. 对各个免疫表型的表达具有异质性, 其中VIM、S100、AAT、CyclinD1、PR及Nestin均呈阳性, 余NSE、SYN、CHG、ER及CK7均阴性(图1), "肝脏肿块"为海绵状血管瘤.
SPT为一种独特的无功能性胰腺肿瘤实体, 于1959年首次报道[6], 曾有多个临床病理学名称[7], 1996年WHO将SPT重新分类为生物学行为未定或交界性恶性潜能的肿瘤[8]. SPT有明显的性别趋势, 好发于青春期女性, 本例患者年仅24岁, SPT无特异性的临床症状及体征, 如同本患者, 通常是在体检或放射线检查时偶然发现的[9], 同时在胰头和胰体尾出现双部位的肿瘤更属罕见, 未见类似报道. SPT生长缓慢, 多呈外生性、膨胀性生长[5,10], 可延伸至后腹膜形成巨大肿瘤, 易被误诊为"后腹膜恶性肿瘤". SPT常为孤立性囊实性肿物, 本例则为罕见的胰头及胰尾同时出现的双部位肿块, 两部位的大体表现不尽相同, 胰头部位的肿块大体表现为以实性区为主的囊实性混合结构, 瘤体中心可见出血、坏死, 边界较清楚; 而胰体尾的肿块表现为以囊性区为主的囊实性混合结构, 局部囊壁有钙化, 有完整的包膜. 两部位肿瘤的病理特点却是一致的, 包括无腺体结构的实质性细胞和丰富血管构成的假乳头结构和区域退行性变性、坏死, 可见到多个细胞围绕纤维血管根部形成的假菊花团结构. SPT对放、化疗罕有敏感者, 手术切除是治疗该病的有效方法, SPT手术切除率高, 外科治疗效果也明显好于胰腺癌, 很少发生肝脏转移, 即使有肝脏转移者术后仍能生存4年、11年之久, 其病程进展非常缓慢[5,11]. SPT单部位肿块的手术方式有局部肿块切除术、胰腺节段切除术和肿瘤扩大切除术[12,13]. 而本患者是胰头和胰体尾双部位的肿瘤, 手术方式为标准胰十二指肠切除、胰体尾及脾切除术, 仅留胰体中段约6 cm的胰腺组织, 依次行胰肠、胆肠和胃肠吻合, 保留部分胰腺实质组织能够保证胰腺的内外分泌功能的维持. 本患者的胰头和胰体尾双部位SPT的免疫组化表达是一样的, 对VIM、S100、AAT、CyclinD1和Nestin均为高表达阳性, 对NSE, SYN, CHG, ER和CK7均不表达. Vim(波形蛋白)是神经干细胞的标志蛋白, 神经早期发生时需要Vim[14], 也是胰岛干细胞的一个分子标志. 神经巢蛋白nestin是一种细胞骨架蛋白, 主要在未分化、具有增殖能力的细胞中表达, nestin阳性细胞具有很强的增殖能力[15], 在细胞分化结束时表达下降[16], 在胰腺发育过程中, nestin只在围绕胰腺上皮的间充质表达, 并不在上皮组织中表达且自然过程中nestin阳性细胞不发育为内分泌细胞[17,18], 上述Vim和nestin在胰腺发育过程中的表达特点, 提示本例SPT中所存在Vim和nestin的高表达可能源于间叶组织中胰腺干细胞, 具有很强的增值分化功能, 这也符合本例SPT中CyclinD1的高表达情况, 因为CyclinD1的高表达多反映肿瘤的高增值能力[19]. 本例SPT对S100神经蛋白也呈阳性高表达, S100蛋白广泛表达于神经外胚叶、中胚层、外胚层来源的正常组织细胞中[20], 因此SPT也有可能来源于神经巢或胚胎神经嵴细胞, 有作者研究也支持此观点[21]. CK7等是上皮细胞性来源的标志物, 是导管内皮的特异性标志物, 本例SPT中表达为阴性. 可见, 本例胰腺双部位肿瘤大体形态的囊实性比例不尽相同, 但镜下肿瘤细胞形态学还是一致的, 可以确诊为胰腺实性假乳头肿瘤, 对各个免疫表型的表达具有异质性, 体现了此肿瘤的多形性分化特征, 说明了该肿瘤细胞不同于胰腺的任何一种细胞, 极可能起源于胰腺多潜能胚胎干细胞及与其发育密切相关的胚胎神经嵴的神经前体细胞. 在生理情况下, 胰腺干细胞保持相对静止, 胰腺干细胞若受某种病理机制变化, 也有可能向其他异常细胞(如SPT细胞等)演变, 出现异常分化或分化不全, 进而形成SPT.
胰腺实性假乳头肿瘤(SPT)是一种少见的潜在低度恶性的胰腺肿瘤, 仅占全部胰腺外分泌肿瘤的0.2%-2.7%, 其生长缓慢, 多呈外生性、膨胀性生长, 可延伸至后腹膜形成巨大肿瘤, 易被误诊为"后腹膜恶性肿瘤", 且有明显的性别趋势, 好发于青春期女性.
王炳元, 教授, 中国医科大学附属第一医院消化内科; 宋振顺, 教授, 中国人民解放军第四军医大学西京医院肝胆外科
Martin等报道SPT对放、化疗罕有敏感者, 手术切除是治疗该病的有效方法, SPT手术切除率高, 外科治疗效果也明显好于胰腺癌, 很少发生肝脏转移, 即使有肝脏转移者术后仍能生存4年、11年之久, 其病程进展非常缓慢.
本文就1例罕见的胰腺双部位实性假乳头肿瘤的临床病例病理特点进行总结, 并探讨其可能起源, 可增加医务人员对该病的临床认识.
本文报道了胰腺双部位实性假乳头肿瘤的临床病理特点和组织起源分析, 属罕见病例, 具有一定的临床参考价值.
编辑: 李军亮 电编:何基才
| 1. | Kang CM, Kim KS, Choi JS, Kim H, Lee WJ, Kim BR. Solid pseudopapillary tumor of the pancreas suggesting malignant potential. Pancreas. 2006;32:276-280. [PubMed] [DOI] |
| 2. | Canzonieri V, Berretta M, Buonadonna A, Libra M, Vasquez E, Barbagallo E, Bearz A, Berretta S. Solid pseudopapillary tumour of the pancreas. Lancet Oncol. 2003;4:255-256. [PubMed] [DOI] |
| 3. | Santini D, Poli F, Lega S. Solid-papillary tumors of the pancreas: histopathology. JOP. 2006;7:131-136. [PubMed] |
| 4. | Cheng DF, Peng CH, Zhou GW, Tao ZY, Chen X, Lei RQ, Zhang SD, Li HW. Clinical misdiagnosis of solid pseudopapillary tumour of pancreas. Chin Med J (Engl). 2005;118:922-926. [PubMed] |
| 5. | Martin RC, Klimstra DS, Brennan MF, Conlon KC. Solid-pseudopapillary tumor of the pancreas: a surgical enigma? Ann Surg Oncol. 2002;9:35-40. [PubMed] [DOI] |
| 6. | Sperti C, Berselli M, Pasquali C, Pastorelli D, Pedrazzoli S. Aggressive behaviour of solid-pseudopapillary tumor of the pancreas in adults: a case report and review of the literature. World J Gastroenterol. 2008;14:960-965. [PubMed] [DOI] |
| 7. | Klimstra DS, Wenig BM, Heffess CS. Solid-pseudopapillary tumor of the pancreas: a typically cystic carcinoma of low malignant potential. Semin Diagn Pathol. 2000;17:66-80. [PubMed] |
| 8. | Huang HL, Shih SC, Chang WH, Wang TE, Chen MJ, Chan YJ. Solid-pseudopapillary tumor of the pancreas: clinical experience and literature review. World J Gastroenterol. 2005;11:1403-1409. [PubMed] |
| 9. | Klöppel G, Kosmahl M. Cystic lesions and neoplasms of the pancreas. The features are becoming clearer. Pancreatology. 2001;1:648-655. [PubMed] [DOI] |
| 10. | Ng KH, Tan PH, Thng CH, Ooi LL. Solid pseudopapillary tumour of the pancreas. ANZ J Surg. 2003;73:410-415. [PubMed] [DOI] |
| 11. | Gedaly R, Toledano A, Millan G, Essenfeld H, Zambrano VJ. Treatment of liver metastases from a solid pseudopapillary tumor of the pancreas. J Hepatobiliary Pancreat Surg. 2006;13:587-590. [PubMed] [DOI] |
| 12. | Peng CH, Chen DF, Zhou GW, Yang WP, Tao ZY, Lei RQ, Zhange SD, Li HW. The solid-pseudopapillary tumor of pancreas: the clinical characteristics and surgical treatment. J Surg Res. 2006;131:276-282. [PubMed] [DOI] |
| 13. | Nakagohri T, Kinoshita T, Konishi M, Takahashi S, Gotohda N. Surgical outcome of solid pseudopapillary tumor of the pancreas. J Hepatobiliary Pancreat Surg. 2008;15:318-321. [PubMed] [DOI] |
| 14. | Sakairi T, Kobayashi K, Goto K, Okada M, Kusakabe M, Tsuchiya T, Sugimoto J, Sano F, Mutai M. Greater expression of transforming growth factor alpha and proliferating cell nuclear antigen staining in mouse hepatoblastomas than hepatocellular carcinomas induced by a diethylnitrosamine-sodium phenobarbital regimen. Toxicol Pathol. 2001;29:479-482. [PubMed] [DOI] |
| 15. | Humphrey RK, Bucay N, Beattie GM, Lopez A, Messam CA, Cirulli V, Hayek A. Characterization and isolation of promoter- defined nestin-positive cells from the human fetal pancreas. Diabetes. 2003;52:2519-2525. [PubMed] [DOI] |
| 16. | Docherty K. Growth and development of the islets of Langerhans: implications for the treatment of diabetes mellitus. Curr Opin Pharmacol. 2001;1:641-650. [PubMed] [DOI] |
| 17. | Huang H, Tang X. Phenotypic determination and characterization of nestin-positive precursors derived from human fetal pancreas. Lab Invest. 2003;83:539-547. [PubMed] |
| 18. | Treutelaar MK, Skidmore JM, Dias-Leme CL, Hara M, Zhang L, Simeone D, Martin DM, Burant CF. Nestin-lineage cells contribute to the microvasculature but not endocrine cells of the islet. Diabetes. 2003;52:2503-2512. [PubMed] [DOI] |
| 19. | Sporny S, Slowinska-Klencka D, Ratynska M. Cyclin D1 expression in primary thyroid carcinomas. Neuro Endocrinol Lett. 2005;26:815-818. [PubMed] |
| 20. | Takahashi M, Kawaguchi M, Shimada K, Konishi N, Furuya H, Nakashima T. Cyclooxygenase-2 expression in Schwann cells and macrophages in the sciatic nerve after single spinal nerve injury in rats. Neurosci Lett. 2004;363:203-206. [PubMed] [DOI] |
| 21. | Chen C, Jing W, Gulati P, Vargas H, French SW. Melanocytic differentiation in a solid pseudopapillary tumor of the pancreas. J Gastroenterol. 2004;39:579-583. [PubMed] [DOI] |