修回日期: 2009-11-15
接受日期: 2009-11-16
在线出版日期: 2010-01-18
目的: 探讨CDKs对体外培养的人肝癌细胞SMMC-7721侵袭力的影响及其分子机制.
方法: 将细胞分为A、B两组(A组用终浓度为0 μmol/L Roscovitine, B组用终浓度为32 μmol/L Roscovitine, 均培养24 h), 采用流式细胞术检测经CDKs特异性抑制剂Roscovitine干预后的人肝癌细胞SMMC-7721的细胞周期, 并用Transwell小室、划痕实验、PCR技术分别检测处于不同细胞周期下的人肝癌细胞侵袭能力、水平运动能力及uPA、MMP-9 mRNA表达.
结果: 经终浓度为32 μmol/L的Roscovitine干预24 h后的人肝癌细胞SMMC-7721处于G0/G1期细胞比例迅速升高(72.19%±0.47% vs 59.22%±0.54%, P<0.05), 细胞侵袭能力下降, 穿膜细胞数明显减(71.40±5.59 vs 149.60±16.36, P<0.05); 细胞水平运动能力明显下降(P<0.05); uPA mRNA的表达下降、但MMP-9 mRNA的表达却无明显变化.
结论: Roscovitine干预使人肝癌细胞SMMC-7721侵袭能力和水平运动能力下降, 其机制可能与肝癌细胞周期时相分布发生改变和uPA mRNA的表达下降有关.
引文著录: 王开阳, 熊爱珍, 蒋星星, 李龙, 李慧珍, 傅华群. 细胞周期依赖性蛋白激酶对体外培养人肝癌细胞侵袭力的影响. 世界华人消化杂志 2010; 18(2): 119-124
Revised: November 15, 2009
Accepted: November 16, 2009
Published online: January 18, 2010
AIM: To investigate the effects of cyclin-dependent kinases on the invasion of human hepatocellular carcinoma SMMC-7721 cells in vitro and explore potential mechanisms involved.
METHODS: SMMC-7721 cells were divided into two groups: control group (untreated with roscovitine) and treatment group (treated with 32 μmol/L of roscovitine for 24 hours). The ell cycle distribution of SMMC-7721 cells was detected by flow cytometry. Cell invasion and motility were evaluated by Transwell chamber assay and wound healing assay, respectively. The mRNA expression of urokinase plasminogen activator (uPA) and matrix metalloproteinase 9 (MMP-9) was detected by reverse transcription-polymerase chain reaction (RT-PCR).
RESULTS: The percentage of SMMC-7721 cells in G0/G1 phase was significantly higher in the treatment group than in the control group (72.19% ± 0.47% vs 59.22% ± 0.54%, P < 0.05). The number of cells passing through the Transwell membrane was significantly lower in the treatment group than in the control group (71.40 ± 5.59 vs 149.60 ± 16.36, P < 0.05). Roscovitine treatment also significantly decreased cell motility (P < 0.05). RT-PCR analysis revealed that roscovitine treatment downregulated the expression of uPA mRNA expression but had no significant impact on MMP-9 mRNA expression.
CONCLUSION: Roscovitine treatment decreases the invasion and motility of SMMC-7721 cells possibly via a mechanism associated with changing cell cycle and downregulating uPA mRNA expression.
- Citation: Wang KY, Xiong AZ, Jiang XX, Li L, Li HZ, Fu HQ. Cyclin-dependent kinase inhibitor roscovitine suppresses the invasion of human hepatocellular carcinoma SMMC-7721 cells in vitro. Shijie Huaren Xiaohua Zazhi 2010; 18(2): 119-124
- URL: https://www.wjgnet.com/1009-3079/full/v18/i2/119.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i2.119
细胞周期依赖性蛋白激酶(cell cycle dependent kinases, CDKs)首先在酵母菌中发现, 他需与细胞周期素(Cyclin)相结合形成复合物才有活性. CDKs不但能作用于细胞周期G1-S-G2-M的调控点影响细胞有丝分裂, 而且还能对RNA的形成和许多因子的转录具有调控作用. 我们的前期研究已证实[1], 利用适宜浓度的CDKs抑制剂Roscovitine抑制CDKs的活性后, 增殖期肝癌细胞的生长、增殖被抑制, 肝癌细胞周期时相的分布被改变, 与凋亡相关的Bcl-2、caspase-3 mRNA的表达也发生相应的改变. Roscovitine可以通过抑制CDKs的活性调控Bcl-2和caspase-3 mRNA的表达使肝癌细胞周期时相分布发生改变. 国外Kar等[2]也报道, 用甲氧雌二醇(2-ME)抑制CDC25后, 发现CDK1和CDK2的磷酸化减弱, 肝癌细胞株(HepBB、HepG2、PLC/PRF5)的周期分布被阻滞在G2/M期, 细胞的凋亡明显增加; Ito等[3]也报道人肝癌中CDK1过表达与高甲胎蛋白(AFP)、高增殖细胞核抗原(Ki267)、低分化、不良预后等密切相关. 国内周奇等[4]发现CyclinE与组织分化、癌栓形成及侵袭转移有关, CyclinA与组织分化、肝门淋巴结/肝外转移、癌灶数目及癌栓形成及侵袭转移均有关. 处于不同周期的肿瘤细胞其分裂能力不同, 那么改变肿瘤细胞的周期时相分布是否对肿瘤细胞的侵袭能力也会有影响? 因此, 我们在前期的研究基础上利用对肝癌细胞生长抑制最有效的Roscovitine浓度(32 µmol/L)作用人肝癌细胞SMMC-7721 24 h后, 观察在不同周期下人肝癌细胞侵袭能力的变化, 并探讨其可能的作用机制, 从而进一步认识影响肝癌细胞侵袭的相关因素, 并为临床治疗肝癌提供新的思路.
人肝癌细胞SMMC-7721细胞株购自中国科学院细胞库. CDKs抑制剂Roscovitine购自美国Sigma公司; MMP-9、uPA、β-actin引物均由上海生物试剂公司合成; 引物系列号MMP-9:Sense 5'-TGG GCT ACG TGA CCT ATG ACA T-3', Antisense 5'-GCC CAG CCC ACC TCC ACT CCT C-3'; uPA: Sense 5'-AGA ATT CAC CAC CAT CGA GA-3', Antisense 5'-ATC AGC TTC ACA ACA GTC AT-3', β-actin: Sense 5'-AGA GGG AAA TCG TGC GTG AC-3', Antisense 5'-CGG ACT CAT CGT ACT CCT GCT-3'; Transwell小室购自Corning公司.
1.2.1 流式细胞仪检测SMMC-7721细胞周期时相分布: 选取对数生长期细胞, 以0.25%胰酶消化, 用含100 mL/L胎牛血清的RPMI 1640培养液将细胞分散成密度为5×104个/mL的单细胞悬液, 将细胞接种于2个培养瓶中(培养瓶底部面积为25 cm2), 每瓶4 mL; 培养24 h后换含有不同浓度的Roscovitine(终浓度为0和32 μmol/L)的培养液处理细胞, 继续培养24 h后, 分为A、B两组(终浓度为0 μmol/L的设为A组, 终浓度为32 μmol/L的设为B组), 以0.25% Trypsin消化, 收集细胞, 制成单细胞悬液, 调整待测细胞浓度至106/mL; 取1 mL细胞悬液, 4 ℃、1 000 r/min离心10 min, 弃上清; 加入1 mL冷PBS, 轻轻吹打使细胞悬浮, 4 ℃、1 000 r/min离心10 min, 弃上清; 重复悬浮3次; 将细胞重悬于100 μL PBS中加入Triton X-100 250 μL, 混匀, 室温孵育10 min; 加入RNA酶200 μL, 混匀, 室温孵育10 min; 加入碘化丙啶(PI)200 μL, 混匀, 4 ℃孵育10 min后立即上机检测.
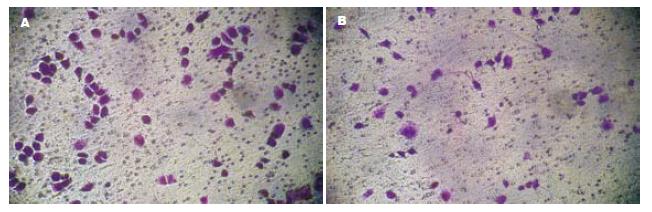
1.2.2 Transwell侵袭小室实验: 分别接种A、B两组中的5.0×105个细胞于已行基底膜包被的Transwell小室中, 小室内的培养基为无血清的RPM1 1640, 体积1 000 µL, 然后于小室外即6孔板的孔内加入2 500 µL含100 mL/L胎牛血清的RPM1 1640培养基, 以提供细胞侵袭运动的趋化因子, 培养24 h后自6孔板中取出Transwell小室, PBS轻轻冲洗3次, 用自备小棉签小心擦净小室底部微孔滤膜上层的细胞, 然后将小室置于甲醇固定液中放置10 min, 取出小室放于结晶紫中染色5 min; 沿小室底部边缘剪下滤膜, 显微镜下观察穿过Matrigel及微孔至滤膜反面的细胞, 于200倍光学显微镜下计数5个视野的细胞, 取平均值; 用SPSS10.0 for Windows统计软件分析两组细胞间的差异, P<0.05(双侧检验)认为有统计学意义.
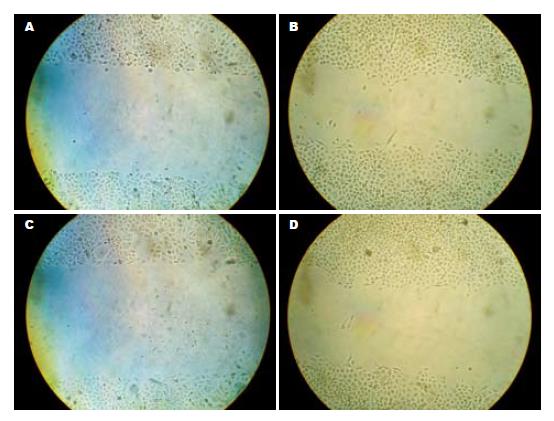
1.2.3 划痕实验: 细胞培养至孔底覆盖率达80%-90%后分为2组, 分别加入0 µmol/L的Roscovitine液(A组)和终浓度为32 µmol/L的Roscovitine液(B组)后, 置于CO2培养箱内培养, 24 h后两组均换无血清培养基, 使细胞饥饿24 h, 待细胞贴壁率达100%时, 用l mL无菌枪头在六孔板中长满的单层细胞上迅速而轻轻地划1-2道痕, PBS冲洗去掉脱落的细胞, 换无血清的培养基继续培养24 h后; 在显微镜下观察划痕修复的过程, 取0、24 h为时间点拍照记录, 并测量各时间点的相对痕距, 比较不同组细胞水平运动能力的差异.
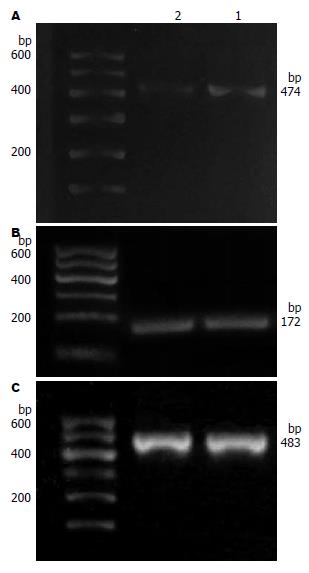
1.2.4 RT-PCR: 按试剂盒说明书进行操作进行A、B两组细胞总RNA抽提, 将提取得到的RNA于1%琼脂糖凝胶电泳检测总RNA的完整性, 分光光度计检测RNA的浓度及纯度; 按试剂盒说明书进行操作, 反应体系为25.0 μL, 在冰浴中进行逆转录; 将逆转录产物按预变性为94 ℃下5 min, 变性为94 ℃下30 s, 退火为温度为(uPA 55 ℃, MMP-9 45 ℃)下30 s, 延伸为72 ℃下60 s, 共30个循环, 最后72 ℃延伸5 min的反应条件进行PCR反应, 最后取相应的PCR产物6.0 µL及DNA Marker(DL600)6.0 µL加入1.5%琼脂糖凝胶点样孔, 置电泳仪上进行水平电泳(恒压恒流: 90 mV, 25 min), 通过Gene Genius全自动凝胶成像系统读取目的电泳条带的斑点密度扫描值, 以各组β-actin条带的扫描值来标化其相应组uPA、MMP-9 mRNA表达量.
统计学处理 所有数据采用SPSS14.0统计软件进行统计分析. 计量资料以mean±SD, 采用t检验, 计数资料采用χ2检验, P<0.05表示差异有显著性意义.
对照组A组中G0/G1期细胞占59.22%±0.54%, S期占26.34%±0.20%, G2/M期占14.44%±0.62%; B组中G0/G1期细胞占72.19%±0.47%, S期占18.95%±0.24%, G2/M期占8.86%±0.76%. 与对照组A组相比, B组G0/G1期细胞比例增多, S期、G2/M期细胞比例减少(均P<0.05, 表1).
A组每个小室穿膜细胞数为(149.60±16.36)个, B组为(71.40±5.59)个, 与对照组A组相比, B组细胞穿过Transwell膜细胞数明显减少(P<0.05, 图1).
与对照组A组相比, 24 h后显微镜下B组中的细胞水平运动距离明显降低, 缩小的痕距也明显减小(均P<0.05, 图2, 表2).
| 作用时间 | 痕距 | |
| A组 | B组 | |
| 0 h | 31.98±2.84 | 30.06±2.66 |
| 24 h | 17.96±1.72 | 26.48±0.93 |
B组与对照组A组相比, uPA mRNA的表达降低, A、B两组间的表达结果有统计学意义(P<0.05), 但MMP-9 mRNA表达却无明显的变化(P>0.05, 图3).
Roscovitine是嘌呤类CDKs抑制剂, 此化合物及其衍生物对CDKs有特异性的抑制作用而对其他蛋白激酶基本无作用, X射线晶体衍射测定结果表明, Roscovitine是通过与ATP竞争ATP结合位点起到抑制CDKs的作用[5]. CDK1可以与CyclinB和CyclinA形成具有活性功能的复合物CyclinB-CDK1, CyclinA-CDK1. CyclinB1-CDK1可以磷酸化RNA聚合酶Ⅱ和蛋白激酶影响有丝分裂. CyclinA-CDK1在DNA的精确复制中起到重要作用, 可以作用DNA复制过程中的重要元件促进细胞向G2期转化. CyclinE-CDK2可以激活pRb, 使pRb磷酸化, 解除进入S期必需基因的转录因子的抑制, 使细胞继续增殖. CyclinA-CDK2可以磷酸化蛋白水解途径中的复合物Skp2和Cdc20, 影响细胞周期[6]. CDK4与CyclinD结合成CyclinD-CDK4复合物, 他一方面可以整合外部刺激信号启动细胞周期; 另一方面可以解除结合在CyclinE-CDK2上面的P27H蛋白, 使得CyclinD-CDK2激活, 促进细胞进入S期. CyclinD-CDK4可以调节肝细胞的生长, 使得细胞有足够大的体积而通过限制性调控点继续分化[7]. 多种CDK可以通过影响RNA转录和相关蛋白作用细胞周期. 我们用32 μmol/L的Roscovitine作用于人肝癌细胞后进行细胞周期检测, 与对照组相比, G0/G1期细胞百分比增加12.97%, S期减少7.39%, G2/M期减少5.58%占8.86%, 采用t检验, P<0.05, 与报道相符. CDKs活性受到抑制后, 细胞周期时相发生相应的改变, 大量细胞被阻滞在G0/G1期, 进入S期和G2/M期的细胞数减少, 细胞的增殖分化能力下降. 肝细胞癌的转移可以分为肝内转移与远处转移, 其转移包含一系列相互关联的事件, 是一个"多步骤过程"[8], 首先要依靠多种蛋白水解酶来降解细胞外基质和基底膜; 其次, 借助黏附分子产生的外力, 借助自身的运动相关蛋白, 侵入血管或者淋巴管内, 游向远处器官和组织; 最后, 黏附分子协助肝癌细胞附壁并最终游出血管. 肝癌细胞的侵袭主要指对细胞外基质和基底膜的突破, 即为肝癌转移早期的第1步, 不但与细胞外基质和基底膜的降解密切相关, 并且细胞运动能力的大小也是影响侵袭能力的重要因素. 我们用划痕实验检测水平运动能力, 发现Roscovitine处理后组的细胞水平运动能力降低. CDK7与CyclinH组成复合物CyclinH-CDK7, 其活性并不随细胞周期的变化而变化, 在静止期细胞中也存在. 其作用可能与转录起始时RNA多聚酶的磷酸化有关. 在RNA转录延长中, 转录因子ⅡH(transcription factor ⅡH, TFⅡH)可以影响RNA聚合酶Ⅱ的磷酸化. CDK7能成为TFⅡH的亚基, 从而调节RNA聚合酶Ⅱ, 调控多种因子的转录延长[9-11]. 原发性肝细胞癌中核转录因子-κB(nuclear transcription factor-κB, NF-κB)表达比正常组织中要高, 且随肝癌的侵袭性增强而表达增高, CDK7还可影响正性转录延长因子b(positive transcription elongation factor b, p-TEFb)的活性而影响NF-κB的表达, 与肝癌的转移有着密切的关系[12]. CDK9是调节转录的细胞周期蛋白依赖性激酶, 与CyclinT结合形成p-TEFB, p-TEFB通过磷酸化RNA聚合酶Ⅱ调控转录的延伸. 我们利用Transwell小室检测两组细胞的体外侵袭能力, 发现Roscovitine处理后组的细胞穿膜数明显比未经Roscovitine处理组少. 根据细胞周期检查结果我们得出, 处于G0/G1期的人肝癌细胞的侵袭能力和水平运动能力均比处于S、G2/M期的细胞要低. 进而提示我们, 增殖能力越强的细胞其侵袭能力越强. 肿瘤侵袭还与各种酶的分泌有关, 在这些环节中, 细胞外基质和细胞基底膜的降解是肿瘤侵袭过程中的关键所在. uPA在激活基质蛋白水解酶及纤溶酶系统中起着关键作用. uPA是一种特异性的丝氨酸蛋白水解酶, 可以激活纤溶酶原形成有活性纤溶酶, 后者可催化一系列的蛋白质降解, 其中包括纤维蛋白、纤黏蛋白、层蛋白等, uPA还可直接或间接地激活金属蛋白酶类[13]. 而现知胶原纤维等细胞外基质的降解主要由肝内的基质金属蛋白酶来完成, 在其破坏中其重要作用的是MMP-2和MMP-9, 因为MMP-2和MMP-9不但可以酶解细胞间基质成分, 也是降解细胞外基质型Ⅳ胶原的主要酶. 因此, 我们同时检测Roscovitine处理后的人肝癌细胞的uPA和MMP-9 mRNA的表达, 发现32 μmol/L的Roscovitine处理后的人肝癌细胞uPA mRNA的表达降低, 而MMP-9 mRNA的表达却没有变化. 是处于不同细胞周期的人肝癌细胞影响uPA的表达还是Roscovitine作用CDKs后在转录水平上就已经影响了uPA的表达, 我们不得而知. 细胞的周期不仅影响肿瘤的发生, 在肿瘤的后续发展中也有重要作用, 抑制CDKs的活性可以改变人肝癌细胞的周期分布, 使大量细胞处于静止期, 人肝癌细胞的侵袭力和运动力也会降低, 与侵袭相关的部分因子的表达也会被下调. 在临床治疗过程中, 我们发现肝癌容易复发, 如射频消融治疗肝癌会促进肿瘤的复发及残癌的增殖[14], 射频消融治疗肝癌后, 复发后的肿瘤再治疗后更容易复发, 再复发后的肿瘤治疗后的复发可能性比原发肿瘤高3倍. von Breitenbuch等[15]通过给小鼠肝右叶内注射CT-26结肠癌细胞制成原发肝转移模型, 5 d后经门静脉注射CT-26肿瘤细胞, 应用射频消融治疗肝右叶肿瘤, 发现射频消融治疗鼠肝肿瘤7 d后残余癌细胞存活率增加, 增殖能力明显提高. 此外, 我们发现肝癌经手术治疗后残留在体内的肝癌细胞转移速度加快. 国内外较大系列的临床资料[16,17]表明肝癌术后的3年复发率为40%-50%左右, 5年复发率为60%-70%乃至更高. 肝癌术后复发的来源一般认为有2个. 一是原发肿瘤产生的肝内播散, 手术切除原发肿瘤后肝内播散病灶继续生长为临床可发现的肿瘤; 另一种是肝脏慢性病变基础上的肿瘤再发[18]. 此外, 复发是否与改变了残癌细胞的周期而加剧了其侵袭能力相关, 值得我们进一步研究.
细胞周期依赖性蛋白激酶(CDKs)最早由Hartwell LH和Nurse P分别在芽殖酵母和裂殖酵母中发现, 并因此获得2001年诺贝尔生理学和医学奖. 起初人们的研究仅局限于CDKs与肿瘤细胞周期的关系, 随着对CDKs的不断认识, 人们发现他不仅对细胞周期有调控作用, 而且对多种蛋白活性和RNA的转录也有影响.
潘兴华, 副主任医师, 中国人民解放军成都军区昆明总医院病理实验科
von Breitenbuch等通过给小鼠肝右叶内注射CT-26结肠癌细胞制成原发肝转移模型, 5 d后经门静脉注射CT-26肿瘤细胞, 应用射频消融治疗肝右叶肿瘤, 发现射频消融治疗鼠肝肿瘤7 d后残余癌细胞存活率增加, 增殖能力明显提高.
不同周期时相下的细胞生物学特征应该是不相同的, 本文通过实验提出处于G0/G1期的人肝癌细胞的侵袭能力和水平运动能力均比S、G2/M期的细胞要低, 并对CDKs的功能得到进一步认识.
本研究提示, Roscovitine可能改变肝癌细胞周期时相分布发生和下调uPA mRNA的表达. 使人肝癌细胞SMMC-7721侵袭能力和水平运动能力下降. 这有利人们对肝癌细胞侵袭相关因素的认识, 为临床治疗肝癌提供新的思路.
本研究探讨细胞周期依赖性蛋白激酶对体外培养的人肝癌细胞侵袭力的影响, 具有一定创新性、科学价值及参考意义.
编辑: 李军亮 电编:何基才
| 2. | Kar S, Wang M, Carr BI. 2-Methoxyestradiol inhibits hepatocellular carcinoma cell growth by inhibiting Cdc25 and inducing cell cycle arrest and apoptosis. Cancer Chemother Pharmacol. 2008;62:831-840. [PubMed] [DOI] |
| 3. | Ito Y, Takeda T, Sakon M, Monden M, Tsujimoto M, Matsuura N. Expression and prognostic role of cyclin-dependent kinase 1 (cdc2) in hepatocellular carcinoma. Oncology. 2000;59:68-74. [PubMed] [DOI] |
| 4. | 周 奇, 梁 力建, 彭 宝岗, 甄 宇洋, 苏 才坤. 肝细胞癌中p27、cyclin E和cyclin A的表达及相关分析. 中山大学学报 (医学科学版). 2006;27:61-63. |
| 5. | Schwartz GK, Shah MA. Targeting the cell cycle: a new approach to cancer therapy. J Clin Oncol. 2005;23:9408-9421. [PubMed] [DOI] |
| 6. | Obaya AJ, Sedivy JM. Regulation of cyclin-Cdk activity in mammalian cells. Cell Mol Life Sci. 2002;59:126-142. [PubMed] [DOI] |
| 7. | Sherwood PW, Osley MA. Histone regulatory (hir) mutations suppress delta insertion alleles in Saccharomyces cerevisiae. Genetics. 1991;128:729-738. [PubMed] |
| 8. | Psaila B, Lyden D. The metastatic niche: adapting the foreign soil. Nat Rev Cancer. 2009;9:285-293. [PubMed] [DOI] |
| 9. | Pinhero R, Liaw P, Yankulov K. A uniform procedure for the purification of CDK7/CycH/MAT1, CDK8/CycC and CDK9/CycT1. Biol Proced Online. 2004;6:163-172. [PubMed] [DOI] |
| 10. | Morris DP, Michelotti GA, Schwinn DA. Evidence that phosphorylation of the RNA polymerase II carboxyl-terminal repeats is similar in yeast and humans. J Biol Chem. 2005;280:31368-31377. [PubMed] [DOI] |
| 11. | Tamrakar S, Kapasi AJ, Spector DH. Human cytomegalovirus infection induces specific hyperphosphorylation of the carboxyl-terminal domain of the large subunit of RNA polymerase II that is associated with changes in the abundance, activity, and localization of cdk9 and cdk7. J Virol. 2005;79:15477-15493. [PubMed] [DOI] |
| 12. | Brès V, Yoh SM, Jones KA. The multi-tasking P-TEFb complex. Curr Opin Cell Biol. 2008;20:334-340. [PubMed] [DOI] |
| 13. | Mazzieri R, Masiero L, Zanetta L, Monea S, Onisto M, Garbisa S, Mignatti P. Control of type IV collagenase activity by components of the urokinase-plasmin system: a regulatory mechanism with cell-bound reactants. EMBO J. 1997;16:2319-2332. [PubMed] [DOI] |
| 15. | von Breitenbuch P, Köhl G, Guba M, Geissler E, Jauch KW, Steinbauer M. Thermoablation of colorectal liver metastases promotes proliferation of residual intrahepatic neoplastic cells. Surgery. 2005;138:882-887. [PubMed] [DOI] |
| 16. | Wakai T, Shirai Y, Yokoyama N, Nagakura S, Hatakeyama K. Hepatitis viral status affects the pattern of intrahepatic recurrence after resection for hepatocellular carcinoma. Eur J Surg Oncol. 2003;29:266-271. [PubMed] [DOI] |