修回日期: 2010-06-06
接受日期: 2010-06-07
在线出版日期: 2010-07-08
目的: 探讨COX-2抑制剂塞来昔布对人结肠癌细胞SW480放射增敏的作用机制.
方法: 体外培养结肠癌细胞SW480. COX-2抑制剂塞来昔布作用SW480细胞24 h, X线不同剂量照射, 克隆形成法计算细胞存活率, 单击多靶模型拟合细胞存活曲线, 计算Dq、D0、SF2值和放射增敏比(SER); X线6 Gy照射后, 流式细胞仪检测细胞凋亡变化, 应用Western blot方法检测磷酸化Akt、COX-2、磷酸化Bad蛋白的表达.
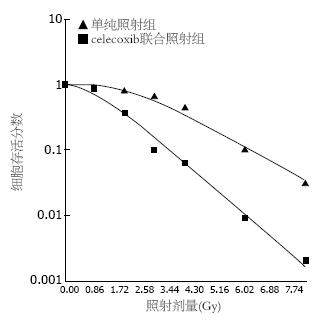
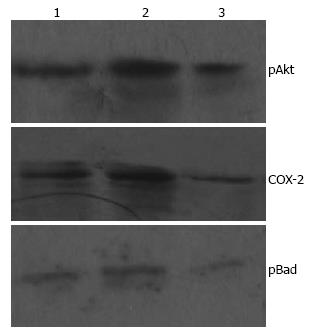
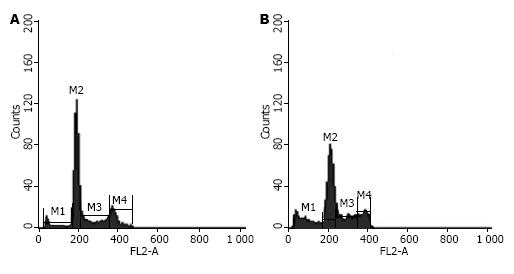
结果: celecoxib联合照射组的Dq、D0及SF2均明显低于单纯照射组(0.995 vs 2.527, 1.091 vs 1.622, 0.352 vs 0.805, 均P<0.05), celecoxib联合照射组SER为1.487; 照射能够提高pAkt、COX-2和pBad的表达, celecoxib联合照射组pAkt、COX-2和pBad表达低于单纯照射组; celecoxib联合照射组SW480的细胞凋亡率明显高于单纯照射组(15.02±2.16 vs 6.25±1.22, P<0.05).
结论: celecoxib能够抑制PI3K/Akt/COX-2途径的活化, 从而提高SW480细胞放射治疗的效果.
引文著录: 夏曙, 刘飞, 刘细友, 付强, 付秀根, 郑微. COX-2抑制剂塞来昔布提高人结肠癌细胞SW480的放射敏感性. 世界华人消化杂志 2010; 18(19): 1990-1994
Revised: June 6, 2010
Accepted: June 7, 2010
Published online: July 8, 2010
AIM: To determine whether celecoxib, a selective cyclooxygenase-2 (COX-2) inhibitor, can improve radiosensitivity of human colon carcinoma cell line SW480.
METHODS: Cultured SW480 cells were treated with celecoxib for 24 h and then irradiated with different doses of X-rays. Cell survival was evaluated by colony formation assay. To calculate Dq, D0, SF2 and SER, the cell survival curve was fitted by the one-hit multi-target model. After 6-Gy radiation, the apoptosis of SW480 cells was detected by flow cytometry, and the expression of pAkt, COX-2, and pBad in SW480 cells was detected by Western blot.
RESULTS: The Dq, D0 and SF2 values for irradiated SW480 cells pretreated with celecoxib were lower than those for unpretreated ones (0.995 vs 2.527, 1.091 vs 1.622 and 0.352 vs 0.805, respectively; all P < 0.05). The SER for irradiated SW480 cells pretreated with celecoxib was 1.487. X-ray radiation enhanced the expression of pAkt, COX-2 and pBad proteins in SW480 cells. The expression levels of pAkt, COX-2 and pBad proteins in irradiated SW480 cells pretreated with celecoxib were lower than those in unpretreated ones. The apoptosis rate was significantly higher in irradiated SW480 cells pretreated with celecoxib than in unpretreated ones (15.02 ± 2.16 vs 6.25 ± 1.22, P < 0.05).
CONCLUSION: Celecoxib improves radiosensitivity of human colon carcinoma cell line SW480 perhaps by inhibiting the activation of the PI3K/Akt/COX-2 pathway.
- Citation: Xia S, Liu F, Liu XY, Fu Q, Fu XG, Zheng W. COX-2 inhibitor celecoxib improves radiosensitivity of human colon carcinoma cell line SW480. Shijie Huaren Xiaohua Zazhi 2010; 18(19): 1990-1994
- URL: https://www.wjgnet.com/1009-3079/full/v18/i19/1990.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i19.1990
PI3K/Akt信号转导途径是一条重要的信号转导通路, 在凋亡、增殖和能量代谢等细胞生命活动中起重要作用. 电离辐射、紫外线和细胞毒性药物均可激活PI3K/Akt信号转导途径, 通过其适应性地调节, 抑制细胞凋亡、促进细胞增殖分裂和损伤修复, 维持细胞生命活动的稳定[1-4]. PI3K/Akt信号转导途径参与调节COX-2的表达. 研究发现, 多种恶性肿瘤中均存在COX-2过表达的情况. COX-2过表达可以促进新生血管生成、促进肿瘤细胞增殖、抑制细胞凋亡, 抑制COX-2在抑制结直肠癌的发生发展中具有重要的意义. 本实验通过应用COX-2抑制剂塞来昔布作用SW480细胞, 观察SW480细胞放射敏感性的变化, 初步探讨抑制PI3K/Akt/COX-2途径对人结肠癌细胞SW480放射增敏的作用机制.
人结肠癌SW480细胞株为华中科技大学同济医学院附属同济医院肿瘤中心实验室保存. RPMI 1640细胞培养基为美国Gibco公司产品; 塞来昔布为安徽合肥森瑞化工有限公司产品; 兔抗人磷酸化Akt抗体(pAkt Thr308)为美国Cell Signaling公司产品; 辣根过氧化物酶标记山羊抗兔IgG、辣根过氧化物酶标记为美国Pierce公司产品; β-actin兔抗人单克隆抗体为美国Santa Cruz公司产品; COX-2(N-20)山羊抗人多克隆抗体、pBad(S112)兔抗人多克隆抗体为美国Santa Cruz公司产品. Saturn-43型直线加速器为美国GE公司产品; PCR仪为美国Biometro T3 thermocycle产品; GDS8000型成像分析系统为英国UVP公司产品.
1.2.1 细胞培养: 人结肠癌SW480细胞接种于含100 mL/L加热灭活胎牛血清的RPMI 1640完全培养液中, 置于37 ℃、50 mL/L CO2、相对湿度90%的细胞培养箱中培养, 细胞呈贴壁生长. 取对数生长期的细胞, 进行实验.
1.2.2 药物细胞毒性测定(MTT法): 对数生长期SW480细胞以接种于96孔板; 加入celecoxib, 浓度分别为80, 100, 120, 140, 160 μmol/L, 药物作用24 h; 去培养液, 加MTT(5 g/L)20 μL/孔避光培养4 h; 去MTT加入DMSO 150 μL/孔作用15 min, 充分振荡10 min; 酶标仪492 nm波长测定各孔吸光度值. 按公式计算细胞抑制率(抑制率 = 1-药物实验组吸光度值/未加药物对照组吸光度值×100%). 药物效应中效方程式法计算药物半数抑制浓度(IC50). 药物效应中效方程式fa/fu = (D/Dm)m, 进行中效作图y = logfa/fu, x = logD, y = ax+b(fa为效应, fa = 抑制率, fu为1-fa, D为药物浓度, Dm为中效剂量, 即0.5效应时的药物浓度, m为斜率).
1.2.3 细胞照射: 将对数生长期细胞置于0.5 cm的补偿物上, 将直线加速器机架角度为180度, 以保证相同厚度的剂量建成区. 应用6 MV X线按所需剂量输出剂量照射.
1.2.4 细胞克隆形成法测定药物对SW480细胞的放射增敏作用: 取celecoxib的20%细胞抑制浓度(IC20)为药物增敏浓度. 实验分组为: 对照组、单纯照射组、celecoxib联合照射组. 对数生长期细胞接种60 mm细胞培养皿, celecoxib联合照射组加入药物作用24 h, X线0、2、3、4、6、8 Gy照射细胞, 3 h后更换不含药物培养基继续培养2 wk, 终止培养, 甲醇固定20 min, Giemsa染色15 min. 自然干燥后计数细胞克隆(50个细胞/克隆). 计算集落形成率及细胞存活分数, 集落形成率(PE) = 空白对照组集落数/空白对照组接种细胞数×100%; 细胞存活分数(SF) = 某一剂量照射实验组的集落数/该组细胞接种数×集落形成率(PE). 放疗加药组得到的细胞存活分数均用单纯给药组细胞存活分数校正, 以消除药物作用对SF的影响.
1.2.5 Western blot方法检测磷酸化Akt、COX-2、磷酸化Bad蛋白的表达: 按上述分组给药作用24 h, X线6 Gy照射细胞1 h后, 细胞裂解液(50 mmol/L Tris-Cl, 150 mmol/L NaCl, 0.02%叠氮钠, 0.1% SDS, 100 mg/L PMSF, 1 mg/L aprotinin, 1% NP-40, 0.5%去氧胆酸钠)提取细胞总蛋白, 加热变性后-20 ℃保存. 取50 μg蛋白进行SDS-PAGE凝胶电泳, 将凝胶中的蛋白质电转移到硝酸纤维素膜上, 封闭液(TBS+5%脱脂奶粉+0.5% tween-20)封闭1 h, 加入相应浓度的一抗(pAkt 1∶200, COX-2 1∶200, pBad 1∶200) 4 ℃孵育过夜, 洗膜后, 加入1∶5 000的辣根过氧化物酶标记的相应二抗孵育2 h, 采用化学发光法(ECL)曝光胶片, 冲洗显色检测相应蛋白条带. 英国UVP公司GPS8000型凝胶成像分析系统扫描分析蛋白条带.
1.2.6 细胞凋亡检测: 按上述分组给药作用24 h, X线6 Gy照射细胞, 3 h后, 消化收集细胞. 1 000 r/min离心5 min收集细胞制成细胞悬液, 0.01 mol/L PBS液冲洗2次, 用-20 ℃ 80%乙醇固定细胞, 细胞悬液1 000 r/min离心5 min, 去掉乙醇固定液, PBS液洗涤2次, 调整细胞浓度为5×108/L, 加入PI染液1 mL(50 mg/L PI, 100 mg/L RNase, 0.1% TRIton-100), 4 ℃孵育60 min, 200目钢筛过滤, 流式细胞术检测细胞凋亡.
统计学处理 每组实验均重复3次. 实验数据以均数表示. 存活曲线用单击多靶模型拟合. 放射增敏比(SER)定义为单纯放射组的D0除以增敏组D0. 应用SPSS11.0软件进行统计分析, 均值用mean±SD表示, 组间进行t检验, 以P<0.05为具有统计学差异.
celecoxib对SW480细胞的抑制作用存在剂量依赖性. 根据药物效应中效方程式法计算药物IC50, celecoxib的IC50为135.47 μmol/L±26.32 μmol/L. 通过进行中效作图, celecoxib的IC20约为45 μmol/L. 取药物的IC20为放射增敏浓度.
通过单击多靶模型拟合细胞存活曲线发现, celecoxib联合照射组的Dq、D0及SF2均明显低于单纯照射组(表1, 图1). celecoxib联合照射组SER为1.487. 抑制COX-2明显提高SW480细胞的放射敏感性.
| Dq | D0 | SF2 | |
| 单纯照射组 | 2.527 | 1.622 | 0.805 |
| celecoxib联合照射组 | 0.995 | 1.091 | 0.352 |
以β-actin为内参照研究, 进行检测蛋白质的比较研究. pAkt蛋白: 照射能够提高pAkt蛋白的表达, celecoxib联合照射组pAkt蛋白表达低于单纯照射组; COX-2蛋白: 照射能够提高COX-2蛋白的表达, celecoxib联合照射组COX-2蛋白表达低于单纯照射组; pBad蛋白: 照射能够提高pBad蛋白的表达, celecoxib联合照射组pBad蛋白的表达低于单纯照射组; 灰度分析蛋白各组间的表达水平存在统计学差异(P<0.05, 表2, 图2).
| pAkt | COX-2 | pBad | |
| 对照组 | 0.4824±0.0071 | 0.3625±0.0064 | 0.2569±0.0069 |
| 单纯照射组 | 0.8199±0.0163 | 0.8165±0.0201 | 0.3176±0.0041 |
| celecoxib联合照射组 | 0.3526±0.0127 | 0.3248±0.0098 | 0.1342±0.0061 |
应用celecoxib抑制PI3K/Akt/COX-2通路后, 能够明显提高辐射对联合照射组SW480细胞的杀伤作用, 通过流式细胞技术检测发现细胞凋亡率明显高于单独照射组, SW480细胞celecoxib联合照射组和单纯照射组细胞凋亡率分别为15.02±2.16和6.25±1.22, 凋亡率差异具有统计学意义(P<0.05, 图3).
细胞在一系列内外因素的作用下, 通过启动PI3K/Akt信号转导通路, 诱导细胞的增殖、分化, 避免细胞发生凋亡. 生长因子(EGF、IGF等)、原癌基因激活、抑癌基因的失活、化放疗及DNA损伤均能活化PI3K/Akt信号转导通路[5,6]. COX-2基因定位于1号染色体1q25.2-25.3, 由10个外显子和9个内含子构成. COX-2与其同工酶COX-1在氨基酸序列上有61%相同, 但表达形式和功能不同. COX-1为结构型表达, 其酶促产物参与维持正常生理功能, 如胃肠道黏膜的保护; COX-2为诱导型表达, 正常情况下只存在于部分肾、脑组织及妊娠后期胎盘中, 当受到炎性介质、促癌因素刺激时, 表达增加[7,8]. COX-2及其产物PGs可进入核内, 调节靶基因的转录. 多种恶性肿瘤中均存在COX-2过表达的情况. COX-2过表达可以促进新生血管生成、促进肿瘤细胞增殖、抑制细胞凋亡. 塞来昔布是一种COX-2的抑制剂, 研究表明抑制肿瘤细胞内的COX-2能够提高放射治疗的效果, 其可能机制如下: (1)降低细胞内前列腺素E2水平, 减少其对细胞的放射保护作用[9,10]; (2)塞来昔布能够抑制细胞增殖, 促进凋亡[11-14]; (3)抑制细胞DNA损伤后的再修复[15,16]. 但是, PI3K/Akt信号转导途径与COX-2肿瘤细胞放射治疗中的作用及其调节机制尚不甚清晰, 值得深入研究.
我们设计通过抑制COX-2来研究PI3K/Akt/COX-2在SW480细胞放射治疗中的作用. 我们发现抑制COX-2通路能够明显提高SW480细胞的放射敏感性. 通过细胞集落形成试验, 单靶多击模型拟合细胞存活曲线发现, celecoxib联合照射组SER是单纯照射组的1.487倍; celecoxib联合照射组的D0值明显低于单纯照射组. 这说明, 抑制COX-2能够明显提高SW480细胞的放射敏感性. 同时, celecoxib联合照射组的Dq值明显低于单纯照射组, 表明抑制COX-2能够抑制SW480细胞的亚致死性损伤的再修复过程, 这可能是提高SW480细胞放射敏感性的重要原因.
我们在celecoxib联合照射组的研究中发现, celecoxib联合照射组pAkt蛋白的表达明显低于单纯照射组. 这说明celecoxib能够抑制照射引起的Akt蛋白磷酸化, 提示我们COX-2可能是Akt发生磷酸化的重要原因. 有学者研究认为: COX-2是一个早反应基因, 能够被多种生长因子和细胞因子活化, 促进细胞增殖生长, celecoxib抑制COX-2的产生, 抑制Akt发生磷酸化, 从而导致细胞凋亡[17]. Lin等[18]在对高表达COX-2的人肺腺癌细胞CL-10研究中发现, COX-2高表达能够使细胞对长春花碱和紫外线导致的凋亡产生抵抗, 其原因是通过COX-2诱导Akt磷酸化实现的, 抑制COX-2则可以明显增加长春花碱和紫外线导致的细胞凋亡. 也有研究认为, COX-2的产物前列腺素E2是导致PI3K/Akt信号转导通路活化的重要原因, celecoxib通过抑制COX-2而使前列腺素E2减少, 导致Akt磷酸化减少[19]. 我们的结果支持celecoxib抑制Akt磷酸化.
PI3K依赖性的Akt激活可以使Bad的Ser136/Ser112残基磷酸化, 磷酸化的Bad与Bcl-2或Bcl-xL解聚, Bad再与抗凋亡结合蛋白14-3-3相结合, 而游离的Bcl-2发挥抗凋亡作用[20]. 我们发现, celecoxib联合照射组的细胞凋亡率明显高于单纯对照组, celecoxib联合照射组磷酸化pBad的表达水平低于单纯对照组, 提示celecoxib能够通过提高抑制Bad磷酸化促进细胞凋亡.
我们的研究提示, 放射诱导PI3K/Akt/ COX-2途径的活化是SW480细胞放射抗拒的重要原因, celecoxib能够抑制PI3K/Akt/COX-2途径的活化, 抑制Bad蛋白的磷酸化, 从而提高SW480细胞放射治疗的效果.
PI3K/Akt途径是一条维持细胞生命活动重要的信号转导通路; 多种恶性肿瘤中均存在COX-2过表达的情况. 抑制PI3K/Akt/COX-2的活化, 可能具有放射增敏作用.
曹秀峰, 教授, 南京医科大学附属南京第一医院肿瘤中心
提高恶性肿瘤的放射生物学效应是肿瘤放射增敏的研究热点, 目前很多放射增敏药物提高肿瘤细胞内在的放射敏感性主要是通过增加细胞DNA损伤及抑制DNA损伤后再修复实现的.
本研究提示, 放射诱导PI3K/Akt/ COX-2途径的活化是SW480细胞放射抗拒的重要原因, celecoxib能够抑制PI3K/Akt/ COX-2途径的活化, 抑制Bad蛋白的磷酸化, 从而提高SW480细胞放射治疗的效果.
COX-2过表达可以促进新生血管生成, 促进肿瘤细胞增殖, 抑制细胞凋亡. 本实验通过应用COX-2抑制剂塞来昔布作用SW480细胞, 提高SW480细胞放射敏感性. 进一步可应用临床提高放射治疗的效果.
本研究科学结论明确, 实验证据充足, 统计学分析结果可信, 文章的科学性、创新性和可读性较好地反映了我国胃肠病学基础研究的先进水平.
编辑 曹丽鸥 电编 何基才
| 1. | Jia S, Liu Z, Zhang S, Liu P, Zhang L, Lee SH, Zhang J, Signoretti S, Loda M, Roberts TM. Essential roles of PI(3)K-p110beta in cell growth, metabolism and tumorigenesis. Nature. 2008;454:776-779. [PubMed] |
| 2. | Kim S, Wong P, Coulombe PA. A keratin cytoskeletal protein regulates protein synthesis and epithelial cell growth. Nature. 2006;441:362-365. [PubMed] [DOI] |
| 3. | Kandel ES, Skeen J, Majewski N, Di Cristofano A, Pandolfi PP, Feliciano CS, Gartel A, Hay N. Activation of Akt/protein kinase B overcomes a G(2)/m cell cycle checkpoint induced by DNA damage. Mol Cell Biol. 2002;22:7831-7841. [PubMed] [DOI] |
| 4. | Opel D, Westhoff MA, Bender A, Braun V, Debatin KM, Fulda S. Phosphatidylinositol 3-kinase inhibition broadly sensitizes glioblastoma cells to death receptor- and drug-induced apoptosis. Cancer Res. 2008;68:6271-6280. [PubMed] [DOI] |
| 5. | Yuan TL, Cantley LC. PI3K pathway alterations in cancer: variations on a theme. Oncogene. 2008;27:5497-5510. [PubMed] [DOI] |
| 6. | Toulany M, Kehlbach R, Rodemann HP, Mozdarani H. Radiocontrast media affect radiation-induced DNA damage repair in vitro and in vivo by affecting Akt signalling. Radiother Oncol. 2010;94:110-116. [PubMed] [DOI] |
| 7. | Ristimäki A, Honkanen N, Jänkälä H, Sipponen P, Härkönen M. Expression of cyclooxygenase-2 in human gastric carcinoma. Cancer Res. 1997;57:1276-1280. [PubMed] |
| 8. | Kulkarni S, Rader JS, Zhang F, Liapis H, Koki AT, Masferrer JL, Subbaramaiah K, Dannenberg AJ. Cyclooxygenase-2 is overexpressed in human cervical cancer. Clin Cancer Res. 2001;7:429-434. [PubMed] |
| 9. | Tessner TG, Muhale F, Schloemann S, Cohn SM, Morrison AR, Stenson WF. Ionizing radiation up-regulates cyclooxygenase-2 in I407 cells through p38 mitogen-activated protein kinase. Carcinogenesis. 2004;25:37-45. [PubMed] [DOI] |
| 10. | Raju U, Nakata E, Yang P, Newman RA, Ang KK, Milas L. In vitro enhancement of tumor cell radiosensitivity by a selective inhibitor of cyclooxygenase-2 enzyme: mechanistic considerations. Int J Radiat Oncol Biol Phys. 2002;54:886-894. [PubMed] [DOI] |
| 11. | Swamy MV, Herzog CR, Rao CV. Inhibition of COX-2 in colon cancer cell lines by celecoxib increases the nuclear localization of active p53. Cancer Res. 2003;63:5239-5242. [PubMed] |
| 12. | Huang S, Sinicrope FA. Celecoxib-induced apoptosis is enhanced by ABT-737 and by inhibition of autophagy in human colorectal cancer cells. Autophagy. 2010;6:256-269. [PubMed] [DOI] |
| 13. | Wen B, Deutsch E, Eschwege P, De Crevoisier R, Nasr E, Eschwege F, Bourhis J. Cyclooxygenase-2 inhibitor NS398 enhances antitumor effect of irradiation on hormone refractory human prostate carcinoma cells. J Urol. 2003;170:2036-2039. [PubMed] [DOI] |
| 14. | Chuang HC, Kardosh A, Gaffney KJ, Petasis NA, Schönthal AH. COX-2 inhibition is neither necessary nor sufficient for celecoxib to suppress tumor cell proliferation and focus formation in vitro. Mol Cancer. 2008;7:38. [PubMed] [DOI] |
| 15. | Kang KB, Zhu C, Yong SK, Gao Q, Wong MC. Enhanced sensitivity of celecoxib in human glioblastoma cells: Induction of DNA damage leading to p53-dependent G1 cell cycle arrest and autophagy. Mol Cancer. 2009;8:66. [PubMed] [DOI] |
| 16. | Lim JW, Kim H, Kim KH. Expression of Ku70 and Ku80 mediated by NF-kappa B and cyclooxygenase-2 is related to proliferation of human gastric cancer cells. J Biol Chem. 2002;277:46093-46100. [PubMed] [DOI] |
| 17. | Barnes NL, Warnberg F, Farnie G, White D, Jiang W, Anderson E, Bundred NJ. Cyclooxygenase-2 inhibition: effects on tumour growth, cell cycling and lymphangiogenesis in a xenograft model of breast cancer. Br J Cancer. 2007;96:575-582. [PubMed] [DOI] |
| 18. | Lin MT, Lee RC, Yang PC, Ho FM, Kuo ML. Cyclooxygenase-2 inducing Mcl-1-dependent survival mechanism in human lung adenocarcinoma CL1.0 cells. Involvement of phosphatidylinositol 3-kinase/Akt pathway. J Biol Chem. 2001;276:48997-49002. [PubMed] [DOI] |
| 19. | Yasumaru M, Tsuji S, Tsujii M, Irie T, Komori M, Kimura A, Nishida T, Kakiuchi Y, Kawai N, Murata H. Inhibition of angiotensin II activity enhanced the antitumor effect of cyclooxygenase-2 inhibitors via insulin-like growth factor I receptor pathway. Cancer Res. 2003;63:6726-6734. [PubMed] |
| 20. | Henshall DC, Araki T, Schindler CK, Lan JQ, Tiekoter KL, Taki W, Simon RP. Activation of Bcl-2-associated death protein and counter-response of Akt within cell populations during seizure-induced neuronal death. J Neurosci. 2002;22:8458-8465. [PubMed] |