修回日期: 2010-05-17
接受日期: 2010-06-02
在线出版日期: 2010-07-08
目的: 探讨牛磺熊去氧胆酸(TUDCA)对四氯化碳(CCl4)诱发大鼠肝纤维化的抑制作用.
方法: 健康6周龄♂SD大鼠75只, 随机分为空白对照组、模型对照组、TUDCA低剂量组、TUDCA高剂量组、己酮可可碱(PTX)阳性对照组, 每组15只. 用40%的CCl4油溶液, 大鼠背部皮下注射3 mL/kg(首次5 mL/kg)造大鼠肝纤维化模型. 各组给予相应浓度干预药物溶液灌胃8 wk, 检测血清纤维化指标HA、LN、Ⅳ-C; 胶原纤维染色(Masson三色染色)观察各组胶原纤维面积比变化; 免疫组织化学SP法观察TGF-β1及α-SMA在大鼠肝组织中的表达及分布变化.
结果: 8 wk后, TUDCA及PTX干预组与模型组相比, 血清HA、LN、Ⅳ-C有明显降低(146.33±35.13, 162.2±24.80, 137.14±22.24 vs 252.83±51.94; 77.20±11.84, 66.80±16.78, 82.00±10.74 vs 108.00±30.00; 14.14±2.59, 12.60±3.17, 10.09±2.22 vs 25.08±5.93, 均P<0.05); 肝组织纤维间隔变细或消失, 形成弥漫性肝硬化结节减少, 胶原面积比降低(P<0.05); 免疫组织化学结果显示, TUDCA及PTX干预组与模型组相比, TGF-β1及α-SMA阳性表达减少, 图像软件半定量分析结果显示差异有显著性(P<0.05). 而TUDCA低剂量组与高剂量组及PTX组三者之间结果差异无显著性.
结论: TUDCA对CCl4诱发的大鼠肝纤维化有拮抗作用, 主要是通过减少TGF-β1合成, 抑制HSC细胞活化, 降低细胞外基质合成, 延缓肝纤维化进程.
引文著录: 王丹, 杨玲, 黄金明, 王保永, 李靓, 钱伟, 叶进, 侯晓华. 牛磺熊去氧胆酸抑制四氯化碳诱导的大鼠肝纤维化. 世界华人消化杂志 2010; 18(19): 1979-1984
Revised: May 17, 2010
Accepted: June 2, 2010
Published online: July 8, 2010
AIM: To determine the inhibitory effects of tauroursodeoxycholic acid (TUDCA) on carbon tetrachloride-induced liver fibrosis in rats.
METHODS: A total of 75 healthy Sprague-Dawley rats were randomly divided into five groups: normal control group, model group, low-dose TUDCA group, high-dose TUDCA group and pentoxifylline (PTX) group. Hepatic fibrosis was induced in rats by hypodermic injection of carbon tetrachloride (40%). The low- and high-dose TUDCA groups were orally administered TUDCA at doses of 50 and 100 mg/(kg•d), respectively. The PTX group was orally administered PTX at a dose of 16 mg/(kg•d). The treatment lasted 8 wk for all the groups. Hematoxylin and eosin staining and Masson's trichrome staining of liver tissue was performed for histopathological evaluation of liver fibrosis. Serum parameters of liver fibrosis were detected by enzyme-linked immunosorbent assay. The expression of transforming growth factor-β1 (TGF-β1) and α-smooth muscle actin (α-SMA) in liver tissue was detected by immunohistochemistry.
RESULTS: Compared with the model group, the levels of serum hyaluronic acid (HA), laminin (LN) and type IV collagen (IV-C) significantly decreased in the low- and high-dose TUDCA groups and the PTX group (HA: 146.33 ± 35.13, 162.2 ± 24.80 and 137.14 ± 22.24 vs 252.83 ± 51.94; LN: 77.20 ± 11.84, 66.80 ± 16.78 and 82.00 ± 10.74 vs 108.00 ± 30.00; IV-C: 14.14 ± 2.59, 12.60 ± 3.17 and 10.09 ± 2.22 vs 25.08 ± 5.93, all P < 0.05). Compared with the model group and normal control group, fibrous septa became thinner and even disappeared, and the number of diffuse cirrhotic nodules and the area of collagen fiber decreased in the TUDCA and PTX intervention groups (all P < 0.05). The expression intensity of TGF-β1 and α-SMA proteins was significantly lower in the TUDCA and PTX intervention groups than in the model group (all P < 0.05), but showed no significant difference between the TUDCA and PTX treatment groups.
CONCLUSION: TUDCA can prevent carbon tetrachloride-induced liver fibrosis in rats by reducing TGF-β1 synthesis, inhibiting hepatic stellate cell activation and decreasing extracellular matrix synthesis.
- Citation: Wang D, Yang L, Huang JM, Wang BY, Li L, Qian W, Ye J, Hou XH. Tauroursodeoxycholic acid inhibits carbon tetrachloride-induced liver fibrosis in rats. Shijie Huaren Xiaohua Zazhi 2010; 18(19): 1979-1984
- URL: https://www.wjgnet.com/1009-3079/full/v18/i19/1979.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i19.1979
肝纤维化是各种慢性肝病发展为肝硬化的共同病理基础, 肝脏中细胞外基质(extracellular matrix, ECM)合成与降解失衡是肝纤维化发生的主要机制. 各种病因所致反复或持续的慢性肝实质炎症、坏死可导致肝脏持续不断的纤维增生而形成肝纤维化. 牛磺熊去氧胆酸(tauroursodeoxycholic acid, TUDCA)是一种结合型天然胆汁酸, 广泛存在于人和动物的胆汁中. 具有保护肝细胞, 拮抗疏水性胆汁酸的细胞毒作用[1-4], 促进胆汁酸转运和分泌[5-8], 以及抗细胞凋亡作用[9,10]. 已有研究显示, 给予等待肝移植的肝硬化患者口服TUDCA, 可明显改善其肝功能及胆汁淤积, 减少患者住院天数[11]. TUDCA对原发性胆汁性肝硬化(primary biliary cirrhosis, PBC)患者也有效, 可以明显改善PBC患者肝功能, 拮抗毒性胆汁酸对肝脏的损伤[12]. 本文通过动物模型来探讨TUDCA抗纤维化作用及其机制.
实验动物与分组: 健康6周龄♂SD大鼠75只, 体质量180-210 g , 购于华中科技大学同济医学院实验动物中心, 每组15只. 随机分为5组: 空白对照组[蒸馏水10 mL/(kg•d)]、模型组[蒸馏水10 mL/(kg•d)]、TUDCA低剂量组[50 mg/(kg•d)]、TUDCA高剂量组[100 mg/(kg•d)]、己酮可可碱(PTX)阳性对照组[16 mg/(kg•d)]. 主要试剂: TUDCA(滔罗特胶囊)由铨福发展有限公司提供; CCl4(分析纯级)由郑州化学试剂二厂提供; TGF-β1兔抗鼠即用型抗体及SP试剂盒购于北京中山生物制品有限公司; α-SMA小鼠抗大鼠单克隆抗体购于武汉博士德生物工程有限公司; Masson三色染色试剂盒购于迈新试剂公司; 血清肝纤维化指标检测试剂盒购于上海昕辉科技发展有限公司.
1.2.1 造模及给药方法: 用花生油与CCl4按3∶2的比例配制成40%的CCl4油溶液, 按每次3 mL/kg(首次5 mL/kg)大鼠背部皮下注射, 正常组注射同等剂量未添加CCl4的花生油, 每周一和周四各注射1次, 连续8 wk, 共16次. 大鼠在第一次皮下注射CCl4后的第二天即开始灌胃给药, 各给药组给予相应浓度的药物灌胃[10 mL/(kg•d)], 正常组和模型组给予等量蒸馏水, 共56 d. 大鼠自由饮水、摄食.
1.2.2 取材: 末次给药灌胃后禁食一晚, 用1%戊巴比妥钠麻醉动物, 打开腹腔于腹主动脉取血制备血清, -20 ℃冰箱内保存; 肝脏标本取右叶相同的部分, 以4%多聚甲醛固定, 3 d内石蜡包埋备组织病理学检测.
1.2.3 血清纤维化指标检测: 用ELISA法检测血清透明质酸(hyaluronic acid, HA)、层粘连蛋白(laminin, LN)、四型胶原(type Ⅳ collagen, Ⅳ-C)浓度.
1.2.4 肝组织TGF-β1及α-SMA表达的检测: 采用免疫组织化学SP染色法. 石蜡切片置于用1∶10的多聚赖氨酸处理的玻片上, 温控箱中烤干. TGF-β1及α-SMA单抗工作液浓度分别为1∶300, 1∶100. 详细操作按照说明书进行. PBS代替一抗做阴性对照. 通过Olympus显微摄像系统于放大400倍下, 每张切片随机选取5个视野照相, 以胞质内棕色颗粒为TGF-β1及α-SMA阳性表达, 采用Image-proplus v6.0软件进行定量分析, 测定其平均吸光度值(A值).
1.2.5 病理形态学观察 采用肝组织HE染色及胶原纤维(Masson)染色法, 每张切片于放大200倍镜下随机取5个视野, 用Image-proplus v6.0软件进行胶原定量分析: 胶原纤维面积百分比 = 胶原纤维面积/肝组织面积×100%.
统计学处理 采用SPSS11.0软件进行分析. 数据以mean±SD表示, 多组资料间比较采用ANOVA分析.
8 wk后, TUDCA及PTX干预组与模型组相比, 血清HA、LN、Ⅳ-C有明显降低(146.33±35.13, 162.2±24.80, 137.14±22.24 vs 252.83±51.94; 77.20±11.84, 66.80±16.78, 82.00±10.74 vs 108.00±30.00; 14.14±2.59, 12.60±3.17, 10.09±2.22 vs 25.08±5.93, 均P<0.05, 表1).
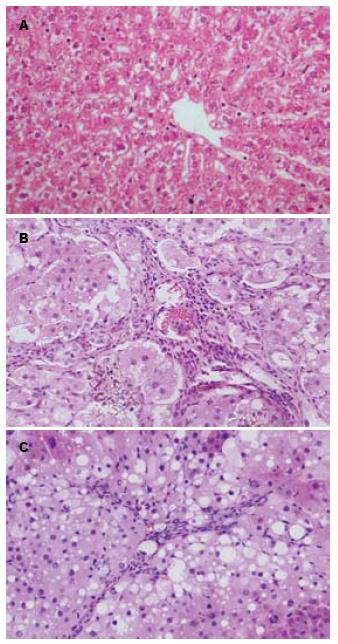
HE染色显示正常组见肝细胞以中央静脉为中心向周围呈放射状排列, 结构完整(图1A). 模型组显示肝细胞索排列紊乱, 肝细胞呈弥漫性脂肪变性, 空泡形成, 汇管区扩大, 汇管区和肝小叶内可见淋巴细胞浸润, 假小叶形成(图1B). TUDCA治疗组见肝细胞坏死及空泡变性减少, 淋巴细胞浸润减少(图1C).
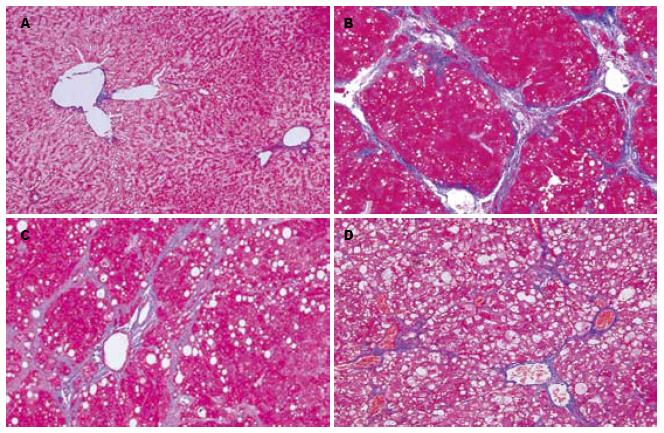
Masson染色可见正常组胶原纤维在血管周围少量表达(图2A), 与模型组和药物干预组都有明显差异(P<0.05), 其中模型组胶原纤维增生明显, 部分区域形成假小叶(图2B), TUDCA干预组及PTX组胶原纤维沉积减少, 形成的纤维间隔和假小叶明显减少(图2C, 2D), 与模型组间差异有统计学意义(P<0.05). PTX阳性对照组与治疗组之间无显著差异. 各组胶原面积百分比结果见表2.
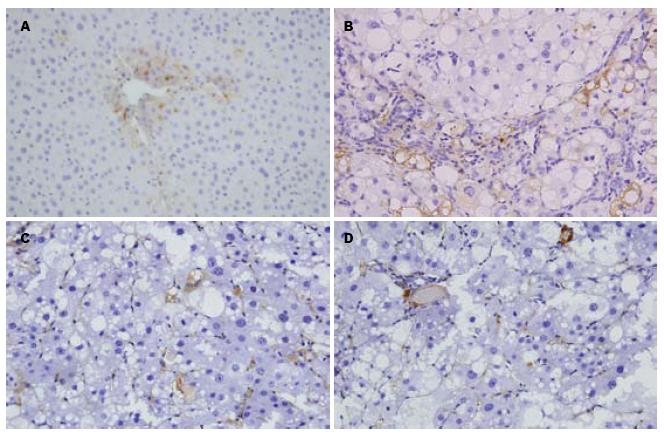
TGF-β1在正常组肝细胞内几乎无表达, 肝窦间隙, 汇管区基质及间质细胞胞质内有少量表达(图3A). 模型组肝内表达明显增强, 主要见于小叶周围扩大的纤维组织内的成纤维细胞、窦周细胞、炎性细胞以及增生的胆小管周围梭状细胞内(图3B). TGF-β1表达的阳性强度明高于正常组(P<0.05); TUDCA和PTX干预组TGF-β1表达较模型组明显减轻, 主要表达集中在汇管区、间质细胞和炎性细胞胞质内(图3C, 3D). 各组TGF-β1表达的MOD结果见表2.
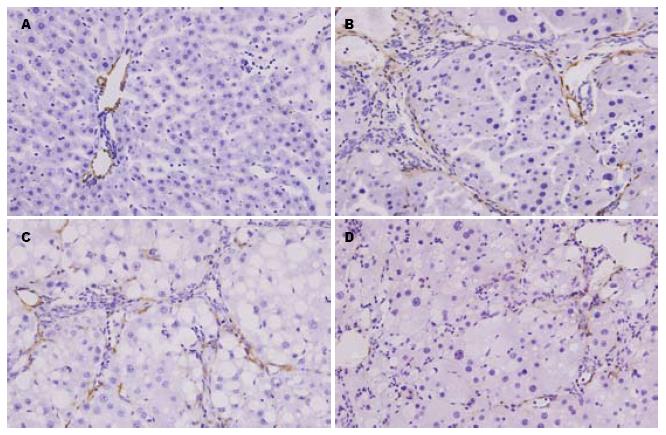
正常组仅在血管壁有少量的α-SMA表达(图4A). 模型组除血管壁表达外, 在门静脉, 汇管区, 纤维间隔和邻近的肝窦中的阳性表达细胞也明显增加, 棕黄色颗粒主要见于胞质(图4B). TUDCA干预组(图4C, 4D)与模型组相比, 阳性表达的细胞明显减少, 且胞质阳性染色减轻, 半定量α-SMA表达的平均光密度值较模型组低(P<0.05). TUDCA干预组与PTX干预组相比无显著差异. TUDCA干预低剂量和高剂量组之间也无显著差异. 各组表达α-SMA的MOD结果见表2.
TUDCA是一种新型天然胆汁酸酰胺化物, 在体内是熊去氧胆酸(ursodeoxycholic acid, UDCA)与牛磺酸的结合形成的一种亲水性的胆汁酸. 最早在熊胆粉中发现. 胆汁酸在临床上已经用于治疗胆固醇结石和胆汁性消化不良及慢性肝脏疾病, 尤其是原发性胆汁性肝硬化和慢性肝炎. 而TUDCA作为最新的胆汁酸药物, 体内及体外研究显示, 其与UDCA相比有更强的细胞保护作用[13,14]. 目前已有临床研究提示用TUDCA治疗由丙型肝炎病毒引起的慢性病毒性肝炎, 可明显降低血清转氨酶水平, 减缓病程进展[15]. 本实验结果表明, 用CCl4诱导大鼠肝纤维化模型, TUDCA干预组大鼠血清HA、LA、Ⅳ-C水平比模型组低; 而肝组织Masson染色显示, TUDCA干预组大鼠肝组织中纤维间隔变细, 纤维增生减少, 半定量结果显示其胶原含量比模型组少(P<0.05), 说明TUDCA存在抗纤维化作用.
TGF-β1在调控纤维化发生发展的中起着核心作用[19], 具有促进肝脏间质细胞分化和增殖, 增加ECM的沉积, 抑制其降解的作用[16]. 同时, TGF-β1也可抑制肝细胞再生, 促其凋亡, 使肝实质细胞与间质成分比例失调, 导致肝脏外基质代谢紊乱, 在Disse间隙过度沉积. TGF-β1调节肝纤维化发生发展的另一重要作用是使HSC激活. 目前研究认为, TGF-β1是调节HSC活化最重要的细胞因子[16]. 活化的HSC可通过自分泌及旁分泌作用促进大量的ECM, 如HA、LN及Ⅳ-C合成[17,18]. 这些ECM在肝脏中过量沉积, 进一步刺激纤维形成及HSC激活, 激活的HSC又可进一步产生TGF-β1, 使纤维化持续发展[19]. 因此, 抑制肝细胞受损, 以及调控TGF-β1合成在抗纤维化有着重要意义. 本实验结果显示, TUDCA治疗组中肝组织TGF-β1表达比模型组显著降低(P<0.05), 而HSC活化的标志物α-SMA的表达也低于模型组(P<0.05), 提示TUDCA干预组中肝组织活化的HSC细胞比模型组减少.
总之, 在CCl4诱导大鼠肝纤维化模型中, TUDCA抑制TGF-β1合成及表达, 进而抑制HSC活化, 减少肝组织ECM合成, 减低其在肝脏中的沉积, 发挥抗纤维化作用.
肝纤维化是各种慢性肝病发展为肝硬化的共同病理基础, 肝脏中细胞外基质合成与降解失衡是肝纤维化发生的主要机制. 各种病因所致反复或持续的慢性肝实质炎症、坏死可导致肝脏持续不断的纤维增生而形成肝纤维化.
刘绍能, 主任医师, 中国中医科学院广安门医院消化科
牛磺熊去氧胆酸(TUDCA)是一种结合型天然胆汁酸, 广泛存在于人和动物的胆汁中. 具有保护肝细胞, 拮抗疏水性胆汁酸的细胞毒作用促进胆汁酸转运和分泌.
临床研究显示TUDCA已经用于治疗胆固醇结石和胆汁性消化不良, 并能改善等待肝移植的肝硬化患者、慢性丙型肝炎患者及原发性胆汁性肝硬化患者的肝功能, 减缓病程进展.
TUDCA是一种新型天然胆汁酸酰胺化物, 较熊去氧胆酸具有更强的亲水性和细胞保护作用, 并能抗肝纤维化, 可用于慢性肝炎、肝纤维化的治疗.
本文实验设计合理, 结果可信, 有一定的参考价值.
编辑 李军亮 电编 吴鹏朕
| 1. | Kitani K, Ohta M, Kanai S. Tauroursodeoxycholate prevents biliary protein excretion induced by other bile salts in the rat. Am J Physiol. 1985;248:G407-G417. [PubMed] [DOI] |
| 2. | Kitani K, Kanai S, Sato Y, Ohta M. Tauro alpha-muricholate is as effective as tauro beta-muricholate and tauroursodeoxycholate in preventing taurochenodeoxycholate-induced liver damage in the rat. Hepatology. 1994;19:1007-1012. [PubMed] [DOI] |
| 3. | Ohiwa T, Katagiri K, Hoshino M, Hayakawa T, Nakai T. Tauroursodeoxycholate and tauro-beta-muricholate exert cytoprotection by reducing intrahepatocyte taurochenodeoxycholate content. Hepatology. 1993;17:470-476. [PubMed] |
| 4. | Heuman DM, Mills AS, McCall J, Hylemon PB, Pandak WM, Vlahcevic ZR. Conjugates of ursodeoxycholate protect against cholestasis and hepatocellular necrosis caused by more hydrophobic bile salts. In vivo studies in the rat. Gastroenterology. 1991;100:203-211. [DOI] |
| 5. | Beuers U, Nathanson MH, Isales CM, Boyer JL. Tauroursodeoxycholic acid stimulates hepatocellular exocytosis and mobilizes extracellular Ca++ mechanisms defective in cholestasis. J Clin Invest. 1993;92:2984-2993. [PubMed] [DOI] |
| 6. | Beuers U, Throckmorton DC, Anderson MS, Isales CM, Thasler W, Kullak-Ublick GA, Sauter G, Koebe HG, Paumgartner G, Boyer JL. Tauroursodeoxycholic acid activates protein kinase C in isolated rat hepatocytes. Gastroenterology. 1996;110:1553-1563. [PubMed] [DOI] |
| 7. | Bruck R, Nathanson MH, Roelofsen H, Boyer JL. Effects of protein kinase C and cytosolic Ca2+ on exocytosis in the isolated perfused rat liver. Hepatology. 1994;20:1032-1040. [PubMed] [DOI] |
| 8. | Dombrowski F, Stieger B, Beuers U. Tauroursodeoxycholic acid inserts the bile salt export pump into canalicular membranes of cholestatic rat liver. Lab Invest. 2006;86:166-174. [PubMed] [DOI] |
| 9. | Xie Q, Khaoustov VI, Chung CC, Sohn J, Krishnan B, Lewis DE, Yoffe B. Effect of tauroursodeoxycholic acid on endoplasmic reticulum stress-induced caspase-12 activation. Hepatology. 2002;36:592-601. [PubMed] [DOI] |
| 10. | Schoemaker MH, Conde de la Rosa L, Buist-Homan M, Vrenken TE, Havinga R, Poelstra K, Haisma HJ, Jansen PL, Moshage H. Tauroursodeoxycholic acid protects rat hepatocytes from bile acid-induced apoptosis via activation of survival pathways. Hepatology. 2004;39:1563-1573. [PubMed] [DOI] |
| 11. | Caglieris S, Giannini E, Dardano G, Mondello L, Valente U, Testa R. Tauroursodeoxycholic acid administration as adjuvant therapy in cirrhotic patients on transplantation waiting lists. Hepatogastroenterology. 2000;47:1045-1047. |
| 12. | Crosignani A, Battezzati PM, Setchell KD, Invernizzi P, Covini G, Zuin M, Podda M. Tauroursodeoxycholic acid for treatment of primary biliary cirrhosis. A dose-response study. Dig Dis Sci. 1996;41:809-815. [PubMed] [DOI] |
| 13. | Tsukahara K, Kanai S, Ohta M, Kitani K. Taurine conjugate of ursodeoxycholate plays a major role in the hepatoprotective effect against cholestasis induced by taurochenodeoxycholate in rats. Liver. 1993;13:262-269. [DOI] |
| 14. | Heuman DM, Bajaj R. Ursodeoxycholate conjugates protect against disruption of cholesterol-rich membranes by bile salts. Gastroenterology. 1994;106:1333-1341. [PubMed] [DOI] |
| 15. | Crosignani A, Budillon G, Cimino L, Del Vecchio Blanco C, Loguercio C, Ideo G, Raimondo G, Stabilini R, Podda M. Tauroursodeoxycholic acid for the treatment of HCV-related chronic hepatitis: a multicenter placebo-controlled study. Hepatogastroenterology. 1998;45:1624-1629. [PubMed] |
| 17. | Herbst H, Wege T, Milani S, Pellegrini G, Orzechowski HD, Bechstein WO, Neuhaus P, Gressner AM, Schuppan D. Tissue inhibitor of metalloproteinase-1 and -2 RNA expression in rat and human liver fibrosis. Am J Pathol. 1997;150:1647-1659. [PubMed] |
| 18. | Gressner AM. Transdifferentiation of hepatic stellate cells (Ito cells) to myofibroblasts: a key event in hepatic fibrogenesis. Kidney Int Suppl. 1996;54:S39-S45. [PubMed] |
| 19. | Bataller R, Brenner DA. Liver fibrosis. J Clin Invest. 2005;115:209-218. [PubMed] [DOI] |