修回日期: 2010-05-21
接受日期: 2010-05-25
在线出版日期: 2010-07-08
目的: 研究应用安全性较好的二甲双胍对胃癌细胞的抑制作用, 初步探讨可能机制.
方法: 以二甲双胍联合或不联合5-氟尿嘧啶干预AGS细胞作为实验组, 无药物组作对照. 干预24、48、72 h应用MTT检测细胞增殖, 干预48 h流式细胞术检测凋亡、线粒体膜电位, 72 h通过细胞划痕实验反映迁移能力改变, 药物作用24 h抽提细胞RNA以RT-PCR检测相关基因转录改变.
结果: AGS细胞相对活力明显降低(24、48、72 h: F = 99.32, 127.30, 235.72, 均P<0.01), 并具有浓度-时间依赖性, 联合应用5-氟尿嘧啶显示协同作用(24 h: t = 2.97, P<0.05; 48、72 h: t = 4.61, 6.02, 均P<0.01). 线粒体膜电位下降(t = 12.43, P<0.01), 凋亡增加(t = 8.32, P<0.01), 平均迁移速率明显减慢(12、24、48 h: t = 9.13, 13.77, 14.21, 均P<0.01), cyclin D1、Bcl-2、MMP-2、MMP-9 mRNA均减少, Bax增加.
结论: 二甲双胍能够抑制AGS胃癌细胞增殖、迁移, 促进凋亡, 与5-氟尿嘧啶联合应用具有协同抑制作用.
引文著录: 薛知新, 钟捷, 赵丹瑜, 许慈, 孙萍胡, 姚静静. 二甲双胍对AGS胃癌细胞生长侵袭的抑制作用. 世界华人消化杂志 2010; 18(19): 1974-1978
Revised: May 21, 2010
Accepted: May 25, 2010
Published online: July 8, 2010
AIM: To investigate the effects of metformin, a widely used antihyperglycemic agent, on cell proliferation, apoptosis and migration in human gastric cancer cell line AGS, and to examine whether there are synergistic effects between metformin and 5-fluorouracil (5-FU).
METHODS: AGS cells were treated with metformin alone or in combination with 5-FU. Methyl thiazolyl tetrazolium (MTT) assay was used to detect cell relative viability at 24, 48 and 72 h after treatment. Apoptosis and mitochondrial membrane potential were examined by flow cytometry (FCM) at 48 h. Cell migration at 72 h was determined by scratch assay. The expression of cyclin D1, Bcl-2, MMP-2, MMP-9 and Bax mRNAs in AGS cells at 24 h was detected by RT-PCR.
RESULTS: Metformin significantly inhibited cell proliferation in a dose- and time-dependent manner (24, 48 and 72 h: F = 99.32, 127.30 and 235.72, respectively; all P < 0.01). After metformin treatment, mitochondrial membrane potential decreased (t = 12.43, P < 0.01), apoptosis rate increased (t = 8.32, P < 0.01), and average migration velocity was reduced (12, 24 and 48 h: t = 9.13, 13.77 and 14.21, respectively; all P < 0.01) in AGS cells. The expression of cyclin D1, Bcl-2, MMP-2 and MMP-9 mRNAs was down-regulated, while that of Bax mRNA was up-regulated after metformin treatment. Metformin treatment enhanced 5-FU-mediated cell growth inhibition (24 h: t = 2.97, P < 0.05; 48 h, t = 4.61, P < 0.01; 72 h: t = 6.02, P < 0.01).
CONCLUSION: Metformin can inhibit cell proliferation and migration and promote apoptosis in human gastric cancer cell line AGS. Metformin and 5-FU have a synergistic anti-proliferation effect in AGS cells.
- Citation: Xue ZX, Zhong J, Zhao DY, Xu C, Sun PH, Yao JJ. Metformin inhibits cell proliferation and migration in gastric cancer cell line AGS. Shijie Huaren Xiaohua Zazhi 2010; 18(19): 1974-1978
- URL: https://www.wjgnet.com/1009-3079/full/v18/i19/1974.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i19.1974
近年来, 关于药物治疗糖尿病引发肿瘤发生的研究逐渐将人们的目光引向降糖药物二甲双胍[1,2]. 二甲双胍在乳腺癌、前列腺癌等肿瘤的临床前研究可见报道, 但在消化系尤其胃癌方面, 尚未见有报道[3,4]. 本研究通过检测二甲双胍干预人AGS胃癌细胞后其生长、凋亡、侵袭能力的改变、相关基因转录以及与化疗药物联合用药的效果, 初步探讨可能机制.
AGS胃癌细胞为上海交通大学瑞金医院内科实验室保存. RPMI 1640培养液、胎牛血清、青链霉素、胰酶购自Gibco公司. 二甲双胍、3-(4, 59二甲基噻唑-2)-2, 5-二苯基四氮唑溴盐(MTT)、二甲基亚砜(DMSO)购自Sigma公司. AnnexinⅤ-FITC流式细胞凋亡检测试剂盒购自Becton Dickinson公司. TRIzol、逆转录试剂盒购自TaKaRa公司. PCR试剂盒购自天根生化科技(北京)有限公司. PCR引物由上海生工生物工程技术服务有限公司合成. 酶联免疫检测仪为Thermo公司产品. 流式细胞仪为Becton Dickinson公司产品. 凝胶成像系统为BIO-RAD公司产品. 流式细胞术检测结果用CELLQUET软件分析, 细胞划痕实验结果用ImagePro软件分析.
1.2.1 细胞培养及药物干预: AGS细胞在37 ℃, 50 mL/L CO2的饱和湿度无菌培养箱常规培养于含100 mL/L胎牛血清, 100 kU/L青霉素、100 mg/L链霉素的RPMI 1640培养液中. 一定浓度的二甲双胍在每次实验前即时配制.
1.2.2 相对生存能力分析: 处于对数生长期的细胞以每孔8×103/200 µL接种于96孔板, 设对照组和实验组, 每组8复孔, 周边余孔以无菌PBS封闭. 培养24 h后, 每孔换以含不同浓度(0、5、10、12.5、17.5、20 mmol/L)二甲双胍的培养基, 其中0 mmol/L组为对照组, 其余均为实验组. 分别继续培养24、48、72 h, 每孔加入5 g/L MTT 20 µL, 37℃孵育4 h, 弃去液体, 每孔加DMSO 150 µL, 避光振荡20 min使结晶充分溶解. 酶联免疫检测仪570 nm波长测定吸光度(A)值, 以不加细胞的培养基孔调零. 细胞相对存活率 = (实验孔A570-调零孔A570)/(对照孔A570-调零孔A570)×100%. 联合用药实验设无药物对照组、单用二甲双胍组、单用5-氟尿嘧啶(40 mg/L)组、两药联合应用组, 以MTT分析.
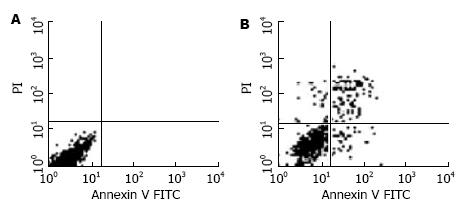
1.2.3 细胞凋亡及线粒体膜电位检测: 细胞以每孔3×105/2 mL接种于6孔板, 每组设3复孔. 培养24 h后再以二甲双胍作用48 h, 用不含EDTA的0.25%胰酶消化并收集细胞于流式管, 离心弃上清, 每管加结合缓冲液100 µL重悬, 加AnnexinⅤ-FITC 5 µL避光10 min, 加碘化丙啶, 之后以结合缓冲液补足500 µL, 流式细胞仪检测细胞凋亡. 线粒体膜电位检测方法为将消化所得细胞经PBS洗涤离心, 加10 µL罗达明-123(10 mg/L), 37 ℃避光孵育20 min, PBS洗涤两次, 上流式细胞仪检测.
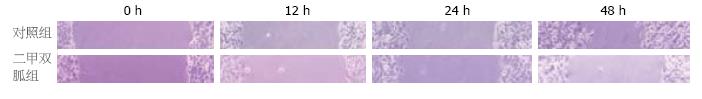
1.2.4 侵袭能力分析: 细胞划痕实验将细胞以每孔2×105/2 mL接种于6孔板, 每组3复孔, 为提供显微镜下参照, 事先在每孔底部水平方向画5条平行线. 24 h后, 加含或不含二甲双胍完全培养基继续培养72 h, 各组细胞均达到80%-90%融合, 换无血清培养液饥饿过夜使细胞同步化, 以200 µL移液器枪头在每孔中央纵向划一直线, 无菌PBS轻柔洗涤2次, 加无血清培养基培养. 分别在划痕后0、12、24、48 h显微镜下观察划痕处的细胞生长状况并拍照.
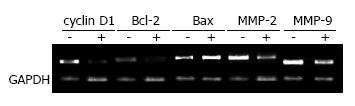
1.2.5 RT-PCR检测相关基因转录: 二甲双胍干预24 h后以TRIzol法提取各组细胞总RNA, 取1 µg逆转录成cDNA, 进行RCR反应, 控制反应循环数勿使反应进入平台期. 以甘油醛-3-磷酸脱氢酶(GAPDH)作为内参. GAPDH引物: 上游: GCACCGTCAAGGCTGAGAAC, 下游: ATGGTGGTGAAGACGCCAGT; 周期蛋白D1(cyclin D1)引物: 上游: TCTACACCGACAACTCCATCC, 下游: TGTGAGGCGGTAGTAGGACAG; B细胞淋巴瘤/白血病-2(Bcl-2)引物: 上游: GATGGCAAATGACCAGCAGA, 下游: GCAGGATAGCAGCACAGGAT; B细胞淋巴瘤/白血病-2相关x蛋白(Bax)引物: 上游AGGATCGAGCAGGGCGAATG, 下游GCTCCCGGAGGAAGTCCAAT; 基质金属蛋白酶2(matrix metalloproteinase 2, MMP-2)引物: 上游CCGTCGCCCATCATCAAGTTCC, 下游GCACGAGCAAAGGCATCATCCA; 基质金属蛋白酶9(matrix metalloproteinase 9, MMP-9)引物: 上游TCCCTGGAGACCTGAGAACC, 下游CGGCAAGTCTTCCGAGTAGTTT.
统计学处理 实验数据以mean±SD表示, 应用SPSS13.0统计软件, 进行单因素方差分析、t检验, 按α = 0.05的检验水准, P<0.05为差异具有统计学意义.
MTT分析显示, 12、24、48 h对照组吸光度低于实验组, 差异具统计学意义(F = 99.32, 127.30, 235.72, 均P<0.01), 提示二甲双胍可以明显抑制AGS细胞生长, 且随药物浓度和作用时间延长抑制效果更加明显. 达到50%抑制率的药物浓度在10 mmol/L左右, 之后实验均在此浓度进行(表1, 图1).
实验组中联合用药组比单用二甲双胍组、单用5-FU组抑制增殖作用更加明显, 差异具统计学意义(联合用药组24 h: t = 3.74, 48 h: t = 6.06, 72 h: t = 12.94, 均P<0.01 vs 单用二甲双胍组; 联合用药组24 h: t = 2.97, P<0.05, 48 h: t = 4.61, P<0.01, 72 h: t = 6.02, P<0.01 vs 单用5-FU组). 不同浓度二甲双胍与5-FU合用, 抑制率具有差异, 尤其较高浓度(15 mmol/L)与较低浓度(5 mmol/L)之间, 但随着时间延长差异逐渐变小(24 h: F = 10.01, P<0.01; 48 h: F = 5.41, P<0.05; 72 h: F = 3.40, P>0.05, 表2).
AGS细胞经二甲双胍作用后早期凋亡(t = 6.57, P<0.05)、晚期凋亡(t = 5.58, P<0.01)、总凋亡(t = 8.32, P<0.01)比例均明显上升, 并呈现明显低线粒体膜电位(高荧光强度)状态(380.61±52.25 vs 5.49±0.89, t = 12.43, P<0.01). 提示二甲双胍具有通过影响线粒体膜电位促进AGS胃癌细胞凋亡作用(表3).
实验组的12、24、48 h平均迁移速率均明显小于对照组(t = 9.13, 13.77, 14.21, 均P<0.01), 对照组48 h后部分视野划痕得到"愈合"(表4, 图2).
二甲双胍作用后, 与对照组相比, cyclin D1、Bcl-2、MMP-2、MMP-9的量均明显减少, Bax量增加. 与前述增殖、迁移抑制、促进凋亡结果相符(图3)
细胞恶性增殖、永生化、转移都是肿瘤发生发展中最基本也是不可避免的问题, 二甲双胍是否能对胃癌细胞的这些变化具有抑制作用也成为其抗肿瘤效应的关键. 于是实验从细胞增殖、凋亡、迁移等方面着手设计, 观察药物干预后改变, 并检测相关基因转录的变化以期探索可能作用机制. 从结果来看, AGS胃癌细胞经二甲双胍作用后, 细胞增殖、迁移受到明显抑制, 凋亡增加. RT-PCR检测的5个相关基因中, cyclin D1是细胞周期调控中的重要分子, 结果显示其量减少, 使得细胞不能进行有效增殖[5]. 这与Ben等[4]的研究发现相符. Bcl-2基因家族与细胞凋亡密切相关, 家族成员中包括对凋亡有抑制作用的比如Bcl-2, 也有促进凋亡的比如Bax. 本实验中Bcl-2减少, 而Bax增加, 两种变化均指向了促进细胞凋亡进行的方向. 另外, 肿瘤转移也是影响肿瘤预后的极大因素, 80%-90%的胃癌患者发现有转移[6]. MMP家族中的MMP-2、MMP-9是肿瘤发生转移非常关键的分子[7]. 二甲双胍下调了MMP-2、MMP-9, 从而有效地抑制了细胞迁移. 除此之外, 胃癌是临床上治疗相当棘手的一种疾病, 因为其不仅对一般化疗药物不敏感, 并且胃癌常用化疗药物如5-FU不良反应相当严重. 二甲双胍作为一种临床广泛应用的安全药物, 如果能增强胃癌细胞对常用化疗药物敏感性, 将提供一个潜在的新治疗途径. 于是本实验联合应用5-FU与二甲双胍, 结果显示具有协同作用, 为临床联合用药治疗胃癌拓展了一条可参考的思路.
近来, 临床常用药以及食品提取物抗肿瘤作用逐渐受到重视[8,9]. 二甲双胍作为安全有效的降糖药物, 其降血糖机制被认为与激活腺苷酸活化蛋白激酶(AMP-activated protein kinase, AMPK)有关[10,11]. AMPK虽是细胞能量平衡方面的重要分子, 但最近研究发现他还参与对肿瘤细胞的调控[12-14]. AMPK能够磷酸化哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR), 并通过mTOR下游分子使cyclin D1、MMP-9等与肿瘤发生、发展相关的分子表达增加[15,16]. 作为AMPK的激活剂, 二甲双胍的抗肿瘤效应已被少量研究证实, 比如Zakikhani等[17]和Dowling等[18]分别证明二甲双胍能抑制乳腺细胞生长, Jiralerspong等[19]发现二甲双胍能提高糖尿病乳腺癌患者对新辅助化疗的反应性. 这些研究主要局限于乳腺癌等肿瘤类型, 对于消化系肿瘤研究较少. 本实验用二甲双胍干预AGS胃癌细胞, 试图探究安全、经济的临床常用药物二甲双胍能否为胃癌这类对化疗普遍不敏感的实体性消化系统肿瘤提供新的治疗可能性.
二甲双胍应用于AGS胃癌细胞能够发挥抗肿瘤效应, 并且作为一种安全性较好的药物, 很值得进一步探索在肿瘤治疗方面的应用, 期待更多深入的基础及临床研究, 为胃癌以至其他肿瘤治疗开辟更安全有效的途径[20].
胃癌是对人类健康危害极大的疾病, 临床上化疗药物效果不佳、不良反应大. 近来糖尿病与肿瘤关系的研究逐渐将人们的目光引向降糖药物二甲双胍. 二甲双胍的抑制肿瘤作用在部分肿瘤类型少量临床前研究, 但在消化系尤其胃癌方面尚未见有报道.
王振宁, 教授, 中国医科大学附属第一医院肿瘤外科
临床安全性较高的常用药以及食品提取物抗肿瘤作用逐渐受到重视. 二甲双胍作为AMPK的激活剂, 其在肿瘤治疗方面的应用及相关机制逐渐成为研究热点.
AMPK作为细胞能量平衡方面的重要分子, 其参与对肿瘤的调控作用被发现. 可能通过抑制mTOR途径起到抗肿瘤作用.
本研究将临床上已经广泛使用的降糖药物二甲双胍应用于胃癌细胞, 观察对胃癌细胞生长、侵袭的抑制作用, 并且探讨了与胃癌常用化疗药物5-氟尿嘧啶的联合用药效果, 有望为胃癌治疗提供新的思路.
本研究发现胃癌细胞经二甲双胍作用后, 细胞增殖、迁移受到明显抑制, 凋亡增加, 并与5-氟尿嘧啶联合用药能显示协同作用, 在临床上有可能为联合化疗治疗胃癌提供新的补充途径, 降低常用化疗药物剂量, 减轻不良反应.
腺苷酸活化蛋白激酶(AMPK): 是一种在细胞内行使能量代谢调节的蛋白激酶. 是一种三聚体, 催化亚基α, 调节亚基γ, β亚基为连接α与γ亚基的桥梁. AMPK在糖尿病及肥胖症等代谢性疾病中发挥重要作用. 近来发现AMPK与衰老、神经系统的能量代谢调控、肿瘤调控等方面也密切相关.
本研究设计尚可, 内容新颖, 有一定参考价值.
编辑 曹丽鸥 电编 吴鹏朕
| 1. | Li D, Yeung SC, Hassan MM, Konopleva M, Abbruzzese JL. Antidiabetic therapies affect risk of pancreatic cancer. Gastroenterology. 2009;137:482-488. [PubMed] [DOI] |
| 2. | Bowker SL, Majumdar SR, Veugelers P, Johnson JA. Increased cancer-related mortality for patients with type 2 diabetes who use sulfonylureas or insulin. Diabetes Care. 2006;29:254-258. [PubMed] [DOI] |
| 3. | Alimova IN, Liu B, Fan Z, Edgerton SM, Dillon T, Lind SE, Thor AD. Metformin inhibits breast cancer cell growth, colony formation and induces cell cycle arrest in vitro. Cell Cycle. 2009;8:909-915. [PubMed] [DOI] |
| 4. | Ben Sahra I, Laurent K, Loubat A, Giorgetti-Peraldi S, Colosetti P, Auberger P, Tanti JF, Le Marchand-Brustel Y, Bost F. The antidiabetic drug metformin exerts an antitumoral effect in vitro and in vivo through a decrease of cyclin D1 level. Oncogene. 2008;27:3576-3586. [PubMed] [DOI] |
| 5. | Moghaddam SJ, Haghighi EN, Samiee S, Shahid N, Keramati AR, Dadgar S, Zali MR. Immunohistochemical analysis of p53, cyclinD1, RB1, c-fos and N-ras gene expression in hepatocellular carcinoma in Iran. World J Gastroenterol. 2007;13:588-593. [DOI] |
| 6. | Kunisaki C, Makino H, Akiyama H, Otsuka Y, Ono HA, Kosaka T, Takagawa R, Nagahori Y, Takahashi M, Kito F. Clinical significance of the metastatic lymph-node ratio in early gastric cancer. J Gastrointest Surg. 2008;12:542-549. [PubMed] [DOI] |
| 7. | de Mingo M, Morán A, Sánchez-Pernaute A, Iniesta P, Díez-Valladares L, Pérez-Aguirre E, de Juan C, García-Aranda C, Díaz-López A, García-Botella A. Expression of MMP-9 and TIMP-1 as prognostic markers in gastric carcinoma. Hepatogastroenterology. 2007;54:315-319. [PubMed] |
| 8. | Johnson JJ, Bailey HH, Mukhtar H. Green tea polyphenols for prostate cancer chemoprevention: a translational perspective. Phytomedicine. 2010;17:3-13. [PubMed] [DOI] |
| 9. | Nakamura Y, Yogosawa S, Izutani Y, Watanabe H, Otsuji E, Sakai T. A combination of indol-3-carbinol and genistein synergistically induces apoptosis in human colon cancer HT-29 cells by inhibiting Akt phosphorylation and progression of autophagy. Mol Cancer. 2009;8:100. [PubMed] [DOI] |
| 10. | Zhou G, Myers R, Li Y, Chen Y, Shen X, Fenyk-Melody J, Wu M, Ventre J, Doebber T, Fujii N. Role of AMP-activated protein kinase in mechanism of metformin action. J Clin Invest. 2001;108:1167-1174. [PubMed] [DOI] |
| 11. | Shaw RJ, Lamia KA, Vasquez D, Koo SH, Bardeesy N, Depinho RA, Montminy M, Cantley LC. The kinase LKB1 mediates glucose homeostasis in liver and therapeutic effects of metformin. Science. 2005;310:1642-1646. [PubMed] [DOI] |
| 12. | Hardie DG. AMP-activated/SNF1 protein kinases: conserved guardians of cellular energy. Nat Rev Mol Cell Biol. 2007;8:774-785. [PubMed] [DOI] |
| 13. | Hadad SM, Fleming S, Thompson AM. Targeting AMPK: a new therapeutic opportunity in breast cancer. Crit Rev Oncol Hematol. 2008;67:1-7. [PubMed] [DOI] |
| 14. | Shackelford DB, Shaw RJ. The LKB1-AMPK pathway: metabolism and growth control in tumour suppression. Nat Rev Cancer. 2009;9:563-575. [PubMed] [DOI] |
| 15. | Inoki K, Li Y, Xu T, Guan KL. Rheb GTPase is a direct target of TSC2 GAP activity and regulates mTOR signaling. Genes Dev. 2003;17:1829-1834. [PubMed] [DOI] |
| 16. | Graff JR, Zimmer SG. Translational control and metastatic progression: enhanced activity of the mRNA cap-binding protein eIF-4E selectively enhances translation of metastasis-related mRNAs. Clin Exp Metastasis. 2003;20:265-273. [PubMed] [DOI] |
| 17. | Zakikhani M, Dowling R, Fantus IG, Sonenberg N, Pollak M. Metformin is an AMP kinase-dependent growth inhibitor for breast cancer cells. Cancer Res. 2006;66:10269-10273. [PubMed] [DOI] |
| 18. | Dowling RJ, Zakikhani M, Fantus IG, Pollak M, Sonenberg N. Metformin inhibits mammalian target of rapamycin-dependent translation initiation in breast cancer cells. Cancer Res. 2007;67:10804-10812. [PubMed] [DOI] |
| 19. | Jiralerspong S, Palla SL, Giordano SH, Meric-Bernstam F, Liedtke C, Barnett CM, Hsu L, Hung MC, Hortobagyi GN, Gonzalez-Angulo AM. Metformin and pathologic complete responses to neoadjuvant chemotherapy in diabetic patients with breast cancer. J Clin Oncol. 2009;27:3297-3302. [PubMed] [DOI] |
| 20. | Goodwin PJ, Ligibel JA, Stambolic V. Metformin in breast cancer: time for action. J Clin Oncol. 2009;27:3271-3273. [PubMed] [DOI] |