修回日期: 2010-05-19
接受日期: 2010-05-25
在线出版日期: 2010-07-08
目的: 研究胃癌细胞来源的外来体对Jurkat T细胞凋亡的影响, 初步探讨MAPK/ERK通路在此过程中的作用.
方法: 采用离心超滤和蔗糖密度梯度超速离心的方法从胃癌SGC7901细胞的上清液中分离出胃癌细胞来源的外来体. 透射电子显微镜下观察外来体形态, 流式细胞仪PI染色检测细胞凋亡, Western blot检测蛋白表达.
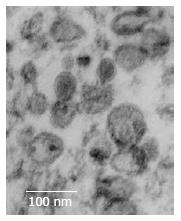
结果: 透射电子显微镜下观察胃癌SGC7901细胞来源的外来体具有特征性的盘状结构, 由双层膜构成, 他们的直径为30-100 nm. 外来体能以时间和剂量依赖性的方式诱导Jurkat T细胞凋亡, 在凋亡过程中伴有caspase-3, 8的活化和p-ERK表达的下调.
结论: 胃癌细胞来源的外来体能诱导Jurkat T细胞凋亡, 其机制可能与抑制MAPK/ERK通路的活性有关.
引文著录: 曲晶磊, 赵明芳, 曲秀娟, 侯科佐, 姜又红, 杨向红, 刘云鹏. MAPK/ERK信号通路在胃癌细胞来源的外来体诱导Jurkat T细胞凋亡中的作用. 世界华人消化杂志 2010; 18(19): 1969-1973
Revised: May 19, 2010
Accepted: May 25, 2010
Published online: July 8, 2010
AIM: To investigate the role of the mitogen-activated protein kinase (MAPK)/extracellular signal-regulated protein kinase (ERK) signaling pathway in gastric cancer exosome-induced apoptosis of Jurkat T cells.
METHODS: Gastric cancer exosomes were isolated and purified by serial centrifugation and sucrose gradient ultracentrifugation. The morphology of gastric cancer exosomes was observed by electron microscopy. Cell apoptosis was determined by propidium iodide staining and flow cytometry. The expression of caspase-3 and -8 and p-ERK was assayed by Western blot.
RESULTS: Gastric cancer exosomes, ranging in diameter from 30 to 100 nm, had a characteristic saucer-like shape that was limited by a lipid bilayer. These exosomes induced Jurkat T cell apoptosis in a time- and dose-dependent manner. Activation of caspase-3 and -8 and down-regulation of p-ERK expression were noted in exosome-induced apoptosis of Jurkat T cells.
CONCLUSION: Gastric cancer exosomes induce apoptosis of Jurkat T cells possibly by inhibiting the MAPK/ERK pathway.
- Citation: Qu JL, Zhao MF, Qu XJ, Hou KZ, Jiang YH, Yang XH, Liu YP. Role of MAPK/ERK signaling pathway in gastric cancer exosome-induced apoptosis of Jurkat T cells. Shijie Huaren Xiaohua Zazhi 2010; 18(19): 1969-1973
- URL: https://www.wjgnet.com/1009-3079/full/v18/i19/1969.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i19.1969
肿瘤能在人体内发生并长期生存, 是由于肿瘤细胞在长期的生长过程中形成了多重免疫逃逸机制, 使机体的免疫系统无法对肿瘤细胞进行识别和杀伤. 最近研究表明肿瘤细胞分泌的exosomes能抑制T细胞和NK细胞的功能, 诱导免疫耐受[1,2]. 本课题组之前的研究显示肿瘤来源的exosomes能诱导Jurkat T细胞凋亡, 在凋亡过程中伴随有PI3K/Akt通路的失活[3], 但MAPK/ERK信号通路在此过程中的作用不清楚. 本研究分离纯化了胃癌SGC7901细胞来源的exosomes, 评价了MAPK/ERK信号通路在胃癌细胞来源的exosomes诱导Jurkat T细胞凋亡中的作用, 为进一步阐明exosomes诱导肿瘤免疫逃避和免疫耐受的机制提供了理论
基础.
RPMI 1640培养基购自Gibco公司, 胎牛血清购自天津血液病研究所. 100 kDa MWCO Amicon超滤管购自美国Millipore公司, 重水购自美国Sigma公司. 兔抗人caspase-3抗体购自Santa Cruz公司, 兔抗人caspase-8抗体购自Lab Vision公司, 鼠抗人Tubulin抗体购自BD Biosciences Pharmingen公司, 兔抗人p-ERK和ERK抗体购自Cell Signaling公司. 辣根过氧化物酶标记的羊抗鼠和羊抗兔二抗购自北京中杉金桥生物技术有限公司, ECL试剂盒购自PIERCE公司.
1.2.1 细胞培养: 人低分化胃腺癌细胞株SGC7901和Jurkat T细胞为本实验室常规传代培养, 生长于含有100 mL/L灭活胎牛血清、12 kU/L庆大霉素的RPMI 1640培养液中, 于37 ℃、50 mL/L CO2、饱和湿度的培养箱内培养, 0.25%胰酶消化液消化传代, 2-3 d传代1次. 所有实验均采用对数生长期细胞. 血清来源的exosomes的去除采用两步法分离, 即10 000 g×30 min, 100 000 g×1 h.
1.2.2 exosomes的制备: 胃癌SGC7901细胞培养48 h后收集细胞上清液用于exosomes的制备. 首先, 收集的上清液通过一系列离心去除细胞及碎片: 4 ℃, 300 g×10 min、1 200 g×30 min、10 000 g×30 min. 然后将上清液移入100 kDa MWCO Amicon 50 mL超滤离心管中, 4 ℃离心, 1 000 g×30 min, 取浓缩液. 将超滤后液体移至含有30%蔗糖/重水垫的15 mL超速离心管中, 4 ℃ 100 000 g超速离心1 h. 收集底部含有exosomes的缓冲垫, 用至少5倍体积的PBS稀释后, 置于100 kDa MWCO Amicon超滤离心管中, 4 ℃ 1 000 g离心30 min, 重复3次. 得到的浓缩液即为exosomes, 0.22 μm滤膜过滤除菌, Bardford法检测蛋白浓度, 分装备用, -80 ℃保存.
1.2.3 电镜: 将exosomes超速离心成沉淀后, 经固定液(2%多聚甲醛, 0.25%戊二醛)4 ℃固定1 h, PBS洗涤3次(15分/次), 1%锇酸固定1.5 h, PBS洗涤3次(15分/次), 梯度酒精脱水, 环氧树脂浸透过夜、包埋, 于35 ℃、45 ℃、60 ℃聚合24 h, 经超薄切片、铅铀染色后透射电镜下观察摄片.
1.2.4 细胞凋亡的检测: 取对数生长期的Jurkat T细胞, 将细胞浓度调至3×105/mL接种于6孔板, 分别加入终浓度为0、25、100和400 mg/L的exosomes培养24和48 h后收集细胞于流式管中, 冷PBS洗2次, 用70%的冷乙醇4 ℃固定过夜后, 冷PBS洗2次, 加入RNase A(20 mg/L)37 ℃孵育30 min后, 加入PI(20 mg/L)避光孵育30 min, 用FACScan流式细胞仪进行DNA含量检测, 判定凋亡百分率.
1.2.5 Western blot 检测蛋白表达: 分别收集对照组及处理组细胞, 将其裂解于200 μL含有蛋白酶抑制剂(100 mg/L PMSF, 2 mg/L Aprotitin)的裂解液中[1% Triton X-100, 50 mmol/L Tris-HCl(pH 7.4), 150 mmol/L NaCl, 10 mmol/L EDTA, 100 mmol/L NaF, 1 mmol/L Na3VO4], 4 ℃裂解40 min, 15 000 r/min离心20 min, 取上清, Bardford法进行蛋白定量. 与3×样品缓冲液混合后, 煮沸5 min. 将样品在10%的SDS-聚丙烯凝胶中进行电泳3 h, 然后转印至硝酸纤维素膜上. 用5%脱脂牛奶封闭1 h后, 分别加入一抗, 4 ℃过夜. TTBS洗4次后加入辣根过氧化物酶标记的二抗, 室温作用30 min, ECL法显色, GIS凝胶图像分析系统照相并分析处理.
统计学处理 所有数据均为3次独立实验结果, 以mean±SD表示. 采用SPSS13.0统计软件进行统计学分析. 两组之间比较采用t检验, P<0.05有统计学意义.
通过离心超滤和蔗糖密度梯度离心, 我们从胃癌SGC7901细胞的上清液中分离出肿瘤来源的exosomes, 然后通过透射电子显微镜对其形态进行了观察. 如图1所示: exosomes具有特征性的盘状结构, 由双层膜构成, 他们的直径为30-100 nm.
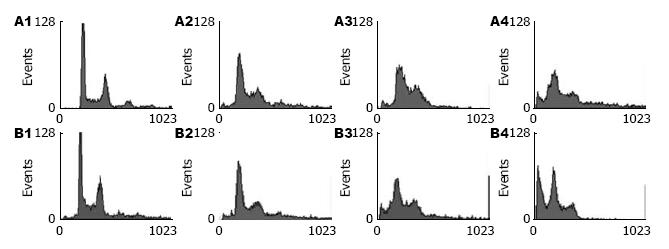
流式细胞仪分析显示不同浓度的exosomes作用于Jurkat T细胞24和48 h后, exosomes以时间和剂量依赖性的方式诱导Jurkat T细胞凋亡. 400 mg/L的exosomes作用于Jurkat T细胞48 h后, 有34.61%的细胞发生了凋亡, 而对照组仅有2.72%的细胞发生凋亡(P<0.01, 图2).
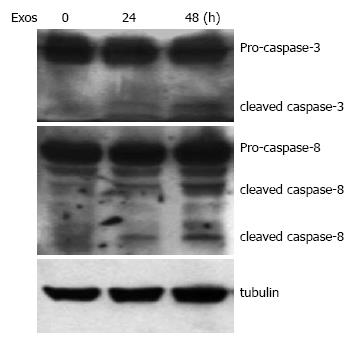
400 mg/L的exosomes分别作用于Jurkat T细胞24和48 h, Western blot结果显示, exosomes作用24 h能检测出裂解的caspase-3和caspase-8片段, 48 h时更明显(图3).
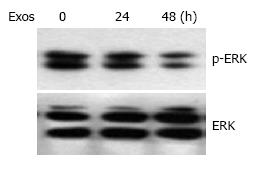
由于MAPK/ERK通路在细胞增殖和凋亡方面的发挥着重要的作用, 我们进一步检测了ERK的活性, Western blot结果显示exosomes以时间依赖性的方式下调p-ERK的表达(图4).
exosomes是由细胞分泌至胞外的膜性小囊泡, 表面含有大量与其来源和功能密切相关的蛋白质和脂质成分[4,5]. 最近研究发现很多类型的细胞都能释放exosomes, 但是大多数研究集中在免疫细胞和肿瘤细胞释放的exosomes. 由于树突状细胞和肿瘤细胞来源的exosomes可同时表达MHC、共刺激分子、热休克蛋白和肿瘤抗原, 体内和体外实验证明其能诱发和增强机体的免疫反应, 具有抗肿瘤作用[6,7], 因此exosomes作为一种新型的亚细胞疫苗被广泛研究. 但近年来也有研究表明肿瘤来源exosomes在特定的环境中也能下调免疫应答或诱导免疫耐受, 这给exosomes的研究提出了新的挑战. 目前越来越多的证据表明exosomes在体内发挥免疫增强作用依赖宿主的树突状细胞[8], exosomes和免疫细胞的直接作用通常表现为免疫抑制. Taylor和Gercel-Talor报道, 卵巢癌来源的exosomes抑制T细胞活化的信号分子CD3-ζ和JAK 3的表达, 从而诱导T细胞凋亡[9]. 另外一项研究结果显示exosomes能选择性破坏淋巴细胞对IL-2的反应[10].
基于上述研究结果, 我们以胃癌SGC7901细胞为模型, 研究了肿瘤来源的exosomes对Jurkat T细胞活性的影响. 结果显示, 胃癌细胞来源的exosomes能以时间和剂量依赖性的方式诱导Jurkat T细胞凋亡, 且在凋亡过程中存在caspase-3和caspase-8的活化. 目前多数学者认为肿瘤来源的exosomes诱导免疫耐受与其表面表达FasL和TRAIL有关[11,12], 其可能通过与T细胞表面的死亡受体结合而诱导细胞凋亡. 我们的研究发现exosomes在诱导Jurkat T细胞凋亡过程中激活了caspase-8, 提示exosomes通过死亡受体通路诱导细胞凋亡.
细胞的存活主要取决于增殖和凋亡信号的平衡. MAPK/ERK信号转导通路是细胞内重要的促增殖和抗凋亡通路, 通过影响下游细胞周期调节蛋白、凋亡相关蛋白等效应分子的活性, 在细胞的增殖、分化和凋亡中起着重要作用[13,14]. 本研究发现胃癌细胞来源的exosomes在诱导Jurkat T细胞凋亡过程中伴随有p-ERK表达的下调, 提示exosomes可能过下调ERK的活性而发挥促凋亡作用. 我们之前的研究显示胃癌细胞来源的exosomes在诱导Jurkat T细胞凋亡过程上调了泛素连接酶Cbl蛋白的表达, 并通过泛素化PI3K启动蛋白酶体降解途径, 进而抑制Akt的活性, 最终导致细胞凋亡的发生[3]. 而近来研究表明, Cbl蛋白也能调控MAPK/ERK通路的活性. Zha等报道转染Cbl显性失活突变体的CD4+ T细胞, 能增强抗CD3/CD28诱导的p-ERK的表达[15]. 这些结果提示在exosomes诱导Jurkat T细胞凋亡过程中, ERK可能是Cbl蛋白作用的另一靶分子.
总之, 本研究结果显示胃癌细胞能通过释放exosomes呈递凋亡信号给抗肿瘤的T细胞, 而不需要细胞与细胞间的直接接触. 研究首次报道了胃癌细胞来源的exosomes在诱导Jurkat T细胞凋亡过程中伴随有ERK活性的下调, 提示MAPK/ERK通路的失活可能是exosomes诱导免疫耐受的一种机制. 进一步研究exosomes和免疫细胞相互作用的分子机制能为我们更好地理解肿瘤免疫抑制的机制提供新的思路.
肿瘤能在人体内发生并长期生存, 是由于肿瘤细胞在长期的生长过程中形成了多重免疫逃逸机制, 使机体的免疫系统无法对肿瘤细胞进行识别和杀伤. 最近研究表明肿瘤细胞分泌的exosomes能抑制T细胞和NK细胞的功能, 诱导免疫耐受. 本课题组之前的研究显示肿瘤来源的exosomes能诱导Jurkat T细胞凋亡, 在凋亡过程中伴随有PI3K/Akt通路的失活, 但MAPK/ERK信号通路在此过程中的作用不清楚.
田字彬, 教授, 青岛大学医学院附属医院消化内科
最近研究发现很多类型的细胞都能释放exosomes, 但是大多数研究集中在免疫细胞和肿瘤细胞释放的exosomes.
目前多数学者认为肿瘤来源的exosomes诱导免疫耐受与其表面表达FasL和TRAIL有关, 其可能通过与T细胞表面的死亡受体结合而诱导细胞凋亡.
本文有先进性和科学性, 对揭示肿瘤免疫机制有一定帮助.
编辑 曹丽鸥 电编 吴鹏朕
| 1. | Iero M, Valenti R, Huber V, Filipazzi P, Parmiani G, Fais S, Rivoltini L. Tumour-released exosomes and their implications in cancer immunity. Cell Death Differ. 2008;15:80-88. [PubMed] [DOI] |
| 2. | Ashiru O, Boutet P, Fernández-Messina L, Agüera-González S, Skepper JN, Valés-Gómez M, Reyburn HT. Natural killer cell cytotoxicity is suppressed by exposure to the human NKG2D ligand MICA*008 that is shed by tumor cells in exosomes. Cancer Res. 2010;70:481-489. [PubMed] [DOI] |
| 3. | Qu JL, Qu XJ, Qu JL, Qu XJ, Zhao MF, Teng YE, Zhang Y, Hou KZ, Jiang YH, Yang XH. The role of cbl family of ubiquitin ligases in gastric cancer exosome-induced apoptosis of Jurkat T cells. Acta Oncol. 2009;48:1173-1180. [DOI] |
| 4. | Théry C, Zitvogel L, Amigorena S. Exosomes: composition, biogenesis and function. Nat Rev Immunol. 2002;2:569-579. [PubMed] |
| 5. | Simpson RJ, Lim JW, Moritz RL, Mathivanan S. Exosomes: proteomic insights and diagnostic potential. Expert Rev Proteomics. 2009;6:267-283. [PubMed] [DOI] |
| 6. | 罗 治彬, 徐 采朴, 王 东, 王 阁, 肖 世全, 朱 高友, 房 殿春. 致敏树突细胞及其亚细胞成分对荷胃癌小鼠的免疫治疗作用研究. 世界华人消化杂志. 2004;12:9-12. [DOI] |
| 7. | Wolfers J, Lozier A, Raposo G, Regnault A, Théry C, Masurier C, Flament C, Pouzieux S, Faure F, Tursz T. Tumor-derived exosomes are a source of shared tumor rejection antigens for CTL cross-priming. Nat Med. 2001;7:297-303. [PubMed] [DOI] |
| 8. | Zeelenberg IS, Ostrowski M, Krumeich S, Bobrie A, Jancic C, Boissonnas A, Delcayre A, Le Pecq JB, Combadière B, Amigorena S. Targeting tumor antigens to secreted membrane vesicles in vivo induces efficient antitumor immune responses. Cancer Res. 2008;68:1228-1235. [PubMed] [DOI] |
| 9. | Taylor DD, Gerçel-Taylor C. Tumour-derived exosomes and their role in cancer-associated T-cell signalling defects. Br J Cancer. 2005;92:305-311. [PubMed] [DOI] |
| 10. | Clayton A, Mitchell JP, Court J, Mason MD, Tabi Z. Human tumor-derived exosomes selectively impair lymphocyte responses to interleukin-2. Cancer Res. 2007;67:7458-7466. [PubMed] [DOI] |
| 11. | Huber V, Fais S, Iero M, Lugini L, Canese P, Squarcina P, Zaccheddu A, Colone M, Arancia G, Gentile M. Human colorectal cancer cells induce T-cell death through release of proapoptotic microvesicles: role in immune escape. Gastroenterology. 2005;128:1796-1804. [PubMed] [DOI] |
| 12. | Abusamra AJ, Zhong Z, Zheng X, Li M, Ichim TE, Chin JL, Min WP. Tumor exosomes expressing Fas ligand mediate CD8+ T-cell apoptosis. Blood Cells Mol Dis. 2005;35:169-173. [PubMed] [DOI] |
| 13. | 张 丰, 李 楠. ERK/MAPK信号传导途径在乳腺肿瘤治疗中的意义. 中国肿瘤生物治疗杂志. 2007;14:497-500. |
| 14. | Maemura K, Shiraishi N, Sakagami K, Kawakami K, Inoue T, Murano M, Watanabe M, Otsuki Y. Proliferative effects of gamma-aminobutyric acid on the gastric cancer cell line are associated with extracellular signal-regulated kinase 1/2 activation. J Gastroenterol Hepatol. 2009;24:688-696. [PubMed] [DOI] |
| 15. | Zha Y, Gajewski TF. An adenoviral vector encoding dominant negative Cbl lowers the threshold for T cell activation in post-thymic T cells. Cell Immunol. 2007;247:95-102. [DOI] |