修回日期: 2010-05-05
接受日期: 2010-05-10
在线出版日期: 2010-06-28
目的: 探讨缺氧诱导因子-2α(hypoxia inducible factor-2α, HIF-2α)在胃癌组织中的表达及其临床意义.
方法: 采用免疫组织化学和逆转录聚合酶链反应检测36例胃癌及正常胃黏膜上皮组织中HIF-2α蛋白及mRNA的表达, 并分析其表达与胃癌临床病理特征的关系.
结果: HIF-2α蛋白在胃癌组织中的阳性表达率显著高于正常胃黏膜上皮(83.3% vs 8.3%, P<0.05), 并且其在胃癌组织中的阳性表达率随分化程度的降低而显著增高(P<0.05); 在有淋巴结转移组中HIF-2α蛋白的阳性表达率显著高于无淋巴结转移组(91.3% vs 69.2%, P<0.05). HIF-2α mRNA在胃癌组织中的阳性表达率及表达水平均显著高于正常胃黏膜上皮(77.8% vs 5.6%, 0.755±0.238 vs 0.581±0.147, 均P<0.05); HIF-2α mRNA的表达与胃癌患者的分化程度和淋巴结转移均存在明显相关性(均P<0.05).
结论: HIF-2α的表达可能与胃癌的发生发展有关, 并对判断胃癌患者的生物学行为具有一定的意义.
引文著录: 任月霞, 刘红涛, 李晟磊, 陈奎生, 张红燕. 缺氧诱导因子-2α在胃癌组织中的表达及临床意义. 世界华人消化杂志 2010; 18(18): 1923-1927
Revised: May 5, 2010
Accepted: May 10, 2010
Published online: June 28, 2010
AIM: To investigate the clinical significance of hypoxia-inducible factor-2α (HIF-2α) expression in gastric carcinoma.
METHODS: Immunohistochemistry and reverse transcription-polymerase chain reaction (RT-PCR) were used to detect HIF-2α protein and mRNA expression in 36 gastric carcinoma specimens and 36 normal gastric epithelial specimens. The relationship between HIF-2α expression and clinicopathologic parameters of gastric carcinoma was analyzed.
RESULTS: The positive rate of HIF-2α expression in gastric carcinoma was significantly higher than that in normal gastric epithelium (83.3% vs 8.30%, P < 0.05). The positive rate of HIF-2α expression in gastric carcinoma was correlated with tumor differentiation and lymph node metastasis (both P < 0.05). The positive rate and relative level of HIF-2α mRNA expression in gastric carcinoma were significantly higher than those in normal gastric epithelium (77.8% vs 5.6%, 0.755 ± 0.238 vs 0.581 ± 0.147, both P < 0.05). High expression of HIF-2α mRNA in gastric carcinoma was correlated with tumor differentiation and lymph node metastasis (both P < 0.05).
CONCLUSION: HIF-2α expression may be associated with the genesis and development of gastric carcinoma and can be used for judging tumor biological behavior.
- Citation: Ren YX, Liu HT, Li SL, Chen KS, Zhang HY. Clinical significance of hypoxia-inducible factor-2α expression in gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2010; 18(18): 1923-1927
- URL: https://www.wjgnet.com/1009-3079/full/v18/i18/1923.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i18.1923
缺氧诱导因子(hypoxia inducible factor, HIF)是缺氧条件下广泛存在于哺乳动物和人体乏氧细胞内的一种转录因子. HIF-2α是近年来发现的HIF-1α蛋白的同系物, 与HIF-1α 48%的氨基酸序列相同. 与HIF-1α相似, HIF-2α同样具有核转录活性, 两者具有相同的DNA识别位点, 现在认为, HIF-2α在肿瘤的形成、恶化等过程中同样发挥调控作用[1,2]. 本研究采用免疫组织化学染色和逆转录聚合酶链反应(reverse transcription-polymerase chain reaction, RT-PCR), 检测HIF-2α在正常胃黏膜上皮及胃癌组织中的表达, 并分析其表达与胃癌的分化程度、浸润深度及淋巴结转移的关系.
收集新乡医学院第一附属医院2006-01/ 2006-09胃癌新鲜手术切除标本36例, 其中男24例, 女12例; 年龄36-77(平均56.28±10.3)岁; 分化Ⅰ级10例, Ⅱ级11例, Ⅲ级15例; 浸润深度: T1-T2者(未侵及肌层)26例, T3-T4者(侵及肌层)10例; 有淋巴结转移者23例, 无淋巴结转移者13例. 标本离体0.5-1 h内, 冰上分离切缘正常黏膜和癌组织各2份, 一份置于-80 ℃冰箱中保存备用; 另一份用体积分数40 g/L多聚甲醛固定, 脱水, 石蜡包埋, 连续切片, 切片厚度3-5 μm, 用于免疫组织化学染色. 所有患者术前均未接受化疗、放疗及其他治疗. 兔抗人HIF-2α单克隆抗体购自北京博奥森生物技术有限公司公司, 免疫组织化学试剂盒、3, 3-二氨基联苯胺(digital audio broadcasting, DAB)显色剂购自北京中杉金桥生物技术有限公司. TRIzol试剂购自Sigma公司, 一步法RT-PCR试剂盒购自大连宝生物工程有限公司. 引物由北京赛百盛生物工程公司合成, 引物序列如下: HIF-2α上游5'-CCCTTCCTCCTGGACAAGTTTC-3', 下游5'-CCCTGAGGTTCTTCATCCGTTT-3'; GAPDH上游5'-GGAAGGTGAAGGTCGGAGTC-3', 下游5'-TGCTTGAGAAGAGGCTCATCC-3', 预期扩增片段大小分别为490 bp和315 bp.
1.2.1 HIF-2α的免疫组织化学染色: 采用链霉菌抗生物素蛋白-过氧化酶连接(streptavidin-perosidase, SP)法, 常规脱蜡, PBS清洗, 抗原修复, 体积分数3%过氧化氢清除内源性过氧化物酶活性, PBS清洗, 滴加正常山羊血清封闭, 加Ⅰ抗(即用型), 4 ℃冰箱过夜, PBS清洗, 加Ⅱ抗, PBS清洗, 加Ⅲ抗, PBS清洗, DAB显色. 苏木素复染, 梯度乙醇脱水, 二甲苯透明, 中性树胶封片. 用Novus Biologicals公司提供的切片作为阳性对照, PBS代替一抗作为阴性对照.
1.2.2 结果判定: HIF-2α阳性显色为棕黄色颗粒, 主要位于细胞核. 参照文献[3-5], 在高倍视野下(400×)随机选取5个视野(每个视野观察不少于200个细胞), 按阳性细胞所占的百分比及着色强度进行结果判定. 按着色强度评分, 0分: 无着色; 1分: 浅黄色; 2分: 黄色; 3分: 棕黄色. 按阳性细胞数占同类细胞数的百分比评分: 0分: 阴性; 1分: 阳性细胞数≤10%; 2分: 11%-50%; 3分: 51%-75%; 4分: >75%. 取2项评分的乘积作为总积分, 阴性(-): 0-3分; 阳性(+): 3分以上.
1.2.3 HIF-2α的RT-PCR检测: 每份冷冻标本取0.1 g剪碎, 加入1 mL预冷的TRIzol溶液裂解, 充分匀浆, 余步骤严格按TRIzol RNA提取试剂盒说明书进行, 所得的总RNA用分光光度计(北京中西化玻仪器有限公司, K13550)测定其浓度和纯度. RT-PCR反应条件: 50 ℃×30 min, 95 ℃×2 min, 95 ℃×30 s, 55 ℃×30 s, 72 ℃×1 min, 共35个循环; 72 ℃延伸10 min. 取5 μL用质量分数1.5%琼脂糖凝胶电泳, 出现阳性扩增条带者为表达阳性, 并在凝胶成像仪上成像及测定分析, 以目的基因与内参条带的吸光度比值作为目的基因的相对表达水平.
统计学处理 实验结果应用SPSS16.0统计分析软件进行分析, 计数资料采用χ2检验, 检验水准α = 0.05, 各组间相对表达水平的比较采用t检验.
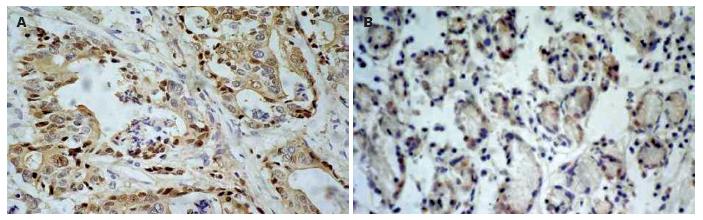
HIF-2α蛋白阳性显色为棕黄色颗粒, 主要定位于细胞核, 细胞质有少部分着色, 肿瘤组织中多呈强阳性表达(图1A), 正常黏膜上皮组织多不表达或表达程度较弱(图1B). 正常胃黏膜上皮中有3例阳性表达(8.3%), 胃癌组织中HIF-2α蛋白阳性表达30例(83.3%), 阳性表达率显著高于正常胃黏膜上皮(P<0.05). HIF-2α蛋白的表达随分化程度的降低而显著增高(P<0.05); 伴淋巴结转移者HIF-2α蛋白的阳性表达率为91.3%, 显著高于无淋巴结转移者(69.2%)(P<0.05), HIF-2α蛋白的表达与胃癌患者的浸润深度无明显关系(P>0.05, 表1).
| 病理学特征 | n | HIF-2α蛋白 | χ2值 | P值 | ||
| 阴性(n) | 阳性(n) | 百分率(%) | ||||
| 正常胃组织 | 36 | 33 | 3 | 8.3 | 40.783 | <0.05 |
| 胃癌 | 36 | 6 | 30 | 83.3 | ||
| 分化程度 | ||||||
| Ⅰ级 | 10 | 4 | 6 | 60.0 | ||
| Ⅱ级 | 11 | 2 | 9 | 81.8 | 6.938 | <0.05 |
| Ⅲ级 | 15 | 0 | 15 | 100.0 | ||
| 浸润深度 | ||||||
| T1 | 14 | 3 | 11 | 78.6 | ||
| T2 | 12 | 1 | 11 | 91.7 | 1.029 | >0.05 |
| T3 | 6 | 1 | 5 | 83.3 | ||
| T4 | 4 | 1 | 3 | 75.0 | ||
| 淋巴结转移 | ||||||
| 有 | 23 | 1 | 22 | 95.7 | 6.959 | <0.05 |
| 无 | 13 | 5 | 8 | 61.5 | ||
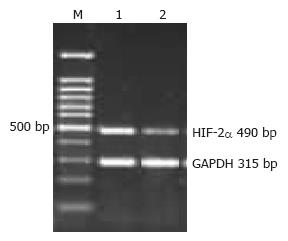
RNA浓度及纯度测定结果显示, 所得样品符合实验要求. RT-PCR结果显示, HIF-2α cDNA扩增片段大小为490 bp, 内参GAPDH片段大小为315 bp(图2). HIF-2α mRNA在胃癌组织中的阳性表达率(77.8%)及表达水平(0.755±0.238)均高于正常胃黏膜上皮(5.6%, 0.581±0.147)(P<0.05). HIF-2α mRNA的表达随分化程度的降低而显著增加(P<0.05), 有淋巴结转移组中的表达显著高于无淋巴结转移组(P<0.05). HIF-2α mRNA的表达与胃癌患者的浸润深度无关(P>0.05, 表2).
| 病理学特征 | n | HIF-2α mRNA | P值 | ||
| 阳性n(%) | P值 | 表达水平 | |||
| 正常胃组织 | 36 | 2(5.6) | <0.05 | 0.581±0.147 | <0.05 |
| 胃癌 | 36 | 28(77.8) | 0.755±0.238 | ||
| 分化程度 | |||||
| Ⅰ级 | 10 | 5(50.0) | <0.05 | 0.571±0.144 | <0.05 |
| Ⅱ级 | 11 | 9(81.8) | 0.788±0.004 | ||
| Ⅲ级 | 15 | 14(93.3) | 0.797±0.122 | ||
| 浸润深度 | |||||
| T1 | 14 | 11(78.6) | >0.05 | 0.663±0.092 | >0.05 |
| T2 | 12 | 10(83.3) | 0.791±0.134 | ||
| T3 | 6 | 5(83.3) | 0.731±0.322 | ||
| T4 | 4 | 2(50.0) | 0.699±0.120 | ||
| 淋巴结转移 | |||||
| 有 | 23 | 21(91.3) | <0.05 | 0.833±0.036 | <0.05 |
| 无 | 13 | 7(53.8) | 0.690±0.130 | ||
在实体瘤的恶性增殖过程中普遍存在缺血缺氧现象, 肿瘤细胞的缺氧适应主要由HIF介导, 肿瘤内缺氧可导致HIF过表达, 并涉及肿瘤细胞的代谢适应、凋亡抵抗、血管生成和侵袭、转移相关的基因表达[6-10], 其中研究较多的是HIF-1α, HIF-2α(或称为EPAS1、HRF、HLF、MOP2)是近年来发现的HIF-1α蛋白同系物, HIF-2α与HIF-1α在结构上极其相似, 也是由诱导表达的α亚单位和持续表达的β亚单位组成的异源二聚体结构. 两者的生物活性均由α亚基决定, 表达也严格地受细胞氧浓度的调节. 均在低氧条件下稳定和具有转录活性, 但二者功能并不完全一致. 目前对HIF-1α的研究比较多已经明确的HIF-1α调控的基因有70多个, 功能广泛. 相对于HIF-1α, 人们对HIF-2α功能的了解还比较少. 已有研究显示HIF-2α能激活含有乏氧反应元件(HRE)的基因, 参与红细胞生成素EPO, 血管生成因子VEGF、糖酵解酶等的转录激活. Zimmer等[11]应用RNA干扰的方法阻断HIF-2α表达, 结果显示VEGF的表达降低, 表明VEGF是HIF-2α的靶基因. 最近有研究表明HIF-1α和HIF-2α可能存在不同的转录调控功能和基因结合位点, HIF-1α表达随缺氧时间的延长呈进行性下降, 而HIF-2表达却呈进行性升高[12]. Krieg等[13]发现无论在常氧还是低氧条件下, HIF-2α较HIF-1α对VEGF mRNA具有更强的激活能力, 并且HIF-2α在转录激活VEGF mRNA的特异性上较HIF-1α更强. Raval等[1]认为HIF-2α对肿瘤生长起促进作用, 而HIF-1α对肿瘤生长起抑制作用.
近年来, 国内外许多学者检测了不同肿瘤组织中HIF-2α的表达情况, 发现结肠癌、乳腺癌、食管癌、肺癌、胰腺癌、前列腺癌及肾癌等多种肿瘤组织中HIF-2α呈阳性表达, 甚至在某些癌前病变中HIF-2α也有表达. 同时, 转移灶中多数出现过表达. 而在多种良性病变中无HIF-2α表达[13]. 本研究采用免疫组织化学和RT-PCR技术分别检测了36例胃癌患者手术切除标本中HIF-2α的表达, 结果显示HIF-2α蛋白在胃癌组织中的阳性表达率显著高于正常胃黏膜上皮, HIF-2α mRNA在胃癌组织中的阳性表达率和相对水平也均显著高于正常胃黏膜上皮. 另外作者还发现随肿瘤分化程度的降低, HIF-2α的表达也显著降低, 并且HIF-2α蛋白和mRNA的表达均与患者的淋巴结转移之间存在显著相关性. Turner等[14]研究表明HIF-2α在肾细胞癌标本中高表达; Mandriota等[15]不但发现在肾透明细胞癌中存在HIF-2α的高表达, 并且其表达的增加与进展期肿瘤损害程度有关. 上述结果均提示在缺氧微环境中, HIF-2α蛋白表达明显增高, 可能是由于肿瘤增长过快而造成局部缺氧, 使抑癌基因突变或癌基因激活, 从而导致一系列基因表达异常, 使肿瘤细胞耐受缺氧, 促进肿瘤生长、浸润和转移, 本课题组下一步拟建立人肿瘤细胞缺氧模型, 进一步研究在缺氧条件下HIF-2α的表达变化及其对下游基因的调节作用.
总之, HIF-2α广泛存在于动物及人体的多种肿瘤细胞中, 其活性对维持肿瘤细胞的能量代谢、肿瘤血管生成、促进肿瘤细胞增殖和转移起重要作用. 因此, 研究HIF-2α对研究肿瘤生长、浸润和转移以及治疗等方面都有重要意义. 作者采用免疫组织化学和RT-PCR技术联合检测了胃癌组织中HIF-2α蛋白和mRNA的表达, 初步证明了HIF-2α在胃癌的发生、发展中具有重要作用, 检测其表达对于判断胃癌患者的预后也具有一定的意义.
缺氧诱导因子(HIF)是缺氧条件下广泛存在于哺乳动物和人体乏氧细胞内的一种转录因子. HIF-2α是近年来发现的HIF-1α蛋白的同系物, 与HIF-1α 48%的氨基酸序列相同. 与HIF-1α相似, HIF-2α同样具有核转录活性, 两者具有相同的DNA识别位点, 现在认为, HIF-2α在肿瘤的形成、恶化等过程中同样发挥调控作用.
王邦茂, 教授, 天津医科大学总医院消化内科
目前对HIF-1α的研究比较多已经明确的HIF-1α调控的基因有70多个, 功能广泛. 相对于HIF-1α, 人们对HIF-2α功能的了解还比较少.
Zimmer等应用RNA干扰的方法阻断HIF-2α表达, 结果显示VEGF的表达降低, 表明VEGF是HIF-2α的靶基因. 最近有研究表明HIF-1α和HIF-2α可能存在不同的转录调控功能和基因结合位点, HIF-1α表达随缺氧时间的延长呈进行性下降, 而HIF-2表达却呈进行性升高.
本文发现HIF-2α的表达与胃癌患者的分化程度和淋巴结转移有关, 对判断胃癌患者的生物学行为具有一定的意义.
编辑 李军亮 电编 何基才
| 1. | Raval RR, Lau KW, Tran MG, Sowter HM, Mandriota SJ, Li JL, Pugh CW, Maxwell PH, Harris AL, Ratcliffe PJ. Contrasting properties of hypoxia-inducible factor 1 (HIF-1) and HIF-2 in von Hippel-Lindau-associated renal cell carcinoma. Mol Cell Biol. 2005;25:5675-5686. [PubMed] [DOI] |
| 2. | Artman T, Schilling D, Gnann J, Molls M, Multhoff G, Bayer C. Irradiation-induced regulation of plasminogen activator inhibitor type-1 and vascular endothelial growth factor in six human squamous cell carcinoma lines of the head and neck. Int J Radiat Oncol Biol Phys. 2010;76:574-582. [PubMed] [DOI] |
| 3. | 李 晟磊, 赵 秋民, 刘 宗文, 赵 志华, 高 冬玲, 郑 湘予, 陈 奎生, 张 云汉. 食管鳞癌中RECK和MMP-9蛋白表达的相关性及临床病理意义. 世界华人消化杂志. 2007;15:1082-1086. [DOI] |
| 4. | 李 晟磊, 刘 宗文, 赵 秋民, 于 金霞, 赵 志华, 高 冬玲, 庞 霞, 陈 奎生, 张 云汉. 食管鳞癌组织中RECK mRNA和蛋白的表达及意义. 中国肿瘤临床. 2007;34:1280-1286. |
| 5. | Li SL, Gao DL, Zhao ZH, Liu ZW, Zhao QM, Yu JX, Chen KS, Zhang YH. Correlation of matrix metalloproteinase suppressor genes RECK, VEGF, and CD105 with angiogenesis and biological behavior in esophageal squamous cell carcinoma. World J Gastroenterol. 2007;13:6076-6081. [PubMed] [DOI] |
| 7. | Morris MR, Hughes DJ, Tian YM, Ricketts CJ, Lau KW, Gentle D, Shuib S, Serrano-Fernandez P, Lubinski J, Wiesener MS. Mutation analysis of hypoxia-inducible factors HIF1A and HIF2A in renal cell carcinoma. Anticancer Res. 2009;29:4337-4343. [PubMed] |
| 8. | Franovic A, Holterman CE, Payette J, Lee S. Human cancers converge at the HIF-2alpha oncogenic axis. Proc Natl Acad Sci U S A. 2009;106:21306-21311. [PubMed] [DOI] |
| 9. | Petrella BL, Brinckerhoff CE. PTEN suppression of YY1 induces HIF-2 activity in von-Hippel-Lindau-null renal-cell carcinoma. Cancer Biol Ther. 2009;8:1389-1401. [PubMed] |
| 10. | Rasheed S, Harris AL, Tekkis PP, Turley H, Silver A, McDonald PJ, Talbot IC, Glynne-Jones R, Northover JM, Guenther T. Hypoxia-inducible factor-1alpha and -2alpha are expressed in most rectal cancers but only hypoxia-inducible factor-1alpha is associated with prognosis. Br J Cancer. 2009;100:1666-1673. [PubMed] [DOI] |
| 11. | Zimmer M, Doucette D, Siddiqui N, Iliopoulos O. Inhibition of hypoxia-inducible factor is sufficient for growth suppression of VHL-/- tumors. Mol Cancer Res. 2004;2:89-95. [PubMed] |
| 12. | Imamura T, Kikuchi H, Herraiz MT, Park DY, Mizukami Y, Mino-Kenduson M, Lynch MP, Rueda BR, Benita Y, Xavier RJ. HIF-1alpha and HIF-2alpha have divergent roles in colon cancer. Int J Cancer. 2009;124:763-771. [PubMed] [DOI] |
| 13. | Krieg M, Haas R, Brauch H, Acker T, Flamme I, Plate KH. Up-regulation of hypoxia-inducible factors HIF-1alpha and HIF-2alpha under normoxic conditions in renal carcinoma cells by von Hippel-Lindau tumor suppressor gene loss of function. Oncogene. 2000;19:5435-5443. [PubMed] [DOI] |
| 14. | Turner KJ, Moore JW, Jones A, Taylor CF, Cuthbert-Heavens D, Han C, Leek RD, Gatter KC, Maxwell PH, Ratcliffe PJ. Expression of hypoxia-inducible factors in human renal cancer: relationship to angiogenesis and to the von Hippel-Lindau gene mutation. Cancer Res. 2002;62:2957-2961. [PubMed] |
| 15. | Mandriota SJ, Turner KJ, Davies DR, Murray PG, Morgan NV, Sowter HM, Wykoff CC, Maher ER, Harris AL, Ratcliffe PJ. HIF activation identifies early lesions in VHL kidneys: evidence for site-specific tumor suppressor function in the nephron. Cancer Cell. 2002;1:459-468. [PubMed] [DOI] |