修回日期: 2010-05-05
接受日期: 2010-05-18
在线出版日期: 2010-06-28
目的: 探讨RhoC基因在食管鳞癌组织中的表达情况及其与食管鳞癌发生、发展的关系.
方法: 采用半定量RT-PCR和原位杂交方法检测62例食管鳞癌、31例癌旁不典型增生组织及62例正常食管黏膜组织中RhoC mRNA的相对表达量及细胞定位.
结果: 食管鳞癌组织中RhoC mRNA表达与癌的组织学分级、浸润深度及淋巴结转移密切相关(P<0.05); 在食管鳞癌癌变过程中, RT-PCR检测RhoC mRNA在癌组织、癌旁不典型增生组织及正常黏膜组织中的表达量依次降低, 分别为0.902±0.119、0.731±0.065、0.653±0.069, 组间比较有明显差异(H = 99.629, P<0.01); 原位杂交检测RhoC转录本主要位于细胞质中, 其在癌组织、癌旁不典型增生组织及正常黏膜组织中的表达率依次降低, 分别为80.6%(50/62)、32.3%(10/31)、21.0%(13/62), 组间比较有明显差异(χ2 = 47.735, P<0.01), 两种方法检测的RhoC mRNA表达具有一致性.
结论: RhoC mRNA在食管鳞癌组织中显著增加, 并与食管鳞癌生物学行为关系密切, 提示RhoC mRNA过表达与食管鳞癌的发生、发展有关, RhoC mRNA可作为食管鳞癌早期诊断和判断预后的辅助指标.
引文著录: 赵志华, 刘宇琼, 张蕾, 李晟磊, 高冬玲, 陈奎生. RhoC基因mRNA在食管鳞癌中的表达及其意义. 世界华人消化杂志 2010; 18(18): 1885-1889
Revised: May 5, 2010
Accepted: May 18, 2010
Published online: June 28, 2010
AIM: To investigate the expression of RhoC mRNA in esophageal squamous cell carcinoma (ESCC) and to explore its correlation with the development and progression of ESCC.
METHODS: Semi-quantitative RT-PCR was used to detect the relative expression levels of RhoC mRNA in 62 ESCC specimens, 31 tumor-adjacent atypical hyperplastic epithelial specimens and 62 normal esophageal epithelial specimens. The distribution of RhoC transcripts in ESCC was determined by in situ hybridization.
RESULTS: The mRNA expression of RhoC was closely correlated with tumor grade, infiltration and lymph node metastasis in ESCC (all P < 0.05). The expression intensity of RhoC mRNA in carcinoma, adjacent atypical hyperplasia epithelium and normal esophageal epithelium were 0.902 ± 0.119, 0. 731 ± 0.065 and 0.653 ± 0.069, respectively, with a significant difference among the three groups (P < 0.01). In situ hybridization analysis demonstrated that RhoC transcripts were detected in the cytoplasm of cells. The positive rates of RhoC mRNA expression in carcinoma, tumor-adjacent atypical hyperplasia epithelium and normal esophageal epithelium were 80.6% (50/62), 32.3% (10/31) and 21.0% (13/62), respectively, with a significant difference among the three groups (P < 0.01). RT-PCR results were consistent with those obtained by in situ hybridization.
CONCLUSION: The mRNA expression of RhoC in ESCC increases significantly and is closely correlated with tumor biological behavior, which suggests that RhoC overexpression is closed associated with the pathogenesis of ESCC. RhoC may be a new auxiliary parameter for early diagnosis and prognostic prediction for ESCC.
- Citation: Zhao ZH, Liu YQ, Zhang L, Li SL, Gao DL, Chen KS. Significance of RhoC mRNA expression in esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2010; 18(18): 1885-1889
- URL: https://www.wjgnet.com/1009-3079/full/v18/i18/1885.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i18.1885
Ras相似物(Rho, rashomologue)家族成员(RhoA、RhoB和RhoC)是一类与Ras同源的小鸟苷三磷酸(GTP)结合蛋白, 在细胞的信号传导通路中起重要作用, 在调节细胞骨架、细胞运动、细胞增殖、细胞凋亡、细胞转录、细胞转化及恶性肿瘤细胞的浸润和转移等方面发挥重要作用[1-8]. 关于RhoC与恶性肿瘤的关系目前已成为研究热点. 本研究采用RT-PCR、原位杂交技术联合检测了RhoC基因在62例食管鳞癌组织、31例癌旁不典型增生组织及62例正常食管黏膜组织的表达, 并探讨其阳性表达在食管鳞癌发生发展中的临床病理意义, 以期寻找食管鳞癌早期诊断和预后判断的指标.
62例食管癌手术切除标本取自河南省安阳市肿瘤医院, 全部病例经常规病理证实均为食管鳞状细胞癌, 术前均无化疗、放疗及免疫治疗史. 其中男36例, 女26例, 年龄38-75(平均60.6±9.5)岁. 组织学分级Ⅰ级15例, Ⅱ级25例, Ⅲ级22例; 伴淋巴结转移者20例, 无淋巴结转移者42例. 7例(浅层组)肿瘤浸润黏膜层、黏膜下层或浅肌层; 55例(深层组)肿瘤浸润深肌层或外膜层. 每例标本于离体0.5 h内分别在无坏死区癌灶、癌旁3 cm以内及远端正常黏膜取材. 将部分组织放在冻存管中置于-80 ℃冰箱中备用于RT-PCR的检测. 剩余组织经40 g/L甲醛固定, 常规脱水, 石蜡包埋切片, 分别用于HE、原位杂交染色. TRIzol试剂购自Qiagen公司, 一步法RT-PCR试剂盒购自日本TaKaRa公司. 原位杂交预杂交液购自武汉博士德生物技术有限公司. 乙酰化BSA及BCIP/NBT均购自美国Sigma公司. 原位杂交5'端生物素标记、全硫代修饰探针、RhoC探针、PCR引物和内参β-actin引物序列均由北京奥科生物技术有限公司合成. RhoC探针序列为: 5'-CGTTGGGGCAGAAGTGCTTCACCTC-3', RhoC上游引物序列5'-CATGTGCTTCTCCATCGACAG-3', 下游引物序列为5'-GGGATCTCAGAGAATGGGACA-3', 预期扩增片段大小为325 bp. 内参β-actin上游序列为5'-CATCCTGCGTCTGCACCT-3', 下游序列为5'-TCAGGAGGAGCAATGATCTTG-3', 预期扩增片段大小为480 bp.
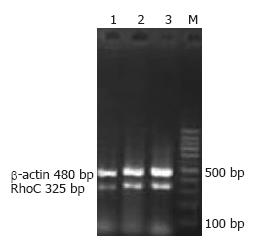
1.2.1 总RNA的提取及半定量RT-PCR反应: 具体步骤按照试剂盒说明进行, 提取的总RNA经紫外分光光度仪检测RNA的质量. 取0.5 μL RNA作为模板, 采用一步法RT-PCR试剂盒同管扩增RhoC目的基因及β-actin内参对照, 反应条件: 94 ℃预变性5 min, 然后94 ℃变性30 s 57 ℃下退火30 s, 72 ℃延伸40 s, 上述3步骤进行30个循环后, 再94 ℃继续延伸5 min. 扩增产物经1%琼脂糖凝胶电泳, 运用Gene genius凝胶成像系统进行分析, 以RhoC扩增条带的灰度值/β-actin条带灰度值作为目的基因mRNA的相对表达量.
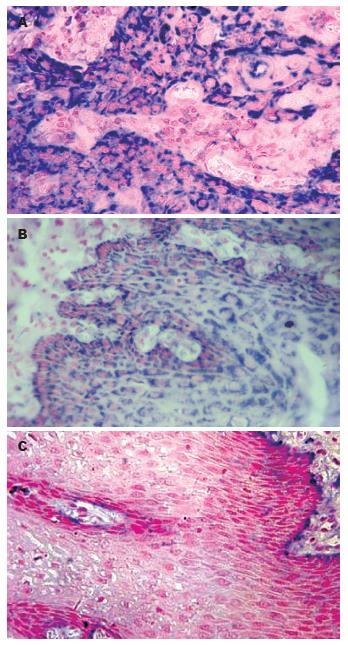
1.2.2 原位杂交: 原位杂交具体步骤参照文献[9-11], 以不含RhoC探针的标本作阴性对照, 已知的阳性的乳腺癌组织切片为阳性对照. RhoC mRNA阳性信号呈紫蓝色颗粒, 位于细胞质内. 高倍镜下随机选取5个视野(每个视野观察细胞数不少于200个), 按阳性细胞所占百分比及着色深浅进行结果判定[9-11]. (1)按切片中细胞着色深浅评分: 0分, 细胞无显色; 1分, 浅黄色; 2分, 棕黄色; 3分, 棕褐色. (2)按阳性细胞数占同类细胞数的百分比, <30%为1分, 30%-70%为2分, >70%为3分. 取(1), (2)两项评分的乘积作为总积分, 0-1分为阴性(-), 2-3分为弱阳性(+), ≥4分为阳性(++).
统计学处理 应用SPSS13.0统计学软件, 采用χ2检验或秩和检验. 检验水准α = 0.05.
RhoC mRNA RT-PCR扩增产物经凝胶电泳显示, 与预计一致, 其片段大小为325 bp, 内参β-actin片段大小为480 bp. 凝胶灰度扫描扩增结果, 对RhoC mRNA的阳性表达进行相对定量, RhoC在正常食管黏膜组织、癌旁不典型增生组织及癌组织中mRNA的含量依次增高, 分别为0.767±0.057, 0.731±0.065、0.902±0.119, 经秩和检验, 组间比较差异有统计学意义(H = 99.629, P<0.05, 表1, 图1). 由表2可知RhoC mRNA的高表达量与食管鳞癌的组织学分级、浸润深度及淋巴结转移密切相关(均P<0.05), 而与患者的性别、年龄无关(P>0.05).
| 分组 | n | RhoC mRNA | ||||
| RT-PCR阳性表达量 | H值 | 原位杂交阳性率(%) | χ2值 | P值 | ||
| 正常黏膜组织 | 62 | 0.767±0.057 | 21.0 | |||
| 癌旁组织 | 31 | 0.731±0.065 | 99.629 | 32.3 | 47.735 | <0.05 |
| 癌组织 | 62 | 0.902±0.119 | 80.6 | |||
| 病理学参数 | n | RT-PCR RhoC mRNA阳性表达量 | t(H) | P值 | 原位杂交RhoC mRNA阳性率 | χ2值 | P值 |
| 性别 | |||||||
| 男 | 36 | 0.922±0.123 | t = 1.586 | 0.118 | 80.6 | 0.000 | 0.983 |
| 女 | 26 | 0.874±0.109 | 80.8 | ||||
| 年龄(岁) | |||||||
| ≥60 | 33 | 0.911±0.108 | t = 0.619 | 0.538 | 81.8 | 0.062 | 0.803 |
| <60 | 29 | 0.892±0.132 | 79.3 | ||||
| 组织学分级 | |||||||
| Ⅰ | 15 | 0.795±0.056 | 53.3 | ||||
| Ⅱ | 25 | 0.898±0.086 | H = 22.535 | 0.000 | 88.0 | 9.520 | 0.009 |
| Ⅲ | 22 | 0.979±0.128 | 90.9 | ||||
| 浸润深度 | |||||||
| 浅层组 | 7 | 0.751±0.036 | 42.9 | ||||
| 深层组 | 55 | 0.924±0.111 | t = 8.716 | 0.000 | 85.5 | 7.219 | 0.007 |
| 淋巴结转移 | |||||||
| 无 | 42 | 0.840±0.074 | t = 9.042 | 0.000 | 73.8 | 3.898 | 0.048 |
| 有 | 20 | 1.032±0.086 | 95.0 |
原位杂交方法检测结果表明: RhoC mRNA阳性表达主要位于癌细胞的胞质内, 呈紫蓝色颗粒. 在食管鳞癌组织、癌旁不典型增生组织和正常食管黏膜组织中, RhoC mRNA阳性表达率为80.6%, 61.3%, 20.0%. 三组间RhoC mRNA表达的比较, 差异有统计学意义(P<0.05, 表1, 图2). 由表2可知RhoC mRNA的养性表达与食管鳞癌的组织学分级、浸润深度及淋巴结转移密切相关(均P<0.05), 而与患者的性别、年龄无关(P>0.05).
RhoC基因定位于1p13-p21, 基因全长6 768 bp, 包括6个外显子和5个内显子; RhoC基因编码产物含193个氨基酸, 是相对分子质量大约为21×103 Da的GTP结合蛋白, 具有GTP酶活性, 能结合并水解鸟苷酸, 使其在活性GTP结合型与失活性GDP结合型之间循环, 从而在细胞信号转导通路中作为信号转换器或分子开关, 作用于细胞骨架或其靶蛋白而产生多种生物学效应[12-16].
RhoC最重要的功能是通过调节肌动蛋白细胞骨架、诱导肌动蛋白、整合素及相关蛋白如纤维连接蛋白(fibronectin, FN)聚集等途径参与调节细胞运动和迁移[17-21]. 肌动蛋白细胞骨架不仅在细胞形状改变、细胞运动和吞噬作用中起重要作用, 还在细胞的各种生命活动如增殖、生长和凋亡中起关键作用[22-27].
研究表明RhoC的过表达与多种恶性肿瘤的发生发展有关, 而有关RhoC基因与人食管鳞癌的发生及其侵袭和转移的关系报道较少. 采用RT-PCR技术检测食管组织中RhoC mRNA的相对表达量, 并采用原位杂交技术检测RhoC转录本细胞定位的研究, 迄今尚未见文献报道. 本研究结果显示RhoC转录本主要在癌细胞胞质中呈阳性表达, 在食管正常黏膜、癌旁不典型增生及食管鳞癌组织中, RhoC mRNA的阳性表达率及相对含量依次升高(P<0.05), 上述结果提示, RhoC高表达可能参与食管黏膜上皮细胞的恶性转化过程, 这可能在食管癌的发生、发展过程中起重要作用. RhoC mRNA的表达及相对含量随癌组织浸润深度的加深而明显升高(P<0.05), 在有淋巴结转移的癌组织中明显高于无淋巴结转移癌组织(P<0.05), 此结果提示RhoC的异常表达可能与食管鳞癌的浸润及淋巴结转移密切相关, 与Faried等[28]研究结果基本一致. 本研究结果还显示, RhoC mRNA表达及相对含量随食管鳞癌分化程度的降低而明显下降(P<0.05), 提示RhoC基因在诱导肿瘤细胞分化过程中起重要作用, 其过表达可能与食管鳞癌的组织学分级、恶性程度有关. 张惠忠等[29]报道RhoC蛋白的表达与食管癌的分化程度无关(P>0.05), 出现这种差异的原因可能与标本的来源、数量及研究方法的不同或RhoC mRNA翻译后修饰有关. Clark等[30]利用DNA芯片研究黑色素瘤的侵袭转移表型时发现高转移性黑色素瘤RhoC的表达明显高于低转移性黑色素瘤, 且RhoC转染低转移能力的黑色素瘤细胞A375P后肿瘤细胞的运动和浸润能力增强, 提示RhoC基因及其表达产物在肿瘤转移过程中有非常重要的作用, 可能是肿瘤转移的分子开关, 该研究首次明确并证实了RhoC在肿瘤细胞转移过程中的作用. Ikoma等[31]研究发现RhoC过表达能导致基质金属蛋白酶2(matrixmetalloproteinases 2, MMP-2)、基质金属蛋白酶9(matrixmetalloproteinases 9, MMP-9)、2型金属蛋白抑制物组织(tissue inhibitor metalloproteinases, TIMP-2)等的mRNA表达显著升高. RhoC不仅能明显上调MMPs的表达, 同时也能增加MMPs的活性, 从而导致肿瘤侵袭性增强. 本研究进一步证实了以上观点.
总之, RhoC基因的高表达与食管鳞癌的发生、浸润转移有关, RhoC有望成为食管鳞癌预后判断的辅助指标.
Ras相似物(Rho, rashomologue)家族成员(RhoA、RhoB和RhoC)是一类与Ras同源的小鸟苷三磷酸(GTP)结合蛋白, 在细胞的信号传导通路中起重要作用, 在调节细胞骨架、细胞运动、细胞增殖、细胞凋亡、细胞转录、细胞转化及恶性肿瘤细胞的浸润和转移等方面发挥重要作用.
王娅兰, 教授, 重庆医科大学基础医学院病理教研室
关于RhoC与恶性肿瘤的关系目前已成为研究热点.
近年来的研究表明, RhoC基因的高表达在恶性肿瘤的浸润转移过程中起重要作用. 先后有文献报道, RhoC高表达或活性升高与乳腺癌、黑色素瘤、胰腺癌、结肠癌、膀胱癌、非小细胞肺癌和胃癌等多种肿瘤的侵袭转移密切相关.
采用RT-PCR技术检测食管组织中RhoC mRNA的相对表达量, 并采用原位杂交技术检测RhoC转录本细胞定位的研究, 迄今尚未见文献报道.
文章对RhoC基因 mRNA在食管鳞癌中的表达进行了检测和分析, 有一定意义.
编辑 曹丽鸥 电编 何基才
| 1. | Nakashima M, Adachi S, Yasuda I, Yamauchi T, Kozawa O, Moriwaki H. Rho-kinase regulates negatively the epidermal growth factor-stimulated colon cancer cell proliferation. Int J Oncol. 2010;36:585-592. [PubMed] |
| 2. | Schaeffer DF, Assi K, Chan K, Buczkowski AK, Chung SW, Scudamore CH, Weiss A, Salh B, Owen DA. Tumor expression of integrin-linked kinase (ILK) correlates with the expression of the E-cadherin repressor snail: an immunohistochemical study in ductal pancreatic adenocarcinoma. Virchows Arch. 2010;456:261-268. [PubMed] [DOI] |
| 3. | Zhao Y, Zong ZH, Xu HM. RhoC expression level is correlated with the clinicopathological characteristics of ovarian cancer and the expression levels of ROCK-I, VEGF, and MMP9. Gynecol Oncol. 2010;116:563-571. [PubMed] [DOI] |
| 4. | Cho HJ, Baek KE, Yoo J. RhoGDI2 as a therapeutic target in cancer. Expert Opin Ther Targets. 2010;14:67-75. [PubMed] [DOI] |
| 5. | Mulloy JC, Cancelas JA, Filippi MD, Kalfa TA, Guo F, Zheng Y. Rho GTPases in hematopoiesis and hemopathies. Blood. 2010;115:936-947. [PubMed] [DOI] |
| 6. | Zárský V, Potocký M. Recycling domains in plant cell morphogenesis: small GTPase effectors, plasma membrane signalling and the exocyst. Biochem Soc Trans. 2010;38:723-728. [PubMed] [DOI] |
| 7. | Zhao L, Wang H, Li J, Liu Y, Ding Y. Overexpression of Rho GDP-dissociation inhibitor alpha is associated with tumor progression and poor prognosis of colorectal cancer. J Proteome Res. 2008;7:3994-4003. [PubMed] [DOI] |
| 8. | Overmoyer BA. Inflammatory breast cancer: novel preoperative therapies. Clin Breast Cancer. 2010;10:27-32. [PubMed] [DOI] |
| 10. | 高 冬玲, 李 晟磊, 陈 奎生, 赵 志华, 赵 秋民, 刘 宗文, 张 云汉. 金属蛋白酶抑制基因RECK在食管鳞癌中的表达及生物学意义. 世界华人消化杂志. 2008;16:1634-1638. [DOI] |
| 11. | Li SL, Gao DL, Zhao ZH, Liu ZW, Zhao QM, Yu JX, Chen KS, Zhang YH. Correlation of matrix metalloproteinase suppressor genes RECK, VEGF, and CD105 with angiogenesis and biological behavior in esophageal squamous cell carcinoma. World J Gastroenterol. 2007;13:6076-6081. [PubMed] [DOI] |
| 12. | Wheeler AP, Ridley AJ. Why three Rho proteins? RhoA, RhoB, RhoC, and cell motility. Exp Cell Res. 2004;301:43-49. [PubMed] [DOI] |
| 13. | Fukata M, Nakagawa M, Kaibuchi K. Roles of Rho-family GTPases in cell polarisation and directional migration. Curr Opin Cell Biol. 2003;15:590-597. [PubMed] [DOI] |
| 14. | van Golen KL, Wu ZF, Qiao XT, Bao LW, Merajver SD. RhoC GTPase, a novel transforming oncogene for human mammary epithelial cells that partially recapitulates the inflammatory breast cancer phenotype. Cancer Res. 2000;60:5832-5838. [PubMed] |
| 15. | van Golen KL, Wu ZF, Qiao XT, Bao L, Merajver SD. RhoC GTPase overexpression modulates induction of angiogenic factors in breast cells. Neoplasia. 2000;2:418-425. [PubMed] [DOI] |
| 16. | Boone B, Brochez L. Clinical markers and driving mechanisms in melanoma progression: VEGF-C, RhoC, c-Ski/SnoN and EGFR. Verh K Acad Geneeskd Belg. 2009;71:251-294. [PubMed] |
| 17. | Sousa JF, Espreafico EM. Suppression subtractive hybridization profiles of radial growth phase and metastatic melanoma cell lines reveal novel potential targets. BMC Cancer. 2008;8:19. [PubMed] [DOI] |
| 18. | Wang W, Wu F, Fang F, Tao Y, Yang L. Inhibition of invasion and metastasis of hepatocellular carcinoma cells via targeting RhoC in vitro and in vivo. Clin Cancer Res. 2008;14:6804-6812. [PubMed] [DOI] |
| 19. | Wang W, Yang LY, Huang GW, Lu WQ, Yang ZL, Yang JQ, Liu HL. Genomic analysis reveals RhoC as a potential marker in hepatocellular carcinoma with poor prognosis. Br J Cancer. 2004;90:2349-2355. [PubMed] |
| 20. | Wang W, Yang LY, Yang ZL, Huang GW, Lu WQ. Expression and significance of RhoC gene in hepatocellular carcinoma. World J Gastroenterol. 2003;9:1950-1953. [PubMed] |
| 21. | Aspenström P. Effectors for the Rho GTPases. Curr Opin Cell Biol. 1999;11:95-102. [PubMed] [DOI] |
| 22. | Nitz MD, Harding MA, Theodorescu D. Invasion and metastasis models for studying RhoGDI2 in bladder cancer. Methods Enzymol. 2008;439:219-233. [PubMed] [DOI] |
| 23. | Morris SW, Valentine MB, Kirstein MN, Huebner K. Reassignment of the human ARH9 RAS-related gene to chromosome 1p13-p21. Genomics. 1993;15:677-679. [PubMed] [DOI] |
| 24. | Dutt P, Nguyen N, Toksoz D. Role of Lbc RhoGEF in Galpha12/13-induced signals to Rho GTPase. Cell Signal. 2004;16:201-209. [PubMed] [DOI] |
| 25. | Iwaki N, Karatsu K, Miyamoto M. Role of guanine nucleotide exchange factors for Rho family GTPases in the regulation of cell morphology and actin cytoskeleton in fission yeast. Biochem Biophys Res Commun. 2003;312:414-420. [PubMed] [DOI] |
| 26. | Durkin ME, Avner MR, Huh CG, Yuan BZ, Thorgeirsson SS, Popescu NC. DLC-1, a Rho GTPase-activating protein with tumor suppressor function, is essential for embryonic development. FEBS Lett. 2005;579:1191-1196. [PubMed] [DOI] |
| 27. | Heasman SJ, Ridley AJ. Mammalian Rho GTPases: new insights into their functions from in vivo studies. Nat Rev Mol Cell Biol. 2008;9:690-701. [PubMed] [DOI] |
| 28. | Faried A, Faried LS, Usman N, Kato H, Kuwano H. Clinical and prognostic significance of RhoA and RhoC gene expression in esophageal squamous cell carcinoma. Ann Surg Oncol. 2007;14:3593-3601. [PubMed] [DOI] |
| 30. | Clark EA, Golub TR, Lander ES, Hynes RO. Genomic analysis of metastasis reveals an essential role for RhoC. Nature. 2000;406:532-535. [PubMed] [DOI] |
| 31. | Ikoma T, Takahashi T, Nagano S, Li YM, Ohno Y, Ando K, Fujiwara T, Fujiwara H, Kosai K. A definitive role of RhoC in metastasis of orthotopic lung cancer in mice. Clin Cancer Res. 2004;10:1192-1200. [PubMed] [DOI] |