修回日期: 2010-05-04
接受日期: 2010-05-10
在线出版日期: 2010-06-28
目的: 研究相同剂量表没食子儿茶素没食子酸酯(EGCG)联合不同剂量放疗对HepG2中hTERT基因表达的影响, 探讨EGCG成为放疗增敏剂的作用.
方法: 用MTT比色法检测EGCG对HepG2细胞增殖的影响, 用荧光显微镜检测EGCG诱导HepG2的细胞凋亡, 从而找到合适的EGCG(25 μmol/L)剂量用于观察其放射效果的实验; 采用实时荧光定量PCR检测不同剂量放疗(0、2、4、6 Gy)联合EGCG和不联合EGCG治疗后, HepG2中hTERT基因的表达. 放疗用直线加速器6MVX线.
结果: EGCG具有抑制HepG2细胞增殖并诱导HepG2细胞凋亡的作用. 同时, 不同剂量放疗联合EGCG和不联合EGCG治疗后HepG2中hTERT基因的表达比较, 空白组无显著差异; 2 Gy组、4 Gy组、6 Gy组均有显著差异(hTERT基因表达的扩增倍数: 0.477±0.025 vs 0.973±0.024; 1.110±0.083 vs 1.382±0.051; 1.174±0.128 vs 1.452±0.109, P<0.01或0.05), 并以2 Gy组最为显著.
结论: EGCG具有抑制HepG2细胞增殖并诱导其凋亡的作用; EGCG联合不同剂量放疗可能下调HepG2中hTERT基因水平, 从而抑制端粒酶活性, 以放射剂量为2 Gy时显著, 因此, EGCG有可能成为放疗增敏剂.
引文著录: 刘礼, 谢纪文, 王熙, 谢烨明. EGCG联合不同剂量放疗对人肝癌细胞系HepG2中hTERT表达的影响. 世界华人消化杂志 2010; 18(18): 1873-1878
Revised: May 4, 2010
Accepted: May 10, 2010
Published online: June 28, 2010
AIM: To study the effect of (-)-epigallocatechin-3-gallate (EGCG) in combination with radiotherapy (different doses) on the expression of hTERT in HepG2 cells and to explore the possibility of using EGCG as a radiation sensitizer.
METHODS: To find an optimal EGCG dose used in subsequent experiments, the effect of different concentrations of EGCG on the proliferation and apoptosis of HepG2 cells was detected by MTT assay and fluorescence microscopy. After HepG2 cells were treated with EGCG (25 μmol/L) in combination with different doses of radiotherapy (2, 4 and 6 Gy, respectively), the expression of hTERT in HepG2 cells was detected by real-time fluorescent quantitative PCR.
RESULTS: EGCG could inhibit proliferation and induce apoptosis in HepG2 cells. Treatment of HepG2 cells with EGCG in combination with different doses of radiotherapy (2, 4 and 6 Gy, respectively) significantly down-regulated hTERT expression when compared with those treated with EGCG alone (0.477 ± 0.025 vs 0.973 ± 0.024, 1.110 ± 0.083 vs 1.382 ± 0.051, 1.174 ± 0.128 vs 1.452 ± 0.109; all P < 0.01 or 0.05), particularly prominent in cells undergoing radiotherapy at a dose of 2 GY.
CONCLUSION: EGCG can inhibit proliferation and induce apoptosis in HepG2 cells. EGCG in combination with different doses of radiotherapy can down-regulate hTERT expression in HepG2 cells and thus inhibit telomerase activity. EGCG may be a potential radiation sensitizer.
- Citation: Liu L, Xie JW, Wang X, Xie YM. EGCG in combination with radiotherapy down-regulates hTERT expression in HepG2 cells. Shijie Huaren Xiaohua Zazhi 2010; 18(18): 1873-1878
- URL: https://www.wjgnet.com/1009-3079/full/v18/i18/1873.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i18.1873
肝癌是我国常见的恶性肿瘤之一. 近年来肝癌的临床放疗取得一些进展, 如何提高肝癌放疗的效果, 是提高整体原发性肝癌治愈率和生存质量的关键. 在肝癌治疗中, 如能耐受较大剂量放疗, 其疗效较好, 但对正常组织有较大损伤. 如果有一种放射增敏剂能使小剂量的肝癌放疗达到大剂量的疗效, 将有利于肝癌的放疗. 本次研究观察了相同剂量表没食子儿茶素没食子酸酯(epigallocatechin gallate, EGCG)联合不同剂量放疗对人肝癌细胞株HepG2中人端粒酶逆转录酶(human telomerase reverse transcriptase, hTERT)基因表达的影响, 探讨EGCG成为放疗增敏剂的作用.
HepG2细胞株由武汉协和医院介入科提供; EGCG纯度>95%: 美国Sigma公司产品, 以无血清1640培养液稀释成浓度为0.01 mol/L的储存液保存于-80 ℃冰箱中备用, 使用前以无血清1640培养液配制成实验中所需浓度; MTT、DMSO: 武汉生命技术有限公司产品; 胎牛血清为杭州四季青生物工程公司产品; Annexin V-FITC细胞凋亡检测试剂盒为南京凯基生物科技发展有限公司产品; TRIzol为美国Invitrogen公司产品; ReverTra Ace-α-逆转录试剂盒为日本ToYoBo产品; SYBR Green realtime PCR master mix-plus-试剂盒为日本ToYoBo产品.
1.2.1 细胞培养: HepG2细胞培养于含100 mL/L胎牛血清RPMI 1640培养液, 37 ℃、50 mL/L CO2温箱中培养, 每3-4 d传代1次.
1.2.2 MTT比色法检测EGCG对HepG2细胞增殖的影响: 设对照组和加用EGCG组(10、25、50、100、200 μmol/L EGCG), 取对数生长期细胞, 常规胰酶消化后用含100 mL/L胎牛血清RPMI 1640培养液制成单细胞悬液, 接种于96孔培养版, 每孔200 μL(含103-105个细胞). 培养4 h后去培养液并加药, 每组设6个复孔, 另设一个调零孔(不加细胞, 只加100 μL: 无血清培养液), 继续培养24 h. 然后每孔加入MTT 20 μL(5 g/L PBS), 4 h后即终止培养, 弃上清液, 每孔加入200 μL DMSO, 震荡均匀, 置于酶联免疫检测仪用490 nm波长测量吸光度(A)值.
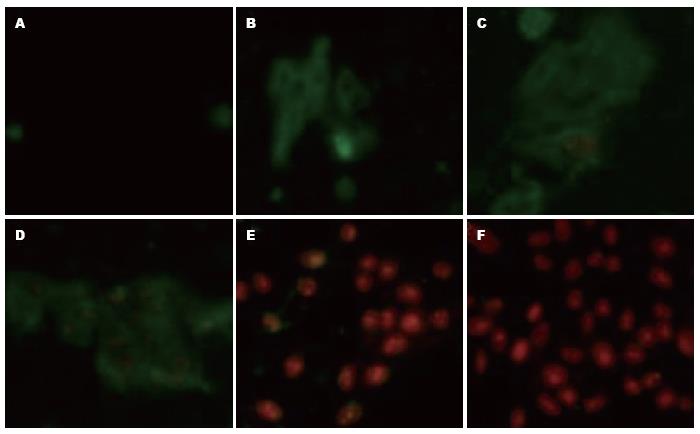
1.2.3 荧光显微镜检测EGCG诱导HepG2细胞凋亡: 取对数生长期细胞, 常规胰酶消化后用含100 mL/L胎牛血清RPMI 1640培养液制成单细胞悬液, 计数后种于含有盖玻片的六孔板内, 每孔含106-108个细胞, 再每孔加入2 mL含血清培养液. 培养24 h后去培养液并加药, 分别加入2 mL含有0、10、25、50、100、200 μmol/L EGCG的培养液. 培养24 h后, 用PBS洗涤盖玻片上的细胞两次; 在500 μL的Binding Buffer中加入5 μL Annexin V-FITC和5 μL Propidum Iodide, 混匀; 将上述溶液滴加在盖玻片表面, 使长有细胞的盖玻片表面均匀覆盖; 避光, 室温反应5 min; 将盖玻片倒置于载玻片上, 于荧光显微镜下, 双色滤光片观察, Annexin V-FITC荧光信号呈绿色, PI荧光信号呈红色.
1.2.4 检测端粒酶逆转录酶的细胞分组和放射: 取培养瓶中对数生长期细胞, 分为无EGCG组(加入4 mL无血清培养液)和EGCG组(加入4 mL含25 μmol/L EGCG培养液), 根据MTT和荧光显微镜检测, 选用25 μmol/L EGCG, 用直线加速器6MVX线进行放疗, 剂量分别用0、2、4、6 Gy共8组. 加药并照射后, 在37 ℃、50 mL/L CO2温箱中培养中培养24 h, 开始进行实时荧光定量PCR检测.
1.2.5 实时荧光定量PCR端粒酶逆转录酶定量检测: (1)引物序列: 种属为人, H-actin-S: GTTGCGTTACACCCTTTCTTG; H-actin-A:CTGCTGTCACCTTCACCGTT; H-tert-S: CCAGATTCGCCATTGTTCAC; H-tert-A: GGTCACTCCAAATTCCCAGAG. (2)实时荧光定量PCR检测: 在上述8组细胞中加TRIzol 1 mL后吹打、混匀、按照TRIzol试剂说明书步骤提取总RNA, 再将总RNA溶于无Rnase酶水中, 用紫外分光光度仪测定RNA浓度和纯度; 按照ReverTra Ace-α-逆转录试剂盒说明书配20 μL反应体系, 反应条件为42 ℃ 20 min, 99 ℃ 5 min, 4 ℃ 5 min; 然后按照SYBR Green realtime PCR master mix-plus-试剂盒说明书配25 μL反应体系, 反应条件为95 ℃ 1 min, 95 ℃ 15 s, 退火温度actin 59 ℃、TLMA 57 ℃ 15 s, 72 ℃ 45 s, 共40个循环. 在实时荧光定量PCR仪上进行检测.
统计学处理 数据mean±SD表示, 采用SPSS13.0软件包. 采用线性回归分析, 计算EGCG的剂量和HepG2细胞生长抑制率之间有无线性关系; 采用t检验, 比较同一放射剂量组中, 联合和不联合EGCG治疗有无差别; 采用单因素方差分析SNK方法, 将不同放射剂量组中, 联合和不联合EGCG治疗的差值进行比较, 以P<0.05为差异有统计学意义.
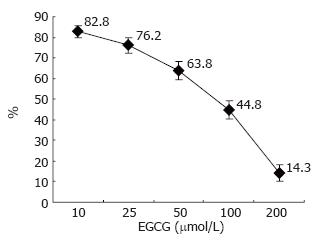
按下列公式计算抑制率: 生长抑制率(IR%) = (1-加药组平均A值/对照组平均A值)×100%. 经计算后, 对照组、10、25、50、100、200 μmol/L EGCG作用HepG2细胞24 h后, 其抑制率分别为0%、17.2%±2.9%、23.8%±3.8%、36.2%±4.6%、55.2%±4.5%、85.7%±3.9%. 采用线性回归分析, 计算EGCG的剂量和HepG2细胞生长抑制率之间有无线性关系, 结果表明, 相关系数R2 = 0.9558, P<0.05. 因此, EGCG抑制HepG2细胞生长, 呈浓度依赖关系. 细胞存活率% = 1-生长抑制率%(图1).
Annexin V-FITC荧光信号呈绿色, PI荧光信号呈红色. 因此, 细胞染色呈单纯的绿色表明为早期凋亡, 绿色和红色兼有表明为晚期凋亡, 呈单纯的红色为死亡. 予10 µmol/L EGCG时, 细胞多呈早期凋亡; 予25 µmol/L EGCG细胞以早期凋亡为主兼有晚期凋亡; 予50 µmol/L EGCG时, 细胞多呈晚期凋亡; 予100 µmol/L EGCG时, 细胞既有晚期凋亡也有死亡; 予200 µmol/L EGCG时, 细胞大部分死亡. EGCG诱导HepG2细胞的凋亡也呈浓度依赖关系(图2).
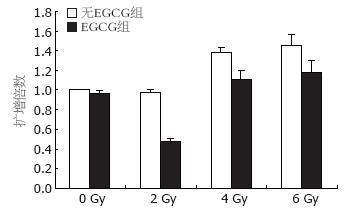
实时连续测定基因扩增过程中产生的荧光, 以Ct值作为计算依据. hTERT基因表达的Ct值 = 实际测得的hTERT基因表达的Ct值-actin的Ct值, Ct值越大hTERT活性越低. 基因表达水平以倍数变化即2x来表示, x为以对照空白组(即未予放射也未加EGCG)Ct值平均数减去其余各组Ct值平均数差值, 对照空白组的倍数为1. 端粒酶的活性与hTERT基因表达的扩增倍数呈正相关(表1, 图3). 采用t检验, 比较同一放射剂量组中, 联合和不联合EGCG治疗的差别. 结果发现, 0 Gy组P>0.05; 2 Gy组P<0.01; 4 Gy组P<0.05; 6 Gy组P<0.05. 由此可见, 单用25 μmol/L EGCG对HepG2中的hTERT基因并无显著影响, 而经2、4、6 Gy放射治疗后HepG2中的hTERT基因均有下调作用. 采用单因素方差分析SNK方法, 将不同放射剂量组中, 联合和不联合EGCG治疗的差值进行比较. 结果发现, 0 Gy组与2、4、6 Gy组均有显著性差异(P<0.05); 2 Gy组与4 Gy组的差异有显著性意义(P<0.05), 2 Gy组与6 Gy组的差异有显著性意义(P<0.05); 4 Gy组与6 Gy组的差异无显著性意义(P<0.05). 提示, 2 Gy组的差异可能更为显著.
| 分组 | 放疗的剂量 | |||
| 0 Gy | 2 Gy | 4 Gy | 6 Gy | |
| 无EGCG组 | 1 | 0.973±0.024 | 1.382±0.051 | 1.452±0.109 |
| EGCG组 | 0.962±0.028 | 0.477±0.025 | 1.110±0.083 | 1.174±0.128 |
hTERT是端粒酶的催化亚单位和限速酶, 对端粒酶活性的维持起关键作用, 对细胞凋亡也发挥着重要的作用[1-3]. 近年来, 大量文献报道了对肝癌治疗大的重要分子靶点端粒酶以及亚单位的研究[4-7]. 端粒酶是对细胞的增殖、衰老、恶变和永生化起着重要作用[8]. 端粒酶和肝癌有关系密切, 在肝癌中端粒酶的阳性率约为85%-100%[9,10]. 同时, 端粒是放射损伤的敏感部位, 在一定剂量范围内, 射线可以诱导端粒酶活性增高[11]. 当端粒酶活性下降和端粒缩短时, 能显著地增加肿瘤细胞对化疗和放疗的敏感性[12]. 同时, hTERT合成增多可能是射线诱导端粒酶活性的重要机制[13]. Ogawa等的研究表明端粒酶活性与肿瘤的放射敏感性负相关[14].
EGCG是绿茶多酚的一种主要成分[15,16], 具有抗肿瘤[17-19]、抗氧化[20,21]、抗血小板聚集[22]、保护正常组织[23,24]及防止紫外线损伤[25,26]等作用. 他还能对缺氧诱导的肝癌细胞株HepG2细胞HIF-1α及VEGF基因表达产生明显下调作用[27], 同时, 具有一定的调节端粒酶活性的作用[28-30]. Yokoyama等的研究表明, 在HeLa细胞和TMCC-1细胞中, 用EGCG联合维甲酸可以下调hTERT的表达从而抑制端粒酶的活性, 但单独使用EGCG却达不到这种效果[31].
本实验通过用MTT比色法检测EGCG对HepG2细胞增殖的影响, 提示EGCG有抑制HepG2细胞增殖的作用, 并呈浓度依赖关系. 荧光显微镜检测提示EGCG能诱导HepG2细胞凋亡也呈浓度依赖关系. 由于放疗本身对人体损伤很大, 选择联合用药时, 需要既能起效又能让机体耐受的剂量. 根据MTT的结果, 排除干预后细胞存活率小于50%的100、200 μmol/L EGEG两组; 根据荧光显微镜检测的结果, 50 μmol/L EGCG组的以晚期凋亡为主, 而10 μmol/L EGCG组以早期凋亡细胞为主, 故选择以早期凋亡为主兼有晚期凋亡的25 μmol/L EGCG联合放疗. 最后, 采用实时荧光定量PCR检测不同剂量放疗联合EGCG和不联合EGCG治疗后, HepG2中hTERT基因的表达. 结果表明空白组使用EGCG前后HepG2中的hTERT基因无显著变化, 而对经2、4、6 Gy放射治疗后HepG2中的hTERT基因均有显著性下调作用. 从而证明EGCG能提高肝癌对放疗的敏感性.
本实验提示, 在体外, EGCG具有抑制HepG2细胞的增殖, 促进其凋亡的作用, 并可能提高肝癌对放射治疗的敏感性, 其中以放射剂量为2 Gy时作用比较明显. EGCG对放疗中正常组织细胞的作用, 以及能否作为放射增敏剂使用, 还有待进一步进行体内和临床研究验证.
肝癌是我国常见的恶性肿瘤之一. 若有一种放射增敏剂能使小剂量的肝癌放疗达到大剂量的疗效, 将提高肝癌放疗的疗效. 大量研究表明, hTERT是端粒酶的催化亚单位和限速酶, hTERT和端粒酶与肝癌的关系密切. 端粒是放射损伤的敏感部位. EGCG是绿茶多酚的一种主要成分, 具有一定的调节端粒酶活性的作用.
陈建杰, 主任医师, 上海中医药大学附属曙光医院(东部)肝病科
近年来肝癌的临床放疗取得一些进展, 如何提高肝癌放疗的效果, 是提高整体原发性肝癌治愈率和生存质量的关键.
Yokoyama等的研究表明, 在HeLa细胞和TMCC-1细胞中, 用EGCG联合维甲酸可以下调hTERT的表达从而抑制端粒酶的活性, 但单独使用EGCG却达不到这种效果.
本研究表明, EGCG联合不同剂量放疗可能下调HepG2中hTERT基因水平, 从而抑制端粒酶活性, 因此, 有可能成为放疗增敏剂.
本研究的内容较为重要, 具有一定的新颖性, 提供了充足的有意义的信息.
编辑 曹丽鸥 电编 何基才
| 1. | Ren H, Zhao T, Wang X, Gao C, Wang J, Yu M, Hao J. Leptin upregulates telomerase activity and transcription of human telomerase reverse transcriptase in MCF-7 breast cancer cells. Biochem Biophys Res Commun. 2010;394:59-63. [PubMed] [DOI] |
| 2. | Sealey DC, Zheng L, Taboski MA, Cruickshank J, Ikura M, Harrington LA. The N-terminus of hTERT contains a DNA-binding domain and is required for telomerase activity and cellular immortalization. Nucleic Acids Res. 2010;38:2019-2035. [PubMed] [DOI] |
| 3. | Azouz A, Wu YL, Hillion J, Tarkanyi I, Karniguian A, Aradi J, Lanotte M, Chen GQ, Chehna M, Ségal-Bendirdjian E. Epigenetic plasticity of hTERT gene promoter determines retinoid capacity to repress telomerase in maturation-resistant acute promyelocytic leukemia cells. Leukemia. 2010;24:613-622. [PubMed] [DOI] |
| 4. | Noureini SK, Wink M. Transcriptional down regulation of hTERT and senescence induction in HepG2 cells by chelidonine. World J Gastroenterol. 2009;15:3603-3610. [PubMed] [DOI] |
| 5. | Liu H, Luan F, Ju Y, Shen H, Gao L, Wang X, Liu S, Zhang L, Sun W, Ma C. In vitro transfection of the hepatitis B virus PreS2 gene into the human hepatocarcinoma cell line HepG2 induces upregulation of human telomerase reverse transcriptase. Biochem Biophys Res Commun. 2007;355:379-384. [PubMed] [DOI] |
| 6. | Brandt S, Heller H, Schuster KD, Grote J. The tamoxifen-induced suppression of telomerase activity in the human hepatoblastoma cell line HepG2: a result of post-translational regulation. J Cancer Res Clin Oncol. 2005;131:120-128. [PubMed] [DOI] |
| 8. | Blagoev KB. Cell proliferation in the presence of telomerase. PLoS One. 2009;4:e4622. [PubMed] [DOI] |
| 9. | Takaishi H, Kitamoto M, Takahashi S, Aikata H, Kawakami Y, Nakanishi T, Nakamura Y, Shimamoto F, Kajiyama G, Ide T. Precancerous hepatic nodules had significant levels of telomerase activity determined by sensitive quantitation using a hybridization protection assay. Cancer. 2000;88:312-317. [PubMed] [DOI] |
| 10. | Toshikuni N, Nouso K, Higashi T, Nakatsukasa H, Onishi T, Kaneyoshi T, Kobayashi Y, Kariyama K, Yamamoto K, Tsuji T. Expression of telomerase-associated protein 1 and telomerase reverse transcriptase in hepatocellular carcinoma. Br J Cancer. 2000;82:833-837. [PubMed] [DOI] |
| 11. | Hande MP, Lansdorp PM, Natarajan AT. Induction of telomerase activity by in vivo X-irradiation of mouse splenocytes and its possible role in chromosome healing. Mutat Res. 1998;404:205-214. [PubMed] [DOI] |
| 12. | González-Suárez E, Goytisolo FA, Flores JM, Blasco MA. Telomere dysfunction results in enhanced organismal sensitivity to the alkylating agent N-methyl-N-nitrosourea. Cancer Res. 2003;63:7047-7050. [PubMed] |
| 13. | 邹 跃, 李 志韧, 周 湘艳, 杜 维霞, 胡 海兰. RNA干扰抑制端粒酶对受照后端粒长度的影响. 中华放射医学与防护杂志. 2006;26:453-455. |
| 14. | Ogawa Y, Nishioka A, Hamada N, Terashima M, Inomata T, Yoshida S, Seguchi H, Kishimoto S. Changes in telomerase activity of advanced cancers of oral cavity and oropharynx during radiation therapy: correlation with clinical outcome. Int J Mol Med. 1998;2:301-307. [PubMed] |
| 15. | Romeo L, Intrieri M, D'Agata V, Mangano NG, Oriani G, Ontario ML, Scapagnini G. The major green tea polyphenol, (-)-epigallocatechin-3-gallate, induces heme oxygenase in rat neurons and acts as an effective neuroprotective agent against oxidative stress. J Am Coll Nutr. 2009;28 Suppl:492S-499S. [PubMed] |
| 16. | Chao J, Lau WK, Huie MJ, Ho YS, Yu MS, Lai CS, Wang M, Yuen WH, Lam WH, Chan TH. A pro-drug of the green tea polyphenol (-)-epigallocatechin-3-gallate (EGCG) prevents differentiated SH-SY5Y cells from toxicity induced by 6-hydroxydopamine. Neurosci Lett. 2010;469:360-364. [PubMed] [DOI] |
| 17. | Lee JH, Jeong YJ, Lee SW, Kim D, Oh SJ, Lim HS, Oh HK, Kim SH, Kim WJ, Jung JY. EGCG induces apoptosis in human laryngeal epidermoid carcinoma Hep2 cells via mitochondria with the release of apoptosis-inducing factor and endonuclease G. Cancer Lett. 2010;290:68-75. [PubMed] [DOI] |
| 18. | Farabegoli F, Papi A, Bartolini G, Ostan R, Orlandi M. (-)-Epigallocatechin-3-gallate downregulates Pg-P and BCRP in a tamoxifen resistant MCF-7 cell line. Phytomedicine. 2010;17:356-362. [PubMed] [DOI] |
| 20. | Wua CH, Yehb CY, Yen GC. Epigallocatechin gallate (EGCG) binds to low-density lipoproteins (LDL) and protects them from oxidation and glycation under high-glucose conditions mimicking diabetes. Food Chem. 2010;121:639-644. [DOI] |
| 21. | Qi X. Reactive oxygen species scavenging activities and inhibition on DNA oxidative damage of dimeric compounds from the oxidation of (-)-epigallocatechin-3-O-gallate. Fitoterapia. 2010;81:205-209. [PubMed] [DOI] |
| 22. | Matsumura K, Takayama H, Bae JY, Kurihara M, Tsutsumi S, Hyon SH. Preservation of platelets by adding epigallocatechin-3-o-gallate to platelet concentrates. Cell Transplant. 2009;18:521-528. [PubMed] |
| 23. | Wang L, Xu S, Xu X, Chan P. (-)-Epigallocatechin-3-Gallate protects SH-SY5Y cells against 6-OHDA-induced cell death through STAT3 activation. J Alzheimers Dis. 2009;17:295-304. [PubMed] |
| 24. | Hsu SD, Dickinson DP, Qin H, Borke J, Ogbureke KU, Winger JN, Camba AM, Bollag WB, Stöppler HJ, Sharawy MM. Green tea polyphenols reduce autoimmune symptoms in a murine model for human Sjogren's syndrome and protect human salivary acinar cells from TNF-alpha-induced cytotoxicity. Autoimmunity. 2007;40:138-147. [PubMed] [DOI] |
| 25. | Jeon HY, Kim JK, Kim WG, Lee SJ. Effects of oral epigallocatechin gallate supplementation on the minimal erythema dose and UV-induced skin damage. Skin Pharmacol Physiol. 2009;22:137-141. [PubMed] [DOI] |
| 26. | Brand RM, Jendrzejewski JL. Topical treatment with (-)-epigallocatechin-3-gallate and genistein after a single UV exposure can reduce skin damage. J Dermatol Sci. 2008;50:69-72. [PubMed] [DOI] |
| 27. | 王 熙, 谢 纪文, 刘 礼. 表没食子儿茶素没食子酸酯对缺氧诱导的肝细胞癌HepG2细胞HIF-1α及VEGF蛋白表达的影响. 世界华人消化杂志. 2009;17:357-361. [DOI] |
| 28. | Wang X, Hao MW, Dong K, Lin F, Ren JH, Zhang HZ. Apoptosis induction effects of EGCG in laryngeal squamous cell carcinoma cells through telomerase repression. Arch Pharm Res. 2009;32:1263-1269. [PubMed] [DOI] |
| 29. | Berletch JB, Liu C, Love WK, Andrews LG, Katiyar SK, Tollefsbol TO. Epigenetic and genetic mechanisms contribute to telomerase inhibition by EGCG. J Cell Biochem. 2008;103:509-519. [PubMed] [DOI] |
| 30. | Sadava D, Whitlock E, Kane SE. The green tea polyphenol, epigallocatechin-3-gallate inhibits telomerase and induces apoptosis in drug-resistant lung cancer cells. Biochem Biophys Res Commun. 2007;360:233-237. [PubMed] [DOI] |
| 31. | Yokoyama M, Noguchi M, Nakao Y, Ysunaga M, Yamasaki F, Iwasaka T. Antiproliferative effects of the major tea polyphenol, (-)-epigallocatechin gallate and retinoic acid in cervical adenocarcinoma. Gynecol Oncol. 2008;108:326-331. [PubMed] [DOI] |