修回日期: 2010-04-26
接受日期: 2010-05-10
在线出版日期: 2010-06-28
目的: 研究鸡尾酒疗法对肝纤维化大鼠肝组织中转化生长因子-β1(TGF-β1)、Ⅰ型胶原(COLⅠ)及Ⅲ型胶原(COLⅢ)表达的影响.
方法: 采用CCl4造成大鼠肝纤维化模型, 实验分为: 牛磺酸组、表没食子儿茶素没食子酸酯组、三羟基异黄酮组、鸡尾酒组、秋水仙碱组、模型组和正常组. 在实验的第10周末取肝组织, HE染色法观察肝组织改变, 免疫组织化学法检测肝组织中TGF-β1、COLⅠ及COLⅢ的表达.
结果: 病理组织学观察发现各组能明显改善肝纤维化大鼠肝组织结构和肝纤维化, 免疫组织化学检测表明鸡尾酒组、三羟基异黄酮组、表没食子儿茶素没食子酸酯组、牛磺酸组的肝组织中TGF-β1、COLⅠ及COLⅢ表达量与模型组比较均显著降低(TGF-β1: 2.57±0.23, 4.21±0.35, 4.93±0.21, 4.81±0.16 vs 12.11±0.62, P<0.05; COLⅠ: 2.69±0.10, 4.88±0.42, 5.04±0.31, 4.79±0.29 vs 13.06±0.24, P<0.05; COLⅢ: 3.17±0.42, 5.73±0.23, 5.51±0.25, 5.24±0.18 vs 15.15±0.43, P<0.05), 并且鸡尾酒组与单一用药各组相比有统计学意义(P<0.05).
结论: 鸡尾酒疗法能对肝纤维化大鼠的肝脏起保护作用, 与单一用药相比更能有效降低TGF-β1、COLⅠ及COLⅢ的表达, 可能具有更高的抗肝纤维化能力.
引文著录: 廖明, 林兴, 陈兆霓, 李彦, 卓朗. 鸡尾酒疗法对肝纤维化大鼠肝组织中TGF-β1、COLⅠ及COLⅢ表达的影响. 世界华人消化杂志 2010; 18(18): 1867-1872
Revised: April 26, 2010
Accepted: May 10, 2010
Published online: June 28, 2010
AIM: To investigate the effects of cocktail therapy on the expression of transforming growth factor-β1 (TGF-β1), collagen I (COL I) and collagen III (COL III) in carbon tetrachloride-induced liver fibrosis in rats.
METHODS: Hepatic fibrosis was induced in rats with carbon tetrachloride. Wistar rats were divided into 7 groups: normal group, model group, colchicine group, taurine group, epigallocatechin gallate (EGCG) group, genistein group and cocktail therapy group. The rats were sacrificed at week 10 after treatment. The deposition of collagen in liver tissue was observed by HE staining. The expression of TGF-β1, COL I and COL III in hepatic tissue was detected by immunohistochemistry.
RESULTS: A significant reduction in collagen deposition and disorganization was noted in the cocktail therapy group when compared with the model group. The expression levels of TGF-β1, COL I and COL III in the cocktail therapy group, genistein group, EGCG group and taurine group, compared with the model group, markedly decreased (TGF-β1: 2.57 ± 0.23, 4.21 ± 0.35, 4.93 ± 0.21 and 4.81 ± 0.16 vs 12.11 ± 0.62, all P < 0.05; COL I: 2.69 ± 0.10, 4.88 ± 0.42, 5.04 ± 0.31 and 4.79 ± 0.29 vs 13.06 ± 0.24, all P < 0.05; COL III: 3.17 ± 0.42, 5.73 ± 0.23, 5.51 ± 0.25 and 5.24 ± 0.18 vs 15.15 ± 0.43, all P < 0.05). Cocktail therapy had a more significant inhibitory effect on the expression of these proteins than other agents tested (all P < 0.05).
CONCLUSION: Cocktail therapy has an obvious protective effect against liver fibrosis in rats possibly by remarkably inhibiting TGF-β1, COL I and COL III expression in liver tissue.
- Citation: Liao M, Lin X, Chen ZN, Li Y, Zhuo L. Effects of cocktail therapy on TGF-β1, COL I and COL III expression in liver fibrosis in rats. Shijie Huaren Xiaohua Zazhi 2010; 18(18): 1867-1872
- URL: https://www.wjgnet.com/1009-3079/full/v18/i18/1867.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i18.1867
迄今为止, 肝纤维化尚缺乏理想的治疗方案.多年来针对肝纤维化的药物治疗在众多离体和动物模型实验中显示了一定的疗效, 主要包括抑制肝星状细胞(hepatic stellate cells, HSC)的药物, 如干扰素[1], 作用于细胞外基质(extracellular matrix, ECM)和细胞因子的药物[2-6], 抗氧化剂[7], 抗炎制剂[8]等. 但令众多学者困惑的是几乎所有的抗肝纤维化药物在动物模型有效而临床无效或效果很差, 这严重限制了抗肝纤维化药物的临床应用和治疗效果. 肝纤维化是一系列复杂的多因素过程, 许多药物由于抗肝纤维化作用靶位单一导致疗效并不理想, 而有些药物不良反应大于治疗作用, 不宜用于临床. 因此, 将作用于肝纤维化发生发展不同环节、靶点的药物联合应用, 即鸡尾酒疗法, 以阻断肝纤维化发展, 达到保护肝脏的目的, 可能是抗肝纤维化药物研究的新方向. 牛磺酸、表没食子儿茶素没食子酸酯(epigallocatechin gallate, EGCG)及三羟基异黄酮已有报道具有抗肝纤维化的作用; 其中, 牛磺酸能促进HSC的凋亡[9], 转化生长因子(transforming growth factor-β1, TGF-β1)的表达和阻断TGF-β1/smad信号通路[10-12]; EGCG具有很强的抗氧化作用并能抑制胶原的形成[13-15]; 我们在前期的研究中发现三羟基异黄酮可抑制HSC的增殖, 能显著增强基质金属蛋白酶(matrix metalloproteinase-2, MMP-2) mRNA的表达, 抑制TGF-β1和基质金属蛋白组织抑制因子-2(tissue inhibitor of metalloproteinase-2, TIMP-2) mRNA的表达[16]. 本研究的目的是采用CCl4诱导大鼠肝纤维化模型, 联合应用以上三种作用于肝纤维化不同环节的药物干扰肝纤维化的大鼠, HE染色法观察肝组织改变, 免疫组织化学检测肝组织TGF-β1、COLⅠ及COLⅢ表达水平, 探讨鸡尾酒疗法对肝纤维化大鼠的干扰效果.
SD大鼠, ♂, 体质量180-220 g, 由广西医科大学实验动物中心提供, 合格证号: SCXK桂(2003-0003). 牛磺酸(Sigma); EGCG(四川乐山禹伽茶业科技开发有限公司); 三羟基异黄酮(深圳市迈瑞尔化学技术有限公司); 秋水仙碱(Sigma公司); CCl4(重庆川江化学试剂厂), 实验时用花生油配成40%四氯化碳溶液. 一抗: CollagenⅠ(BA0325)、Ⅲ型(BA0326)及TGF-β1(BA0290), 兔抗大鼠多克隆抗体(即用型, 武汉博士德生物工程有限公司); 二抗: 即用型免疫组织化学MaxvisionTM抗兔-HRP检测试剂盒、DAB显色试剂盒(福建迈新公司).
1.2.1 分组及处理: 105只SD健康大鼠随机分为7组, 每组15只, 分别为正常组、模型组、秋水仙碱阳性对照组、牛磺酸组、EGCG组、三羟基异黄酮组、鸡尾酒组. 除正常对照组外, 其余各组大鼠于首次在背部皮下注射纯CCl4 5 mL/kg, 以后皮下注射40% CCl4溶液2 mL/kg, 每周注射2次, 共10 wk. 自造模之日起的第6周开始, 各用药组每天1次灌胃给牛磺酸(100 mg/kg)、EGCG(15 mg/kg)、三羟基异黄酮(10 mg/kg)、鸡尾酒(同时应用牛磺酸、EGCG、三羟基异黄酮剂量不变), 阳性对照组灌胃给秋水仙碱(0.5 mg/kg). 至10 wk末处死大鼠取肝组织, 肝组织经100 g/L甲醛固定, 做HE染色和免疫组织化学检测.
1.2.2 病理学检查: 肝组织经100 g/L甲醛固定, 石蜡包埋, 做常规组织切片, HE染色观察.
1.2.3 免疫组织化学检测TGF-β1、COLⅠ及COLⅢ表达: 石蜡包埋常规组织切片经二甲苯脱蜡, 梯度酒精水化. 然后将脱蜡水化后的组织切片放入已沸腾的柠檬酸缓冲液中进行酸化修复. 取出玻片, 先用自来水冲洗后, 置放于孵育盒中. PBS冲洗3次, 每次间隔3 min, 除去PBS液. 每张切片加1滴3%过氧化氢, 室温下孵育10 min. PBS冲洗3次, 每次间隔3 min, 除去PBS液. 每张切片加50 μL的TGF-β1、COLⅠ及COLⅢ兔抗大鼠多克隆抗体, 在4 ℃温度下孵育过夜. PBS冲洗3次, 每次间隔3 min. 除去PBS液, 每张切片加50 μL MaxvisionTM抗兔-HRP检测试剂盒, 室温下孵育15 min. PBS冲洗3次, 每次间隔3 min, 除去PBS液. 每张切片加50 μL新鲜配制的DAB溶液显色观察. 自来水冲洗, 苏木素复染30 s, 自来水冲洗, 返蓝. 切片经梯度酒精脱水干燥、中性树胶封固. 在OLYMPUS倒置金相显微镜(GX51)的全自动图像分析系统上, 每张切片随机选取10个视野(×100倍)测定阳性细胞面积百分比(阳性着色面积百分比 = 阳性着色面积/肝组织面积×100%), 平均值越大表明组织中该抗原含量越高, 据此分析TGF-β1、COLⅠ及COLⅢ的表达.
统计学处理 应用SPSS13.0软件进行统计分析. 数据均以mean±SD表示, 组间比较采用t检验, 以P<0.05为有统计学差异.
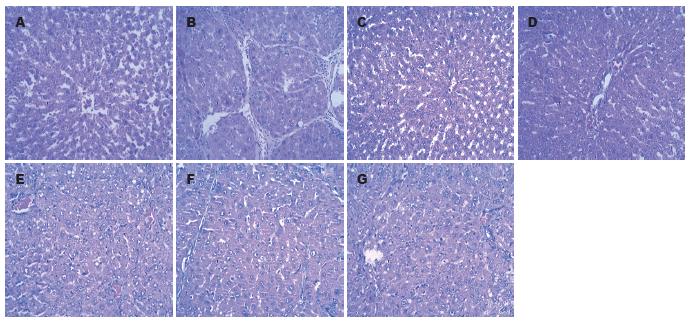
HE染色后观察(图1), 正常组肝小叶结构完整, 中央静脉及静脉窦状隙无扩张, 肝细胞排列整齐, 无变性及硬化; 模型组大鼠肝细胞高或中度浊肿变性, 形成大小不等的圆形或椭圆形肝细胞结构结节构成假小叶, 结节周围纤维组织沉积、增生. 牛磺酸、EGCG、三羟基异黄酮、鸡尾酒组和秋水仙碱组大鼠纤维程度均有不同程度减轻, 肝小叶结构基本完整, 少量肝细胞轻度浊肿, 汇管区少量纤维组织增生, 纤维间隔变窄, 炎脂肪空泡的形成明显降低.
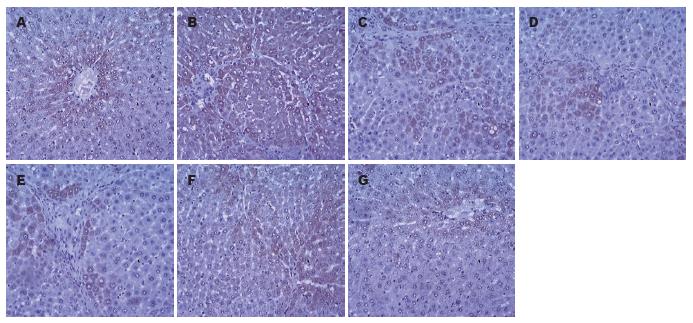
按"1.2.3"中的方法定量分析各组肝组织中TGF-β1表达, 正常对照组中的大鼠肝组织仅在中央静脉和汇管区有少量浅淡着色, TGF-β1仅微量表达; 模型组中大量阳性染色分布于变性的肝细胞、中央小叶和门静脉周围纤维带及肝纤维间隔, TGF-β1阳性表达显著增强(P<0.05 vs 对照组); 各用药组和秋水仙碱阳性对照组的大鼠肝组织中TGF-β1染色程度均较模型组明显减轻, 仅少量或微量表达(P<0.05); 并且鸡尾酒组与单一用药各组相比显著减轻(P<0.05, 表1, 图2), 但与秋水仙碱组相比无差异.
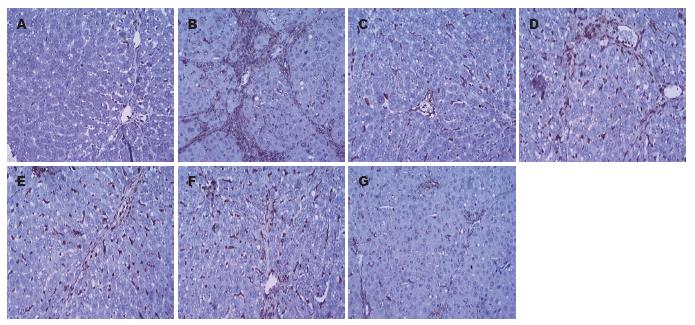
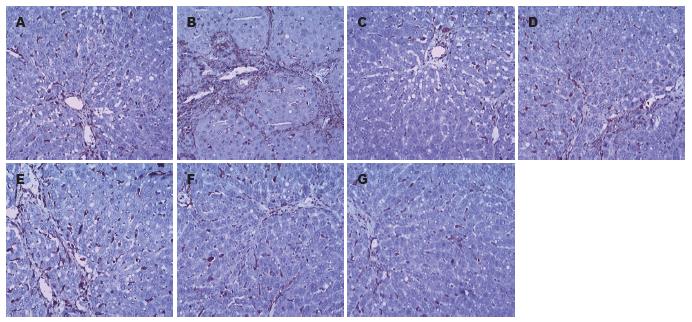
正常组大鼠肝组织中的Ⅰ型胶原纤维少量分布于汇管区和中央静脉管壁, 在肝实质内沿肝窦壁形成的细丝状着色, 免疫组织化学染色呈弱阳性; Ⅲ型胶原分布于大血管周围, 免疫组织化学染色呈弱阳性; 模型组大鼠肝脏中Ⅰ、Ⅲ型胶原除汇管区、中央静脉及肝窦四周增多外, 在纤维隔内呈弥漫分布, 广泛存在于纤维间隔及肝细胞内, 呈连续细分枝状或间断分枝状; 各用药组大鼠肝脏中Ⅰ、Ⅲ型胶原明显减少, 纤维间隔较薄, 无明显假小叶形成. 按"1.2.3"中的方法定量分析各组肝组织中Ⅰ、Ⅲ型胶原表达, 各用药组和秋水仙碱阳性对照组的大鼠肝组织中Ⅰ、Ⅲ型胶原染色程度均较模型组明显减轻, 仅少量或微量表达(P<0.05 vs 模型组), 并且鸡尾酒组与单一用药各组相比也有显著减轻(P<0.05, 表1, 图3, 4), 但与秋水仙碱组相比无差异.
鉴于众多抗肝纤维化药物的单一应用的临床疗效很差, 作用于肝纤维化不同环节的药物联合应用的鸡尾酒疗法日益成为关注的焦点. 有关实验研究初步证实联合应用具有协同作用. 戚合德等[17]发现安络化纤丸联合恩替卡韦用药更有利于阻断或逆转肝纤维化的形成和发展; 曾佑祥等[18]在采用阿米洛利联合苦参素预防大鼠肝纤维化的研究发现, 两者联用有一定的协同作用; 拉米夫定联合大黄素或肝纤方的抗肝纤维化作用研究表明, 联合用药更有利于阻断或逆转肝纤维化的形成与发展, 具有一定的临床试用价值[19]. 抗纤维化药物的联合应用主要有以下优点, 首先作用于肝纤维化形成的不同环节的药物联合应用能更有效地阻断肝纤维化的发展, 达到比任何单一药物更好的肝保护作用, 这一点对于在目前大多单一的纤维化药物临床效果极差或无效的情况下尤为重要[20]. 其次, 联合用药可以减少单一药物的有效剂量, 降低与药物剂量相关的不良反应[21].
本实验的肝组织HE染色表明鸡尾酒干扰组的大鼠肝纤维化程度较轻, 肝小叶结构基本正常, 与模型组大小不等的圆形或椭圆形肝细胞结构结节构成的假小叶, 及结节周围纤维组织沉积、增生相比, 其假小叶形成和纤维不明显, 表明鸡尾酒对实验性大鼠肝纤维化具有很好的逆转作用.
目前认为ECM的过度增多和异常沉积是肝纤维化发生的主要原因, Ⅰ型和Ⅲ型胶原是ECM的主要成分[22-24]. 而ECM的合成与降解在很大程度上由TGF-β1调控, TGF-β1在肝纤维化中表达明显增多, 能够抑制肝细胞增殖、诱导肝细胞凋亡, 促进HSC的增殖和活化, 使ECM成分合成增多, 降解减少, 促进肝纤维化的进程[25-29]. 现已证实肝纤维化发生的关键是HSC的激活及其激活后ECM异常表达, TGF-β1是激活HSC并促进其表达ECM的关键因子, 在促进ECM合成、抑制ECM降解等多环节发挥重要作用[30]. 鸡尾酒干扰肝纤维化大鼠后, 明显抑制肝组织中TGF-β1的表达和COLⅠ、COLⅢ的水平, 鸡尾酒组与单一用药各组相比有显著性差异(P<0.05), 从而进一步证实了鸡尾酒疗法对大鼠肝脏的保护作用.
迄今为止, 对肝纤维化的治疗尚缺乏理想的治疗方案. 因肝纤维化是一系列复杂的多因素过程, 许多药物由于抗肝纤维化作用靶位单一导致疗效并不理想, 而有些药物不良反应大于治疗作用, 不宜用于临床. 因此, 将作用于肝纤维化发生发展不同环节、靶点的药物联合应用即鸡尾酒疗法以阻断肝纤维化发展, 达到保护肝脏的目的, 可能是抗肝纤维化药物研究的新方向.
徐可树, 教授, 华中科技大学同济医学院协和医院消化内科; 刘海林, 主任医师, 上海交通大学医学院附属第九人民医院消化科
牛磺酸和表没食子儿茶素没食子酸酯已有报道具有抗肝纤维化的作用, 本课题组的前期研究发现三羟基异黄酮可抑制HSC的增殖, 能显著增强MMP-2 mRNA的表达, 抑制TGF-β1和TIMP-2 mRNA的表达. 联合应用以上三种作用于肝纤维化不同环节的药物即鸡尾酒疗法干扰肝纤维化的大鼠, 以评价鸡尾酒疗法的效果尚未见有报道.
戚合德等2008年发现安络化纤丸联合恩替卡韦用药更有利于阻断或逆转肝纤维化的形成和发展; 曾佑祥等2006在采用阿米洛利联合苦参素预防大鼠肝纤维化的研究发现, 两者联用有一定的协同作用.
本研究采用HE染色和免疫组织化学法研究鸡尾酒疗法对肝纤维化大鼠肝组织中TGF-β1、COLⅠ及COLⅢ表达的影响, 首次探讨鸡尾酒疗法的抗肝纤维化效果.
本研究探讨了鸡尾酒疗法对肝纤维化大鼠肝组织中TGF-β1、COLⅠ及COLⅢ表达影响, 为下一步的鸡尾酒疗法抗肝纤维化的临床前研究奠定基础.
本研究是作者在前期工作基础上的进一步探索, 研究思路清楚, 内容充实.
编辑 李军亮 电编 何基才
| 1. | Weng H, Mertens PR, Gressner AM, Dooley S. IFN-gamma abrogates profibrogenic TGF-beta signaling in liver by targeting expression of inhibitory and receptor Smads. J Hepatol. 2007;46:295-303. [PubMed] [DOI] |
| 2. | Son G, Iimuro Y, Seki E, Hirano T, Kaneda Y, Fujimoto J. Selective inactivation of NF-kappaB in the liver using NF-kappaB decoy suppresses CCl4-induced liver injury and fibrosis. Am J Physiol Gastrointest Liver Physiol. 2007;293:G631-G639. [PubMed] [DOI] |
| 3. | Seki E, Brenner DA. Toll-like receptors and adaptor molecules in liver disease: update. Hepatology. 2008;48:322-335. [PubMed] [DOI] |
| 4. | Iimuro Y, Brenner DA. Matrix metalloproteinase gene delivery for liver fibrosis. Pharm Res. 2008;25:249-258. [PubMed] [DOI] |
| 5. | Dooley S, Hamzavi J, Ciuclan L, Godoy P, Ilkavets I, Ehnert S, Ueberham E, Gebhardt R, Kanzler S, Geier A. Hepatocyte-specific Smad7 expression attenuates TGF-beta-mediated fibrogenesis and protects against liver damage. Gastroenterology. 2008;135:642-659. [PubMed] [DOI] |
| 6. | Inagaki Y, Higashi K, Kushida M, Hong YY, Nakao S, Higashiyama R, Moro T, Itoh J, Mikami T, Kimura T. Hepatocyte growth factor suppresses profibrogenic signal transduction via nuclear export of Smad3 with galectin-7. Gastroenterology. 2008;134:1180-1190. [PubMed] [DOI] |
| 7. | Comporti M, Signorini C, Arezzini B, Vecchio D, Monaco B, Gardi C. Isoprostanes and hepatic fibrosis. Mol Aspects Med. 2008;29:43-49. [PubMed] [DOI] |
| 8. | Dumont JM, Maignan MF, Janin B, Herbage D, Perrissoud D. Effect of malotilate on chronic liver injury induced by carbon tetrachloride in the rat. J Hepatol. 1986;3:260-268. [PubMed] [DOI] |
| 9. | Chen YX, Zhang XR, Xie WF, Li S. Effects of taurine on proliferation and apoptosis of hepatic stellate cells in vitro. Hepatobiliary Pancreat Dis Int. 2004;3:106-109. [PubMed] |
| 11. | Kato J, Ido A, Hasuike S, Uto H, Hori T, Hayashi K, Murakami S, Terano A, Tsubouchi H. Transforming growth factor-beta-induced stimulation of formation of collagen fiber network and anti-fibrotic effect of taurine in an in vitro model of hepatic fibrosis. Hepatol Res. 2004;30:34-41. [PubMed] [DOI] |
| 13. | Nagle DG, Ferreira D, Zhou YD. Epigallocatechin-3-gallate (EGCG): chemical and biomedical perspectives. Phytochemistry. 2006;67:1849-1855. [PubMed] [DOI] |
| 14. | Nakamuta M, Higashi N, Kohjima M, Fukushima M, Ohta S, Kotoh K, Kobayashi N, Enjoji M. Epigallocatechin-3-gallate, a polyphenol component of green tea, suppresses both collagen production and collagenase activity in hepatic stellate cells. Int J Mol Med. 2005;16:677-681. [PubMed] |
| 15. | Zhen MC, Wang Q, Huang XH, Cao LQ, Chen XL, Sun K, Liu YJ, Li W, Zhang LJ. Green tea polyphenol epigallocatechin-3-gallate inhibits oxidative damage and preventive effects on carbon tetrachloride-induced hepatic fibrosis. J Nutr Biochem. 2007;18:795-805. [PubMed] [DOI] |
| 21. | 郑 青山, 张 劲松, 桂 常青, 王 学文, 杨 会杰, 李 爱华, 汪 幼霞, 孙 瑞元. 纳米红色元素硒与葡萄糖醛酸内酯联用对大鼠肝纤维化形成过程的干预及其定量分析. 中国药理学通报. 2002;18:99-102. |
| 22. | Giannelli G, Antonaci S. Immunological and molecular aspects of liver fibrosis in chronic hepatitis C virus infection. Histol Histopathol. 2005;20:939-944. [PubMed] |
| 23. | Friedman SL. Mechanisms of disease: Mechanisms of hepatic fibrosis and therapeutic implications. Nat Clin Pract Gastroenterol Hepatol. 2004;1:98-105. [PubMed] [DOI] |
| 24. | Tsukada S, Parsons CJ, Rippe RA. Mechanisms of liver fibrosis. Clin Chim Acta. 2006;364:33-60. [PubMed] [DOI] |
| 25. | Sanderson N, Factor V, Nagy P, Kopp J, Kondaiah P, Wakefield L, Roberts AB, Sporn MB, Thorgeirsson SS. Hepatic expression of mature transforming growth factor beta 1 in transgenic mice results in multiple tissue lesions. Proc Natl Acad Sci U S A. 1995;92:2572-2576. [PubMed] [DOI] |
| 26. | Kanzler S, Lohse AW, Keil A, Henninger J, Dienes HP, Schirmacher P, Rose-John S, zum Büschenfelde KH, Blessing M. TGF-beta1 in liver fibrosis: an inducible transgenic mouse model to study liver fibrogenesis. Am J Physiol. 1999;276:G1059-G1068. [PubMed] |
| 27. | Schnur J, Oláh J, Szepesi A, Nagy P, Thorgeirsson SS. Thioacetamide-induced hepatic fibrosis in transforming growth factor beta-1 transgenic mice. Eur J Gastroenterol Hepatol. 2004;16:127-133. [PubMed] [DOI] |
| 28. | Gressner AM, Weiskirchen R. Modern pathogenetic concepts of liver fibrosis suggest stellate cells and TGF-beta as major players and therapeutic targets. J Cell Mol Med. 2006;10:76-99. [PubMed] [DOI] |
| 29. | Parsons CJ, Takashima M, Rippe RA. Molecular mechanisms of hepatic fibrogenesis. J Gastroenterol Hepatol. 2007;22 Suppl 1:S79-S84. [PubMed] [DOI] |
| 30. | Gressner AM, Weiskirchen R, Breitkopf K, Dooley S. Roles of TGF-beta in hepatic fibrosis. Front Biosci. 2002;7:d793-d807. [PubMed] [DOI] |