修回日期: 2010-05-08
接受日期: 2010-05-18
在线出版日期: 2010-06-28
目的: 观察shRNA沉寂HK-Ⅱ基因的表达对胃癌细胞株SGC7901细胞增殖、凋亡的影响, 初步评价HK-Ⅱ基因治疗胃癌的应用前景.
方法: 取胃癌细胞株SGC7901及胃上皮细胞株GES-1细胞为研究对象, 将每株细胞分别分成5组(A: 干扰组; B: 阳性对照组; C: 阴性对照组; D: 脂质体组; E: 空白对照组). 用shRNA沉寂胃癌细胞株SGC7901及胃上皮细胞株GES-1细胞中HK-Ⅱ的表达. 用逆转录-聚合酶链反应(RT-PCR)检测转染shRNA后每株细胞中各组HK-Ⅱ mRNA的表达变化; 分别用MTT及流式细胞仪检测转染后细胞增殖、凋亡的变化.
结果: HK-Ⅱ mRNA在胃癌细胞株SGC7901细胞中的表达明显高于胃上皮细胞株GES-1细胞(t = 12.119, P<0.01), HK-Ⅱ shRNA可以明显抑制两株细胞中HK-Ⅱ的表达(P<0.01). 沉寂HK-Ⅱ的表达可抑制SGC7901细胞的增殖(F = 159.811, P<0.01), 并促进其凋亡(χ2 = 21.324, P<0.01); 但对胃上皮细胞增殖(F = 0.704, P = 0.592)及凋亡(χ2 = 1.007, P = 0.909)无明显影响.
结论: 沉寂HK-Ⅱ表达可以抑制胃癌细胞株SGC7901的增殖, 促进其凋亡; 但对胃上皮细胞株GES-1无明显影响. HK-Ⅱ可能成为胃癌治疗的一个靶点.
引文著录: 吴平安, 李国华, 万娟, 王翀, 杨霞. shRNA沉寂HK-Ⅱ表达对胃癌SGC7901细胞增殖、凋亡的影响. 世界华人消化杂志 2010; 18(18): 1860-1866
Revised: May 8, 2010
Accepted: May 18, 2010
Published online: June 28, 2010
AIM: To observe the changes in cell proliferation and apoptosis in gastric cancer cell line SGC7901 after silencing the hexokinase II (HK-II) gene with an HK-II-specific shRNA, and to assess the potential application of HK-II-targeted gene therapy for gastric cancer.
METHODS: Gastric cancer cell line SGC7901 and gastric epithelial cell line GES-1 were used in this study. Both SGC7901 cells and GES-1 cells were divided into 5 groups: HK-II shRNA group, positive control group, negative control group, empty liposome group, and blank control group. After transfection of HK-II-specific shRNA into SGC7901 and GES-1 cells, the change in the expression of HK-II mRNA was detected by reverse transcription-polymerase chain reaction (RT-PCR), and the changes in cell proliferation and apoptosis were assessed by MTT assay and flow cytometry, respectively.
RESULTS: The expression level of HK-II mRNA in SGC7901 cells was significantly higher than that in GES-1 cells (t = 12.119, P < 0.01). The expression of HK-II mRNA was obviously silenced after transfection of HK-II-specific shRNA (P < 0.01). HK-II knockdown could significantly inhibit proliferation (F = 159.811, P < 0.01) and promote apoptosis (χ2 = 21.324, P < 0.01) in SGC7901 cells, but had no significant effect on proliferation and apoptosis in GES-1 cells (F = 0.704, P = 0.592; χ2 = 1.007, P = 0.909).
CONCLUSION: HK-II knockdown significantly inhibits proliferation and promotes apoptosis in SGC7901 cells, but has no significant impact in GES-1 cells. HK-II may be a potential target for the treatment of gastric cancer.
- Citation: Wu PA, Li GH, Wan J, Wang C, Yang X. shRNA-mediated silencing of hexokinase II inhibits proliferation but promotes apoptosis in SGC7901 cells. Shijie Huaren Xiaohua Zazhi 2010; 18(18): 1860-1866
- URL: https://www.wjgnet.com/1009-3079/full/v18/i18/1860.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i18.1860
恶性肿瘤具有高度的糖分解代谢表型, 并且是以糖酵解为主. 其原因最主要的是糖酵解的限速酶(己糖激酶、磷酸果糖激酶和丙酮酸激酶)活性增强, 尤其与己糖激酶活性显著增加有关[1-3]. 目前研究表明, 生长迅速的肿瘤细胞不同于正常细胞, 其糖酵解主要是依靠HK-Ⅱ, 即肿瘤细胞中HK-Ⅱ活力显著增加; 且HK-Ⅱ不仅影响恶性肿瘤细胞的葡萄糖的代谢, 同时影响着恶性肿瘤细胞的增殖、凋亡[4,5]. 胃癌是消化系最常见的恶性肿瘤, 严重危害人类的健康[6]. 但目前沉寂HK-Ⅱ基因表达对胃癌细胞增殖、凋亡影响未见报道, HK-Ⅱ在胃癌治疗中的应用价值及前景不明. 本实验通过观察短发夹状RNA(short hairpin, shRNA)沉寂HK-Ⅱ表达前后胃癌及胃上皮细胞株增殖、凋亡的变化, 探讨细胞中HK-Ⅱ的表达与细胞增殖、凋亡的关系, 评价HK-Ⅱ在胃癌中的治疗意义和应用前景.
HK-Ⅱ shRNA(pGCsilencerTM U6/Neo/shGFP RNAi载体, 图1)购自上海吉凯制药技术有限公司; LipofectamineTM2000(脂质体)购自Invitrogen公司; 杜尔伯克改良基础培养基(dulbecco's modified eagle medium, DMEM)购自Gibco公司; 胰酶购自Solarbio公司; 胎牛血清购自杭州四季青生物工程材料有限公司; 二甲基亚砜(DMSO)购自中国医学科学院生物医学工程研究所.
1.2.1 细胞培养: 胃癌SGC7901细胞购自南京凯基生物科技发展有限公司; 胃上皮GES-1细胞由北大肿瘤医院遗传研究室惠赠. 用含10%新生小牛血清、100 kU/L青霉素、100 kU/L链霉素的高糖DMEM, 于37 ℃、50 mL/L CO2、饱和湿度的培养箱中培养. 实验选用对数生长期细胞.
1.2.2 逆转录-聚合酶链反应(RT-PCR): 按TRIzol试剂说明提取细胞总RNA, 并逆转录合成cDNA. 根据GenBank提供的HK-Ⅱ mRNA序列设计合成引物. 上游引物: 5'-ATCTGCTTGCCTACTTCTTC-3', 下游引物: 5'-TCTCCATCTCCACCTTCTG-3', 产物长度311 bp. PCR反应条件: 95 ℃预变性5 min; 94 ℃ 30 s, 55 ℃ 30 s, 72 ℃ 1 min, 30个循环; 72 ℃延伸5 min. PCR产物用1.5%琼脂糖凝胶电泳鉴定. 以β-肌动蛋白为内参照.
1.2.3 HK-Ⅱ shRNA转染实验: HK-Ⅱ shRNA: 5'- CCAAAGACATCTCAGACAT-3', 起始点2 932 (NCBI BANK NM 000189的基因系列)由上海吉凯制药技术有限公司设计. GAPDH阳性对照序列: 5'-CTCTGGTAAAGTGGATATT-3'; 阴性对照序列: 5'-TTCTCCGAACGTGTCACGT-3', 购自上海吉凯制药技术有限公司. 胰酶消化细胞并计数, 将细胞接种于6孔细胞培养板, 用250 μL无血清培养基稀释3 μL Lipofectamine 2000转染试剂, 在5 min内同稀释的质粒DNA混合, 将复合物加入到每孔中, 在37 ℃, 50 mL/L CO2中继续培养48 h. 实验分为HK-Ⅱ shRNA组(A组)、阳性对照组(B组), 阴性对照组(C组), 脂质体组(D组), 空白对照组(E组), 每组均设3个复孔.
1.2.4 MTT法检测shRNA转染后细胞增殖: 胰酶消化细胞并计数, 将细胞接种于96孔细胞培养板, 用无血清培养基稀释Lipofectamine 2000转染试剂, 在5 min内同稀释的质粒DNA混合, 将复合物加入到每孔中, 在37 ℃, 50 mL/L CO2中继续培养96 h. 加20 µL/孔MTT液(5 g/L), 4 h后小心吸去培养基, 每孔加150 µL二甲亚砜(DMSO). Model 550型酶标仪在490 nm下测吸光值(A值). 实验分组同前(HK-Ⅱ shRNA转染实验), 每组均设5个复孔.
1.2.5 流式细胞仪检测细胞凋亡: 收集转染48 h后6孔板细胞, 胰酶消化细胞并计数, 每孔细胞总数>105个. 加入100 mL/L的胎牛血清的DMEM培养液将贴壁细胞吹打成细胞悬液, 用吸管把细胞悬液转移至一新的离心管中, 1 000 r/min离心5 min. 用PBS液洗涤细胞2次, 并用培养液重悬后吸管将细胞悬液转移上样管中离心. 并加入碘化丙锭(PI)染色液混匀, 至4 ℃避光30 min, 上机检测细胞凋亡率.
统计学处理 计量资料用mean±SD表示, 两组之间用t检验或SNK检验, 多组之间用单因素方差分析. 计数资料用秩和或卡方检验. P = 0.05为显著性水准, P<0.05有统计学意义. 采用SPSS16.0统计分析进行分析.
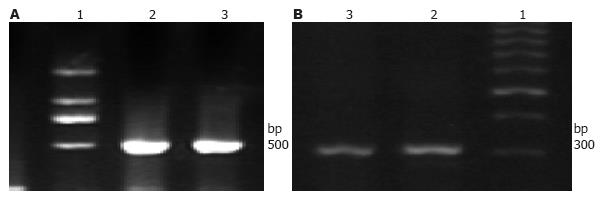
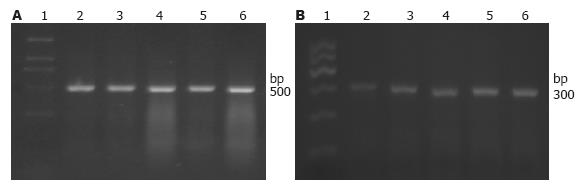
RT-PCR分别检测转染前胃癌细胞株SGC7901及胃上皮细胞株GES-1中HK-Ⅱ mRNA的表达发现, 两株细胞均有HK-Ⅱ mRNA的表达(图2). HK-Ⅱ在胃癌细胞株SGC7901中的表达明显高于胃上皮细胞株GES-1(t = 12.119, P<0.01).
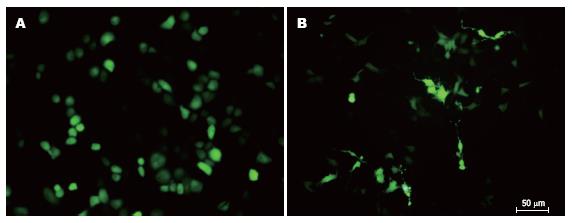
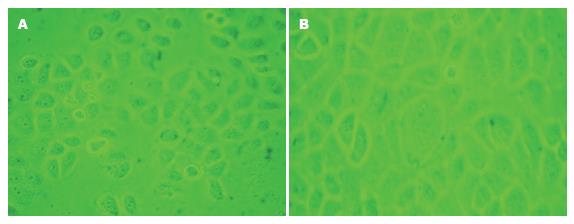
细胞转染试验在6孔板中进行, 采用脂质体转染方法. 转染后荧光显微镜观察显示, 转染后A组、B组, C组细胞有绿色荧光(质粒携带有GFP基因, 其在体内或体外表达的蛋白在荧光显微镜下经蓝光的激发可发出具有特征性的绿色荧光), 而D组, E组无绿色荧光(图3), 说明两株细胞的转染成功.
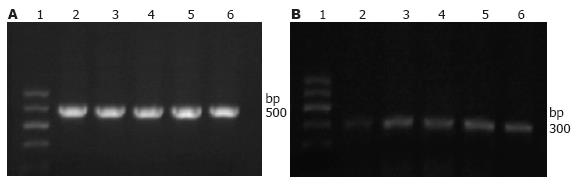
HK-Ⅱ shRNA转染细胞48 h后行RT-PCR检测β-actin及HK-Ⅱ表达, 无论是SGC7901还是GES-1细胞, 转染HK-Ⅱ shRNA后, HK-Ⅱ表达量均明显低于阳性对照组、阴性对照组、脂质体组及空白对照组(P<0.05, 表1, 图4, 5); 而每株细胞实验中的阳性对照组、阴性对照组、脂质体组及空白对照组之间均无统计学差异(P>0.05). 说明HK-Ⅱ shRNA可以有效沉寂HK-Ⅱ基因的表达.
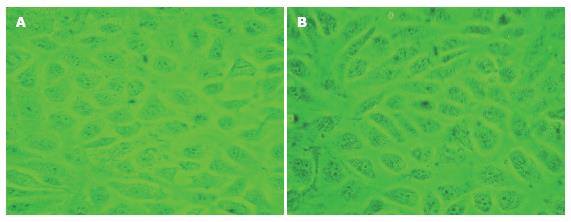
shRNA转染胃癌细胞株SGC7901 48 h后在倒置显微镜下观察, 发现HK-Ⅱ shRNA组细胞排列疏松, 形态变圆, 皱缩, 体积变小, 出现飘浮的细胞; 而阳性对照、阴性对照及脂质体组细胞仅见少量空泡(图6). HK-Ⅱ shRNA组细胞数量明显低于其他各组(P<0.05), 而其他他各组之间细胞数量无显著性差异(χ2 = 3.854, P = 0.278). shRNA转染胃上皮细胞株GES-1后各组细胞形态学均未见明显变化(图7); 各组高倍镜下计数的细胞数量无显著性差异(χ2 = 6.307, P = 0.177).
shRNA转染细胞96 h后, MTT法检测SGC7901及GES-1细胞的吸光度值, 在SGC7901细胞实验中, HK-Ⅱ shRNA组吸光度值明显低于阳性对照组、阴性对照组、脂质体组及空白对照组(表2, P<0.05); 而阳性对照组、阴性对照组、脂质体组、空白对照组之间无显著性差异(F = 0.567, P = 0.639). shRNA转染GES-1细胞后, 各组之间吸光度值均无显著性差异(F = 0.704, P = 0.592, 表2). 因为MTT检测的吸光度值反映细胞增殖情况, 说明HK-Ⅱ shRNA能明显抑制SGC7901细胞的增殖, 而对正常胃上皮细胞株GES-1细胞的增殖无明显影响.
用流式细胞术检测转染后细胞的凋亡率, SGC7901转染后HK-Ⅱ shRNA组凋亡率显著高于其他各组(P<0.01), 而其余各组之间均无显著性差异(χ2 = 0.249, P = 0.969, 表3). GES-1细胞转染后各组之间凋亡率均无显著性差异(χ2 = 1.007, P = 0.909, 表4). 说明HK-Ⅱ shRNA促进SGC7901细胞的凋亡, 而对正常胃上皮GES-1细胞的凋亡无明显影响.
| 分组 | 凋亡率(各观察值) | 统计量 | ||||||||
| A | 23.4 | 42.5 | 32.1 | 31.2 | 28.9 | 34.5 | 27.6 | 34.1 | 32.1 | χ2 = 21.324 |
| B | 7.6 | 8.7 | 10.2 | 11.2 | 9.8 | 8.4 | 8.5 | 9.5 | 8.9 | P<0.01 |
| C | 8.7 | 9.7 | 8.6 | 8.9 | 9.0 | 11.1 | 9.6 | 9.8 | 7.6 | |
| D | 9.4 | 7.9 | 8.5 | 8.0 | 8.6 | 9.9 | 9.7 | 8.9 | 11.2 | |
| E | 8.1 | 9.2 | 10.5 | 8.7 | 6.5 | 7.2 | 10.1 | 8.7 | 11.2 | |
| 分组 | 凋亡率(各观察值) | 统计量 | ||||||||
| A | 10.2 | 9.7 | 8.6 | 7.6 | 7.5 | 7.8 | 8.6 | 8.9 | 7.9 | χ2 = 1.007 |
| B | 7.9 | 7.0 | 9.5 | 8.5 | 8.4 | 7.9 | 7.6 | 8.1 | 7.7 | P = 0.909 |
| C | 7.6 | 9.8 | 9.6 | 11.1 | 9.0 | 8.9 | 8.6 | 9.7 | 8.7 | |
| D | 11.2 | 8.9 | 9.7 | 9.9 | 8.6 | 8.0 | 8.5 | 7.9 | 9.4 | |
| E | 11.2 | 8.7 | 10.1 | 7.2 | 6.5 | 8.7 | 10.5 | 9.2 | 8.1 | |
活跃的糖酵解是恶性肿瘤显著的代谢特征, 是细胞恶性转化的能量基础[7]. 己糖激酶是调控细胞糖酵解的重要限速酶. 目前已知人类有HK-Ⅰ、HK-Ⅱ、HK-Ⅲ和HK-Ⅳ 4种同工酶. 正常情况下, HK-Ⅱ仅在心脏、肌肉和脂肪组织中微量表达. 而在大多数生长迅速的恶性肿瘤细胞中, 是以HK-Ⅱ高表达为主, 并且他是以线粒体结合型的方式存在[8-11]. Golshani-Hebroni等[12]的研究发现, HK-Ⅱ和线粒体外膜蛋白的结合不但能让己糖激酶更好地利用ATP, 加速糖代谢, 调节葡萄糖消耗量和氧气之间的平衡, 而且能向线粒体提供更多的ADP而加速三羧酸循环. 同时, 三羧酸循环的加速也可以通过两种机制刺激蛋白质的合成: 一是增加ATP的生成; 二是提供蛋白质合成所需的某些氨基酸, 如谷氨酸、丙氨酸、天冬氨酸等. 就刺激生长分裂迅速的细胞产生更多的ATP和合成更多的蛋白质而言, 己糖激酶和线粒体外膜蛋白的结合处于能量代谢增加的中心. Gelb等[13]也发现, HK-II的活力在大多数的癌症细胞中显著性地增加的一个重要原因就是他和线粒体外膜相结合. 另外, 线粒体结合型HK-Ⅱ具有拮抗细胞凋亡功能, 是细胞线粒体的保护者, 他将细胞能量代谢与抗凋亡作用在线粒体水平上联系在一起[14]. HK-Ⅱ黏附于线粒体外膜, 与VDAC、ANT等构建MPTP(线粒体通透性转换孔复合体), 并和Bcl-2家族成员一起参与调控线粒体膜的通透性. 外源性HK-Ⅱ高表达可促进MPTP关闭, 抑制Bax、tBid诱导的细胞凋亡[15]. 即使在促凋亡因子(Bax、Bak)缺乏的情况下, 将HK-Ⅱ从线粒体上分离也可导致细胞凋亡, Bcl-2却不能抑制这种效应[16]. 我们用RT-PCR检测了SGC7901胃癌细胞及GES-1胃上皮细胞的HK-Ⅱ的表达, 发现胃癌细胞中HK-Ⅱ的表达明显高于胃上皮细胞, 此结果与既往国外的研究中发现的胃癌中HK-Ⅱ表达增强是一致的[17-19]. 也进一步说明了HK-Ⅱ对胃癌细胞的生长增殖有重要作用. 但HK-Ⅱ对胃癌细胞增殖、凋亡的影响未见报道. 因此我们想通过观察沉寂HK-Ⅱ表达前后胃癌SGC7901及胃上皮GES-1细胞增殖、凋亡, 分析HK-Ⅱ对胃癌细胞增殖、凋亡的影响.
RNA干扰(RNA interference, RNAi)技术是近年来发展的一种新的基因沉默技术, 他是将外源性的双链RNA(double strand RNA, dsRNA)导入细胞内形成沉默复合体(RNA-induced silencing complex, RISC), 引起同源mRNA降解的一种细胞反应过程, 属于转录后基因沉默(posttranscriptional gene silencing, PTGS)[20]. RNA干扰有多种方法, 其中一种方法是成功构建能在体内转录的载体, 在载体内插入了一个19-21 nt的反向重复序列, 中间4-9 nt碱基与目的基因不互补, 利用U6启动子或H1启动子驱动, 转染细胞后, 能在细胞内转录出mRNA, 形成自身茎环结构, 成为shRNA, 转录出的shRNA与细胞内的Dicer酶结合, 成功地抑制目的基因的RNA翻译, 他是目前最好的RNA干扰方法. 我们选择了shRNA进行转染实验. 实验中订购了针对HK-Ⅱ基因cds区的shRNA, 用其转染SGC7901及GES-1细胞后, 转染后荧光显微镜观察显示, 转染后HK-Ⅱ shRNA组(A组)、阳性对照组(B组), 阴性对照组(C组)细胞有绿色荧光(质粒携带有GFP基因, 其在体内或体外表达的蛋白在荧光显微镜下经蓝光的激发可发出具有特征性的绿色荧光), 而脂质体组(D组), 空白对照组(E组)无绿色荧光, 说明了对两株细胞的转染是成功的. 并且用RT-PCR的方法检测转染后HK-Ⅱ基因的表达, 发现HK-Ⅱ shRNA能明显抑制细胞靶基因的表达.
通过观察转染HK-Ⅱ shRNA后细胞的增殖及凋亡情况发现, 转染HK-Ⅱ shRNA后, SGC7901细胞的增殖明显受抑制, 而凋亡率明显升高, 说明HK-Ⅱ可以促进SGC7901细胞的增殖, 抑制其凋亡. 而对正常胃上皮细胞(GES-1)的增殖、凋亡未见明显影响. 这也说明HK-Ⅱ对胃癌细胞的增殖是重要的, 而对正常细胞并不重要. 为什么HK-Ⅱ shRNA能抑制胃癌细胞的增殖、促进细胞的凋亡而对正常胃上皮细胞无明显的影响, 可能有以下原因: 首先, 癌细胞存在代谢酶谱的缺陷, 不能如正常细胞那样使用能源, 即使在有氧的情况下, 也是主要依靠糖酵解提供能源, 而HK-Ⅱ正是糖酵解的主要限速酶之一. 其次, 如前所述, HK-Ⅱ与肿瘤细胞的蛋白质代谢有关, 能促进癌细胞的蛋白合成, 抑制HK-Ⅱ后, 癌细胞可能出现蛋白匮乏而增殖受抑, 甚至死亡. 另外, HK-Ⅱ与线粒体结合可促进肿瘤细胞线粒体膜通透性降低, 从而抑制Bax、tBid诱导的细胞凋亡. 而沉寂HK-Ⅱ的表达可能使线粒体结合型HK-Ⅱ减少, 从而使线粒体的结构相对发生变化(MPTP开放)、通透性增高, 使线粒体内的促凋亡因子释放到胞质, 激活包括caspase-3在内的线粒体介导的细胞凋亡信号通路, 从而诱导细胞的凋亡[15,16].
总之, 利用shRNA表达载体, 在体内瞬时表达siRNA分子可以有效抑制HK-Ⅱ基因的表达. HK-Ⅱ shRNA沉寂HK-Ⅱ的表达能明显抑制人胃癌细胞增殖, 并且促进其的凋亡, 这为目前临床仍控制效果差的胃癌治疗提供了一个值得探索的方向.
目前研究表明, 生长迅速的肿瘤细胞不同于正常细胞, 其糖酵解主要是依靠HK-Ⅱ, 即肿瘤细胞中HK-Ⅱ活力显著增加; 且HK-Ⅱ不仅影响恶性肿瘤细胞的葡萄糖的代谢, 同时影响着恶性肿瘤细胞的增殖、凋亡. 胃癌是消化系最常见的恶性肿瘤, 严重危害人类的健康. 但目前沉寂HK-Ⅱ基因表达对胃癌细胞增殖、凋亡影响未见报道, HK-Ⅱ在胃癌治疗中的应用价值及前景不明.
高国全, 教授, 中山大学中山医学院生化系
Golshani-Hebroni等的研究发现, HK-Ⅱ和线粒体外膜蛋白的结合不但能让己糖激酶更好地利用ATP, 加速糖代谢, 调节葡萄糖消耗量和氧气之间的平衡, 而且能向线粒体提供更多的ADP而加速三羧酸循环.
通过观察沉寂HK-Ⅱ表达前后胃癌SGC7901及胃上皮GES-1细胞增殖、凋亡, 分析HK-Ⅱ对胃癌细胞增殖、凋亡的影响.
利用shRNA表达载体, 在体内瞬时表达siRNA分子可以有效抑制HK-Ⅱ基因的表达. HK-Ⅱ shRNA沉寂HK-Ⅱ的表达能明显抑制人胃癌细胞增殖, 并且促进其的凋亡, 这为目前临床仍控制效果差的胃癌治疗提供了一个值得探索的方向.
本文思路具有一定的创新性, 实验总体设计合理, 有一定的学术价值.
编辑 曹丽鸥 电编 何基才
| 1. | Mathupala SP, Rempel A, Pedersen PL. Glucose catabolism in cancer cells: identification and characterization of a marked activation response of the type II hexokinase gene to hypoxic conditions. J Biol Chem. 2001;276:43407-43412. [PubMed] [DOI] |
| 2. | Ko YH, Pedersen PL, Geschwind JF. Glucose catabolism in the rabbit VX2 tumor model for liver cancer: characterization and targeting hexokinase. Cancer Lett. 2001;173:83-91. [PubMed] [DOI] |
| 3. | Brown RS, Goodman TM, Zasadny KR, Greenson JK, Wahl RL. Expression of hexokinase II and Glut-1 in untreated human breast cancer. Nucl Med Biol. 2002;29:443-453. [PubMed] [DOI] |
| 4. | Mathupala SP, Rempel A, Pedersen PL. Glucose catabolism in cancer cells. Isolation, sequence, and activity of the promoter for type II hexokinase. J Biol Chem. 1995;270:16918-16925. [PubMed] |
| 5. | Rempel A, Mathupala SP, Perdersen PL. Glucose catabolism in cancer cells: regulation of the Type II hexokinase promoter by glucose and cyclic AMP. FEBS Lett. 1996;385:233-237. [PubMed] [DOI] |
| 7. | Gatenby RA, Gillies RJ. Why do cancers have high aerobic glycolysis? Nat Rev Cancer. 2004;4:891-899. [PubMed] [DOI] |
| 8. | Shinohara Y, Ichihara J, Terada H. Remarkably enhanced expression of the type II hexokinase in rat hepatoma cell line AH130. FEBS Lett. 1991;291:55-57. [PubMed] [DOI] |
| 9. | Rempel A, Bannasch P, Mayer D. Differences in expression and intracellular distribution of hexokinase isoenzymes in rat liver cells of different transformation stages. Biochim Biophys Acta. 1994;1219:660-668. [PubMed] |
| 10. | Johansson T, Berrez JM, Nelson BD. Evidence that transcription of the hexokinase gene is increased in a rapidly growing rat hepatoma. Biochem Biophys Res Commun. 1985;133:608-613. [PubMed] [DOI] |
| 11. | Shinohara Y, Ishida T, Hino M, Yamazaki N, Baba Y, Terada H. Characterization of porin isoforms expressed in tumor cells. Eur J Biochem. 2000;267:6067-6073. [PubMed] [DOI] |
| 12. | Golshani-Hebroni SG, Bessman SP. Hexokinase binding to mitochondria: a basis for proliferative energy metabolism. J Bioenerg Biomembr. 1997;29:331-338. [PubMed] [DOI] |
| 13. | Gelb BD, Adams V, Jones SN, Griffin LD, MacGregor GR, McCabe ER. Targeting of hexokinase 1 to liver and hepatoma mitochondria. Proc Natl Acad Sci U S A. 1992;89:202-206. [PubMed] [DOI] |
| 14. | Robey RB, Hay N. Mitochondrial hexokinases: guardians of the mitochondria. Cell Cycle. 2005;4:654-658. [PubMed] |
| 15. | Majewski N, Nogueira V, Robey RB, Hay N. Akt inhibits apoptosis downstream of BID cleavage via a glucose-dependent mechanism involving mitochondrial hexokinases. Mol Cell Biol. 2004;24:730-740. [PubMed] [DOI] |
| 16. | Majewski N, Nogueira V, Bhaskar P, Coy PE, Skeen JE, Gottlob K, Chandel NS, Thompson CB, Robey RB, Hay N. Hexokinase-mitochondria interaction mediated by Akt is required to inhibit apoptosis in the presence or absence of Bax and Bak. Mol Cell. 2004;16:819-830. [PubMed] [DOI] |
| 17. | Bassalyk LS, Ljubimova NV. Hexokinase isoenzymes in the diagnosis of gastric and esophageal neoplasms. Neoplasma. 1987;34:319-324. [PubMed] |
| 18. | Liubimova NV, Gorozhanskaia EG. [Several peculiarities of hexokinase of malignant and benign tumors in man]. Eksp Onkol. 1984;6:42-46. [PubMed] |
| 19. | Bassalyk LS, Liubimova NV. [Hexokinase in biopsy material from gastric neoplasms]. Vestn Akad Med Nauk SSSR. 1981;52-55. [PubMed] |