修回日期: 2010-04-29
接受日期: 2010-05-10
在线出版日期: 2010-06-18
目的: 检测肿瘤-睾丸抗原SPANX-C基因在肝细胞癌(HCC)中的表达, 预测SPANX-C/HLA-A2限制性CTL表位. 为HCC的免疫治疗寻找新的靶位.
方法: 用逆转录聚合酶链反应(RT-PCR)方法对HCC患者癌组织、相应癌旁组织和对照组织(肝硬化和正常肝组织)中的SPANX-C基因mRNA进行检测, 随机选取RT-PCR阳性扩增产物进行序列测定; 用超基序法和量化基序法联合预测SPANX-C/HLA-A2限制性CTL表位.
结果: 在所检测的115例HCC组织中有70例(60.9%)表达SPANX-C基因mRNA, 癌旁组织和20例对照肝组织均不表达. SPANX-C基因的表达与肿瘤分期、肿瘤分化程度、血清甲胎蛋白(AFP)水平等临床指标无相关性(P>0.05). 用基序预测法筛选出5个HLA-A2限制性CTL表位(9肽), 其中SPANX-C51-59 (LVVRYRRNV)与HLA-A2分子具有较高结合力.
结论: SPANX-C基因mRNA在HCC组织中呈高频率特异性表达, 并存在HLA-A2限制性CTL表位, 有望用于HCC的免疫治疗.
引文著录: 赵力, 牟东成, 彭吉润, 冷希圣. 肿瘤-睾丸抗原SPANX-C基因mRNA在肝细胞癌中的表达及HLA-A2限制性CTL表位的预测. 世界华人消化杂志 2010; 18(17): 1810-1814
Revised: April 29, 2010
Accepted: May 10, 2010
Published online: June 18, 2010
AIM: To investigate the expression of SPANX-C (sperm protein associated with the nucleus mapped to the X chromosome-C) gene in hepatocellular carcinoma (HCC) and to predict the HLA-A2-restricted cytotoxic T lymphocyte (CTL) epitopes of SPANX-C to find new targets for specific immunotherapy of HCC.
METHODS: The expression of SPANX-C mRNA was characterized by RT-PCR in tumor tissue and adjacent liver tissue specimens from 115 HCC patients and liver tissue specimens from 20 non-HCC patients (10 with liver cirrhosis and 10 without liver disease). The positive PCR products (297 bp) obtained from 5 tumor tissue specimens were randomly selected for sequencing to confirm the detecting results. HLA-A2-restricted CTL epitopes of SPANX-C were predicted by peptide supermotif prediction method in combination with quantitative motif method.
RESULTS: Seventy (60.9%) of 115 tumor tissue specimen from HCC patients expressed SPANX-C mRNA. In contrast, SPANX-C mRNA was not detected in tumor-adjacent tissue and liver tissue from non-HCC patients. There was no discernable correlation between SPANX-C expression and tumor stage, differentiation degree or serum α-fetoprotein level (all P > 0.05). Five CTL epitope candidates (nonamers) derived from the antigen SPANX-C were found by peptide supermotif prediction, of them, SPANX-C51-59 (LVVRYRRNV) may have stronger binding potential with HLA-A2 molecule.
CONCLUSION: SPANX-C mRNA is highly expressed in HCC tumor tissue in Chinese patients. SPANX-C may provide potential HLA-A2-restricted CTL epitopes as specific targets for immunotherapy of HCC.
- Citation: Zhao L, Mou DC, Peng JR, Leng XS. Expression of cancer-testis antigen SPANX-C mRNA in human hepatocellular carcinoma and prediction of HLA-A2-restricted CTL epitopes of SPANX-C. Shijie Huaren Xiaohua Zazhi 2010; 18(17): 1810-1814
- URL: https://www.wjgnet.com/1009-3079/full/v18/i17/1810.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i17.1810
人类肿瘤抗原研究一直是肿瘤免疫研究的热点之一. 一个理想的用于免疫治疗的肿瘤抗原, 必须是特异地、稳定地表达于肿瘤细胞内, 而不存在于正常组织中. 在众多肿瘤抗原中, 最吸引人的是肿瘤-睾丸抗原(cancer-testis antigen), 简称CT抗原, CT抗原仅在睾丸组织中表达或在极少数正常组织中弱表达, 而在人类多种组织学来源的肿瘤组织中表达增强. 睾丸组织因为缺乏人类白细胞抗原(human leukocyte antigen, HLA)分子, 其表达的CT抗原不会引起机体免疫反应. 而表达于肿瘤组织的CT抗原因含有相应的肿瘤抗原表位, 故能引起针对肿瘤的特异性免疫反应. 由于这种表达特点, 使CT抗原成为制备肿瘤多肽疫苗、诱导抗肿瘤细胞免疫应答的理想抗原[1,2]. SPANX-C(sperm protein associated with the nucleus mapped to the X chromosome-C)是从黑色素瘤细胞株中发现的一种CT抗原基因[3]. 为了探讨将该基因编码的多肽抗原用于肝癌免疫治疗的可能性, 我们对SPANX-C基因mRNA在肝细胞癌(hepatocellular carcinoma, HCC)患者肝癌组织中的表达情况进行了检测, 并采用超基序法和量化基序法, 对SPANX-C基因编码的、能被HLA-A2分子呈递的细胞毒T淋巴细胞(cytotoxic T lymphocyte, CTL)表位进行了预测.
北京大学人民医院肝胆外科中心手术治疗的HCC患者115例, 平均年龄47.6岁±8.4岁, 其中男98例, 女17例. 106例患者HbsAg阳性, 其中6例合并有HCV感染. 血清甲胎球蛋白(α-fetoprotein, α-FP)正常(<20 μg/L)或轻度升高(<40 μg/L)者38例, 其余77例均≥40 μg/L. 肿瘤分化程度为高、中、低者分别为20例、67例、28例; 肿瘤TNM分期为Ⅰ期者14例, Ⅱ期32例, Ⅲ期13例, Ⅳ期56例4; 手术中切取癌和癌旁组织各1份, 经液氮速冻后保存于-80 ℃冰箱备用; 所有癌和癌旁组织均经常规病理检查证实. 另取10例肝硬化患者的肝组织和10例非肝病患者的正常肝活检组织作为研究对照. 以正常睾丸组织作为阳性参照. 引物由上海基康生物技术有限公司设计并合成, TRIzol及RT-PCR试剂盒购于Gibco公司.
1.2.1 总RNA提取及cDNA合成: 取液氮中保存的标本约50-100 mg, 加入TRIzol 1 mL裂解. 参照说明书要求提取总RNA. 取总RNA 2.5 μg, 加入Oligo(dT)15及Superscript Ⅱ逆转录酶, 按照说明书要求合成cDNA.
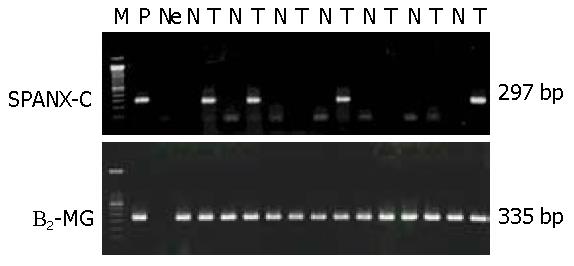
1.2.2 cDNA的PCR扩增(50 μL的反应体系): 取稀释5倍后的cDNA 5 μL, 加入10 μmol/L的外引物(5'-CTGCCCCAGACATTGAAGAA-3'和5'-TCCATGAATTCCTCCTCCTC-3')[3]各1 μL, 1 μL的10 mmol/L dNTPs, 2.5 U Taq多聚酶以及PCR缓冲液等. PCR反应按照以下条件进行: 94 ℃预变性5 min, 然后按94 ℃, 45 s; 57 ℃, 60 s; 72 ℃, 90 s的条件进行25个循环的扩增, 在72 ℃延伸8 min. 扩增片段长度为297 bp. 扩增内参照β2-微球蛋白cDNA, 以鉴定cDNA样品的质量[5]. 引物序列是: 5'-CTC GCG CTA CTC TCT CTT TCT GG -3'和5'-GCT TAC ATG TCT CGA TCC CAC TTA-3'(扩增片段为335 bp). 反应条件为预变性3 min, 然后按94 ℃, 45 s; 55 ℃, 45 s; 72 ℃, 45 s的条件进行28个循环的扩增, 在72 ℃延伸8 min.
1.2.3 扩增产物进行图像: 按文献报道的方法对扩增产物进行图像分析[5].
1.2.4 SPANX-C基因cDNA的序列测定: 随机选择5例SPANX-C呈阳性表达RT-PCR产物, 直接进行DNA序列测定(ABI PRISM® 3700 DNA Analyzer)(上海基康生物技术有限公司).
1.2.5 CTL表位预测: 登录GenBank, 获取SPANX-C基因编码的一级氨基酸序列. 首先按照超基序法扫描SPANX-C的氨基酸序列, 预选能与HLA-A2结合的9肽CTL表位, 即这些9肽的第二位氨基酸残基为V、 I、M、L、 T中的一种, 同时其第九位氨基酸残基为I、 L 、V、M、T中的一种[6]. 随后, 利用量化基序法对预选的表位进行量化处理, 即利用九肽矩阵计算每一个多肽与HLA-A2分子的结合系数, 以寻求结合最好的表位; 当结合系数大于或等于5, 可以确定为与HLA-A2分子结合稳定[7].
统计学处理 应用SPSS10.0软件进行χ2检验, P<0.05认为差异有显著性.
在115例HCC患者的癌组织中, SPANX-C基因mRNA呈阳性表达者为70例(60.9%), PCR产物电泳显示为297 bp, 与阳性对照大小一致(图1), 癌旁组织、肝硬化组织以及正常肝活检组织均未发现有SPANX-C基因的表达. 测序结果表明所得的RT-PCR产物与从GenBank检索的SPANX-C(AJ238277)扩增范围序列一致, 证实所得到的阳性RT-PCR产物确为SPANX-C基因的cDNA扩增片段.
肝癌组织中SPANX-C基因的表达与患者的年龄、性别、肿瘤TNM分期、分化程度、血清α-FP水平、HBV感染状况无显著相关性(P>0.05). 值得注意的是, 38例AFP正常(<20 μg/L)或轻度升高(<40 μg/L)的HCC患者中, 25例(65.8%)表达SPANX-C基因.
预选出5个符合P2(V, I, M, L, T)、P9(I, L, V, M, T)的SPANX-C/HLA-A2限制性CTL表位, 分别为: (1)EVNETMPET(20-28); (2)KMKTSESST(41-49); (3)KTSESSTIL(43-51); (4)LVVRYRRNV(51-59); (5)SVPCESNEV(13-21).
利用九肽结合系数运算, 我们发现1个结合系数大于5的HLA-A2限制性CTL表位, 即LVVRYRRNV(51-59), 结合系数是21.03.
选择合适的肿瘤抗原并把他们作为肿瘤疫苗的候选靶标, 一直是肿瘤免疫治疗的一个重要方向[8]. 近年来, 肿瘤特异性抗原方面的研究工作进展迅速, 这些抗原按照表达方式或结构特点可以分为以下几类: CT抗原, 自身免疫原性分化抗原, 突变基因产物, 过度表达的自体抗原, 剪接变异抗原以及病毒抗原等[9]. 其中, CT抗原被认为是肿瘤特异性的共享抗原, 也是最有希望作为免疫治疗靶点的一类抗原[10]. CT抗原首先于黑色素瘤中发现[11], 是一大类包含多个基因家族的肿瘤特异性抗原, 目前至少已有70个家族, 140多种基因[12]. 并且新的CT抗原仍在不断被发现[13-15].
SPANX-C属于SPANX(CT11)基因家族的成员, 为组织限制性表达CT基因. 该基因最初被命名为CTp11(cancer-testis-associated protein of 11 kDa), 是Zendman等3利用差异显示技术从黑色素瘤细胞株1F6m中发现一种CT抗原基因, 该基因位于Xq26.3-Xq27.1上, 全长408 bp, 编码蛋白的相对分子质量为11 kDa, 由97个氨基酸残基组成, 已证实SPANX-C在膀胱癌、乳腺癌、结肠癌、黑色素瘤、非小细胞肺癌等多种肿瘤中表达[10]. 该基因在睾丸组织中的正常表达参与精细胞有丝分裂周期的调控, 促精细胞发育成熟[16]. 但如同绝大多数CT抗原基因一样, 该基因在肿瘤中的作用尚不清楚.
目前, 关于SPANX-C基因在HCC中的表达情况国内外其他单位尚未见报道. 本研究结果显示, SPANX-C基因mRNA在HCC患者的肝癌组织中表达率高达60.9%, 而在癌旁组织、肝硬化和非肝病患者的正常肝活检组织中均不表达, 因此具有高度的特异性. 由于该基因在肝癌组织中具有如此高的特异性表达率, 因此, SPANX-C基因编码的抗原有可能作为潜在的攻击靶位, 用于肝癌的免疫治疗.
CT抗原之所以能诱导抗肿瘤细胞免疫应答, 是由于在这些抗原的氨基酸序列中, 具有能被特定的HLA分子呈递的抗原多肽(表位). 当肿瘤抗原多肽在抗原呈递细胞(antigen-presenting cell, APC)的作用下, 以HLA-多肽分子复合物的形式被呈递于APC细胞的表面时, 可被特异的CD8+ T淋巴细胞识别, 而使后者激活, 成为对肿瘤有特异性杀伤能力的CTL. 由于在我国HCC患者中HLA-A2的表达率高达53.5%[17], 因此预测能被HLA-A2分子呈递的限制性表位具有现实意义. 超基序法和量化基序法是预测HLA-A2限制性表位的两种基本方法, 我们通过超基序法预选出5个SPANX-C/HLA-A2限制性CTL表位(9肽), 通过量化基序法进一步从中筛选出SPANX-C51-59(LVVRYRRNV)的结合系数高达21.03, 因而在理论上与HLA-A2分子具有较高结合力, 有可能作为多肽疫苗, 用于肝癌的免疫治疗.
目前已有一些CT抗原(包括MAGE-1[18]、MAGE-3[19]与NY-ESO-1[20,21]等)应用于肿瘤免疫治疗并展示出了良好的前景, 但CT抗原在肿瘤免疫治疗中的应用受HLA类型的限制以及抗原异质性表达问题的制约, 因此寻找在肿瘤组织中高频率特异性表达的CT抗原作为研制多价瘤苗的备选抗原一直是CT抗原研究的热点之一. 我们的研究显示SPANX-C基因mRNA在HCC组织中呈高频率特异性表达, 并存在HLA-A2限制性CTL表位, 理论上是HCC的免疫治疗的理想靶位, 发展基于SPANX-C抗原的免疫治疗, 有望应用于半数以上的HCC患者, 若联合应用其他CT抗原(包括MAGE-1、MAGE-3与NY-ESO-1等)研制多价瘤苗, 将有利于机体免疫系统针对不同的抗原表位的刺激产生有效的、广谱的保护性免疫反应, 可能会解决肿瘤抗原异质性和抗原丢失性变体等问题.
我们的研究还发现SPANX-C基因的表达与患者的年龄、性别无关, 提示不同年龄、不同性别的患者肝癌组织中的SPANX-C基因表达没有特异性. Zendman等[3]发现在转移侵袭力高的黑色素瘤细胞株中SPANX-C的表达较高. Goydos等[22]发现SPANX-C基因的表达与黑色素瘤患者的临床分期有关, 表达率随分期进展降低. 而我们研究并未发现SPANX-C的表达与HCC患者的临床指标如肿瘤TNM分期、肿瘤分化程度的相关性, 提示SPANX-C的表达可能与HCC进展情况与恶性程度无关.
本研究并未发现SPANX-C的表达与HCC患者血清α-FP水平具有相关性, 但在α-FP阴性或轻度升高的HCC患者中, 有65.8%可检测到SPANX-C基因的表达, 提示在α-FP阴性的HCC患者中, 将SPANX-C基因mRNA作为肿瘤标志物, 也许还有助于提高α-FP阴性肝癌的诊断水平.
免疫治疗能够对肿瘤细胞进行特异性杀伤而可能成为肝癌理想的治疗手段, 而肿瘤细胞表达肿瘤特异性抗原是诱发肿瘤特异性免疫应答的前提. CT 抗原可作为靶点对肿瘤进行特异性的免疫治疗而不会对正常组织造成免疫损伤.目前以CT抗原肽为主组成的疫苗是肿瘤抗原疫苗应用的热点.
陈立波, 教授, 华中科技大学同济医学院附属协和医院肝胆外科中心.
CT抗原被认为是最有希望作为免疫治疗靶点的一类抗原. 但CT抗原在肿瘤免疫治疗中的应用受抗原异质性表达以及HLA类型的限制等问题的制约, 因此寻找在肿瘤组织中高频率特异性表达的CT抗原作为研制多价瘤苗的备选抗原一直是CT抗原研究的热点之一.
SPANX-C在睾丸组织中的正常表达参与精细胞有丝分裂周期的调控, 促精细胞发育成熟. 但如同绝大多数CT抗原基因一样, 该基因在肿瘤中的作用尚不清楚. Zendman等发现在转移侵袭力高的黑色素瘤细胞株中SPANX-C的表达较高. Goydos等发现SPANX-C基因的表达与黑色素瘤患者的临床分期有关, 表达率随分期进展降低.
本文用逆转录聚合酶链反应(RT-PCR)方法对HCC患者癌组织、相应癌旁组织和对照组织(肝硬化和正常肝组织)中的SPANX-C基因mRNA进行检测, 用超基序法和量化基序法联合预测SPANX-C/HLA-A2限制性CTL表位. 对肝癌免疫治疗具有潜在的应用价值.
SPANX-C基因mRNA在HCC组织中呈高频率特异性表达, 并存在HLA-A2限制性CTL表位, 有望用于HCC的免疫治疗.
本文初步研究了肝癌组织中SPANX-C的表达, 发现其具有较高的肿瘤特异性, 可能是肝癌免疫治疗的潜在靶点, 具有一定的学术价值.
编辑: 曹丽鸥 电编: 吴鹏朕
| 1. | Caballero OL, Chen YT. Cancer/testis (CT) antigens: potential targets for immunotherapy. Cancer Sci. 2009;100:2014-2021. [PubMed] [DOI] |
| 2. | Simpson AJ, Caballero OL, Jungbluth A, Chen YT, Old LJ. Cancer/testis antigens, gametogenesis and cancer. Nat Rev Cancer. 2005;5:615-625. [PubMed] [DOI] |
| 3. | Zendman AJ, Cornelissen IM, Weidle UH, Ruiter DJ, van Muijen GN. CTp11, a novel member of the family of human cancer/testis antigens. Cancer Res. 1999;59:6223-6229. [PubMed] |
| 4. | Greene FL. TNM staging for malignancies of the digestive tract: 2003 changes and beyond. Semin Surg Oncol. 2003;21:23-29. [PubMed] [DOI] |
| 5. | Mou DC, Cai SL, Peng JR, Wang Y, Chen HS, Pang XW, Leng XS, Chen WF. Evaluation of MAGE-1 and MAGE-3 as tumour-specific markers to detect blood dissemination of hepatocellular carcinoma cells. Br J Cancer. 2002;86:110-116. [PubMed] [DOI] |
| 6. | Parker KC, Bednarek MA, Coligan JE. Scheme for ranking potential HLA-A2 binding peptides based on independent binding of individual peptide side-chains. J Immunol. 1994;152:163-175. [PubMed] |
| 7. | Falk K, Rötzschke O, Stevanović S, Jung G, Rammensee HG. Allele-specific motifs revealed by sequencing of self-peptides eluted from MHC molecules. Nature. 1991;351:290-296. [PubMed] [DOI] |
| 8. | Old LJ. Cancer vaccines: an overview. Cancer Immun. 2008;8 Suppl 1:1. [PubMed] |
| 9. | Jäger D, Jäger E, Knuth A. Immune responses to tumour antigens: implications for antigen specific immunotherapy of cancer. J Clin Pathol. 2001;54:669-674. [PubMed] [DOI] |
| 10. | Scanlan MJ, Simpson AJ, Old LJ. The cancer/testis genes: review, standardization, and commentary. Cancer Immun. 2004;4:1. [PubMed] |
| 11. | van der Bruggen P, Traversari C, Chomez P, Lurquin C, De Plaen E, Van den Eynde B, Knuth A, Boon T. A gene encoding an antigen recognized by cytolytic T lymphocytes on a human melanoma. Science. 1991;254:1643-1647. [PubMed] [DOI] |
| 12. | Ghafouri-Fard S, Modarressi MH. Cancer-testis antigens: potential targets for cancer immunotherapy. Arch Iran Med. 2009;12:395-404. [PubMed] |
| 13. | Ajiro M, Katagiri T, Ueda K, Nakagawa H, Fukukawa C, Lin ML, Park JH, Nishidate T, Daigo Y, Nakamura Y. Involvement of RQCD1 overexpression, a novel cancer-testis antigen, in the Akt pathway in breast cancer cells. Int J Oncol. 2009;35:673-681. [PubMed] |
| 14. | Lin ML, Fukukawa C, Park JH, Naito K, Kijima K, Shimo A, Ajiro M, Nishidate T, Nakamura Y, Katagiri T. Involvement of G-patch domain containing 2 overexpression in breast carcinogenesis. Cancer Sci. 2009;100:1443-1450. [PubMed] [DOI] |
| 15. | Bettoni F, Filho FC, Grosso DM, Galante PA, Parmigiani RB, Geraldo MV, Henrique-Silva F, Oba-Shinjo SM, Marie SK, Soares FA. Identification of FAM46D as a novel cancer/testis antigen using EST data and serological analysis. Genomics. 2009;94:153-160. [PubMed] [DOI] |
| 16. | Zendman AJ, Zschocke J, van Kraats AA, de Wit NJ, Kurpisz M, Weidle UH, Ruiter DJ, Weiss EH, van Muijen GN. The human SPANX multigene family: genomic organization, alignment and expression in male germ cells and tumor cell lines. Gene. 2003;309:125-133. [PubMed] [DOI] |
| 17. | Peng JR, Chen HS, Mou DC, Cao J, Cong X, Qin LL, Wei L, Leng XS, Wang Y, Chen WF. Expression of cancer/testis (CT) antigens in Chinese hepatocellular carcinoma and its correlation with clinical parameters. Cancer Lett. 2005;219:223-232. [PubMed] [DOI] |
| 18. | Ge W, Hu PZ, Huang Y, Wang XM, Zhang XM, Sun YJ, Li ZS, Si SY, Sui YF. The antitumor immune responses induced by nanoemulsion-encapsulated MAGE1-HSP70/SEA complex protein vaccine following different administration routes. Oncol Rep. 2009;22:915-920. [PubMed] |
| 19. | Wieckowski EU, Visus C, Szajnik M, Szczepanski MJ, Storkus WJ, Whiteside TL. Tumor-derived microvesicles promote regulatory T cell expansion and induce apoptosis in tumor-reactive activated CD8+ T lymphocytes. J Immunol. 2009;183:3720-3730. [PubMed] [DOI] |
| 20. | Gnjatic S, Nishikawa H, Jungbluth AA, Güre AO, Ritter G, Jäger E, Knuth A, Chen YT, Old LJ. NY-ESO-1: review of an immunogenic tumor antigen. Adv Cancer Res. 2006;95:1-30. [PubMed] [DOI] |
| 21. | Ries J, Mollaoglu N, Vairaktaris E, Neukam FW, Nkenke E. Diagnostic and therapeutic relevance of NY-ESO-1 expression in oral squamous cell carcinoma. Anticancer Res. 2009;29:5125-5130. [PubMed] |
| 22. | Goydos JS, Patel M, Shih W. NY-ESO-1 and CTp11 expression may correlate with stage of progression in melanoma. J Surg Res. 2001;98:76-80. [PubMed] [DOI] |